Електролітична дисоціація Електролітична дисоціація- це розпад речовин на йони під час її розчинення або плавлення
Содержание
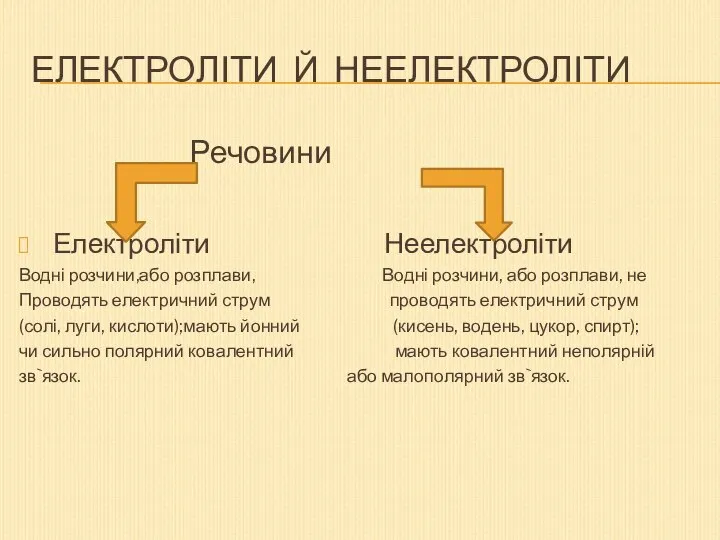
- 2. Електроліти й неелектроліти Речовини Електроліти Неелектроліти Водні розчини,або розплави, Водні розчини, або розплави, не Проводять електричний
- 3. Електроліти:
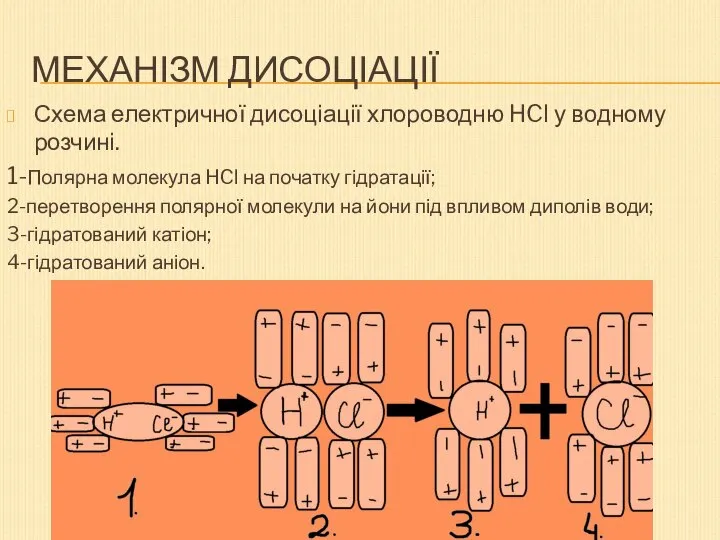
- 4. Механізм дисоціації Схема електричної дисоціації хлороводню HCl у водному розчині. 1-Полярна молекула HCl на початку гідратації;
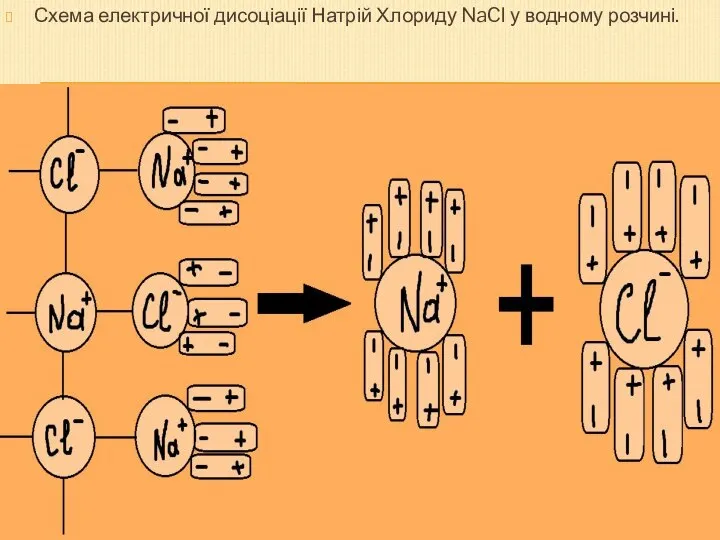
- 5. Схема електричної дисоціації Натрій Хлориду NaCl у водному розчині.
- 6. Механізм процесу електричної дисоціації Молекули розчинника відіграють важливу роль у процесі електролітичної дисоціації. Розглянемо на прикладі
- 7. Реакції обміну між розчинами електронів Реакції йонного обміну – хімічні реакції, що відбуваються у розчинах електролітів
- 9. Скачать презентацию



 Задача № 5 «Вероятность» Докладчик: Самунь Виктор
Задача № 5 «Вероятность» Докладчик: Самунь Виктор  Интегрированный урок: География с элементами физики
Интегрированный урок: География с элементами физики Магнитное поле
Магнитное поле Строение атома
Строение атома Структурные методы анализа
Структурные методы анализа Квантовая теория. Свойства операторов и принцип неопределенности Гейзенберга
Квантовая теория. Свойства операторов и принцип неопределенности Гейзенберга Механика – наука о движении
Механика – наука о движении Электризация тел и электрический заряд Первые уроки по электричеству. Автор – Ямбаршев Н.А., учитель физики МОУ ООШ д. П
Электризация тел и электрический заряд Первые уроки по электричеству. Автор – Ямбаршев Н.А., учитель физики МОУ ООШ д. П Магнітостатичні хвилі в дотично намагніченому феромагнітному шарі
Магнітостатичні хвилі в дотично намагніченому феромагнітному шарі Уравнение состояния идеального газа
Уравнение состояния идеального газа Применение аккумуляторов
Применение аккумуляторов Теория Максвелла. Вихревое электрическое поле. Ток смещения
Теория Максвелла. Вихревое электрическое поле. Ток смещения Последние достижения в области нанотехнологий
Последние достижения в области нанотехнологий Sensors and actuators
Sensors and actuators Электрический ток в жидкостях. Первый закон Фарадея
Электрический ток в жидкостях. Первый закон Фарадея Сравнительная характеристика методов нейтронного каротажа для определения водонасыщенной пористости
Сравнительная характеристика методов нейтронного каротажа для определения водонасыщенной пористости Типы камер сгорания и их сравнительная оценка
Типы камер сгорания и их сравнительная оценка Пространственная система сил
Пространственная система сил Цикл Карно. Теплота и работа. КПД цикла
Цикл Карно. Теплота и работа. КПД цикла Презентация по физике "Электроизмерительные приборы" - скачать
Презентация по физике "Электроизмерительные приборы" - скачать  Задачи к ГОСам. Ж. д. путь
Задачи к ГОСам. Ж. д. путь Жұқа қабыршақ (ұлпалардағы) интерференция. Бірдей қалыңдықтағы жолақтар. Интерференция құбылысының өндірісте қолдануы
Жұқа қабыршақ (ұлпалардағы) интерференция. Бірдей қалыңдықтағы жолақтар. Интерференция құбылысының өндірісте қолдануы Аттестационная работа. Проектная и исследовательская деятельность на уроках и во внеурочной работе по физике
Аттестационная работа. Проектная и исследовательская деятельность на уроках и во внеурочной работе по физике Презентація на тему: «Радіоактивність» Виконала: Коновалова Марина 11-А
Презентація на тему: «Радіоактивність» Виконала: Коновалова Марина 11-А  Дифракция света Дифракционная решетка МБОУ «СОШ №3» Богомолова Н. В.
Дифракция света Дифракционная решетка МБОУ «СОШ №3» Богомолова Н. В. Испытания, эксплуатация, техническое обслуживание металлорежущего оборудования
Испытания, эксплуатация, техническое обслуживание металлорежущего оборудования Поверхневий натяг рідини. Змочування. Капілярні явища
Поверхневий натяг рідини. Змочування. Капілярні явища Линзы. Собирающие и рассеивающие линзы
Линзы. Собирающие и рассеивающие линзы