Содержание
- 2. Энтропия в термодинамике TdS = dQ = dU + dA = (ivR/2)dT + PdV Энтропия появилась
- 3. В расчете на один моль вещества приращение энтропии составляет: dS = (iR/2)(dT/T) + (P/T)dV = (iR/2)(dT/T)
- 4. Уравнение состояния идеального газа PV = vRT позволяет переписать выражение для энтропии через разные параметры S=
- 5. Энтропия в термоднамике Чем полезна энтропия в термодинамике? Энтропия характеризует степень беспорядка в термодинамической системе Энтропия
- 6. Тепловая машина (двигатель) = устройство, совершающее механическую работу за счёт теплоты, получаемой от внешних источников. Тепловой
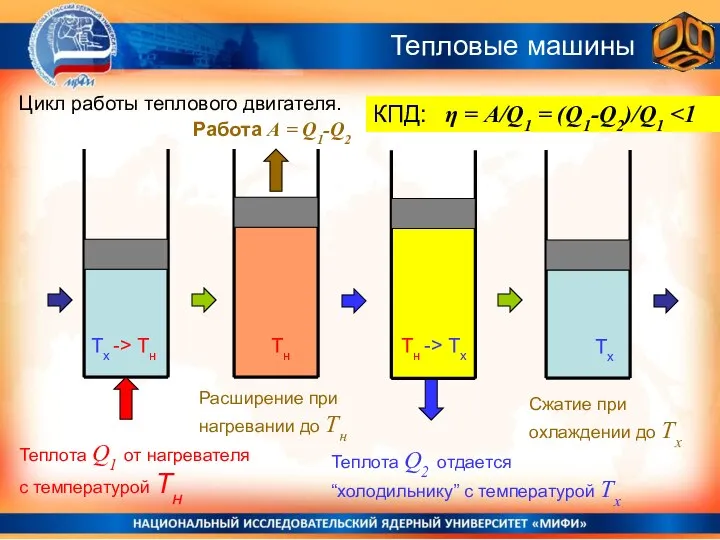
- 7. Цикл работы теплового двигателя. Работа А = Q1-Q2 Теплота Q1 от нагревателя с температурой Тн Тх
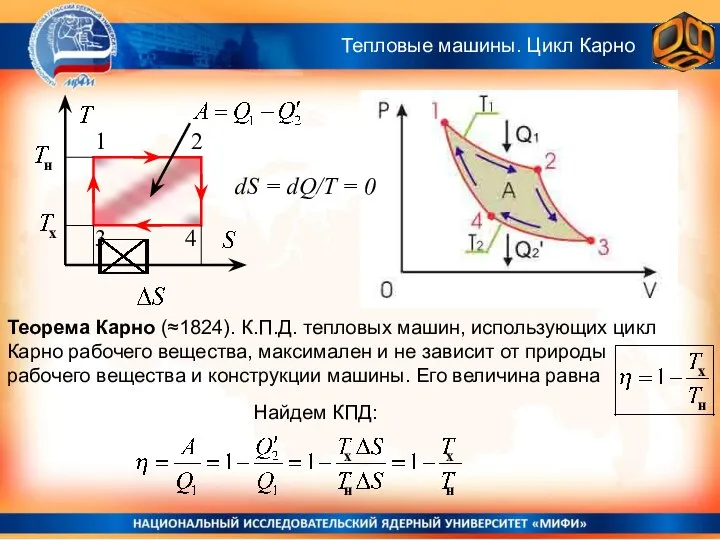
- 8. Цикл Карно идеального газа Тепловые машины. Цикл Карно Цикл Карно − это обратимый цикл, состоящий из
- 9. Теорема Карно (≈1824). К.П.Д. тепловых машин, использующих цикл Карно рабочего вещества, максимален и не зависит от
- 10. Теорема Карно (≈1824). К.П.Д. тепловых машин, использующих цикл Карно рабочего вещества, максимален. Как доказать это? Простейший
- 11. РЕШЕНИЕ: Работа производится только на двух изотермических участках и равна А = vRTHln(V2/V1) – vRTXln(V2/V1) =
- 12. РЕШЕНИЕ: УМК позволяет найти температуры всех точек: vRT1 = P1V1; vRT2 = P2V1; vRT3 = P2V2;
- 13. Для групп Б201, Б202 и ИНО: ДЗ на 9-13 апреля КО: 2.5. 1 – 12, 14,
- 14. Энтропия в термоднамике Чем полезна энтропия в термодинамике? Энтропия характеризует степень беспорядка в термодинамической системе Энтропия
- 15. Предоставленная сама себе, система ВСЕГДА переходит из более упорядоченного в менее упорядоченное (и оттого более вероятное)
- 16. Первый закон термодинамики (закон сохранения энергии) – запрещает возможность извлечения энергии из ничего. Вечный двигатель первого
- 17. ПРИМЕР: Расширение идеального газа в пустоту в теплоизолированном сосуде. V растёт S растёт Неравенство Клаузиуса –
- 18. Здесь Q1 − теплота, за цикл полученная, а Q2 − отданная. В соответствии с неравенством Клаузиуса,
- 19. Результаты, основанные на статистике Основное уравнение состояния идеального газа : Р = nkT Основное уравнение в
- 20. Основы молекулярной и статистической физики Лекция 07(10) Теория вероятностей и энтропия Лектор: Доцент НИЯУ МИФИ, к.ф.-м.н.,
- 21. Теория игр «Орлянка» - Eagle and Tails game Вероятности
- 22. Игры в «орлянку» и в «кости» ПРИМЕР 1: Бросаем монетку. Результат испытаний: тип 1 – если
- 23. Сложение и умножение вероятностей. Pi или k = Немного математики - вероятность P i или k
- 24. N – число испытаний, Ni – число испытаний с результатом типа i Рi – вероятность выпадения
- 26. Скачать презентацию





















 Молекулярно-кинетическая теория
Молекулярно-кинетическая теория Капиллярность. Капиллярные явления
Капиллярность. Капиллярные явления Молекулярно-кинетическая теория идеального газа
Молекулярно-кинетическая теория идеального газа Презентация по физике "Основные сведения о строении атомов" - скачать
Презентация по физике "Основные сведения о строении атомов" - скачать  Закон преломления
Закон преломления МКТ и термодинамика
МКТ и термодинамика Термодинамика и теплопередача. Первое начало термодинамики
Термодинамика и теплопередача. Первое начало термодинамики Плотность овощей и фруктов, выращиваемых на приусадебном участке МОУ “Средняя общеобразовательная школа № 1 с углублённым изучением английского языка”
Плотность овощей и фруктов, выращиваемых на приусадебном участке МОУ “Средняя общеобразовательная школа № 1 с углублённым изучением английского языка” Кинематика движения материальной точки
Кинематика движения материальной точки Спектроскопические и оптические методы исследования
Спектроскопические и оптические методы исследования Презентация по физике "Агрегатные состояния вещества 8 класс" - скачать
Презентация по физике "Агрегатные состояния вещества 8 класс" - скачать  Сложные (составные) оптические системы
Сложные (составные) оптические системы Кинематика. Основные понятия
Кинематика. Основные понятия Презентация по физике "Работа" - скачать
Презентация по физике "Работа" - скачать  КСЕ. Современные представления о пространстве и времени. Материя и ее свойства. (Лекция 3)
КСЕ. Современные представления о пространстве и времени. Материя и ее свойства. (Лекция 3) Применение УФЛ
Применение УФЛ Кең ауқымды вибратор
Кең ауқымды вибратор Законы Ньютона
Законы Ньютона Равноускоренное движение без начальной скорости. Лабораторная работа
Равноускоренное движение без начальной скорости. Лабораторная работа Prikladnaya_optika_Lektsia1_vvodnaya
Prikladnaya_optika_Lektsia1_vvodnaya Электростатическое поле в вакууме. Тема 1
Электростатическое поле в вакууме. Тема 1 Анализ отрасли «Металлургия»
Анализ отрасли «Металлургия»  Молекулярная физика и термодинамика. Статистический и термодинамический методы. (Лекция 5)
Молекулярная физика и термодинамика. Статистический и термодинамический методы. (Лекция 5) Генераторы переменного тока
Генераторы переменного тока Реактивное движение
Реактивное движение Дослідження потужності та ККД штучних джерел різного типу
Дослідження потужності та ККД штучних джерел різного типу Разборка, ремонт и сборка коробки передач автомобиля КамАЗ – 5320
Разборка, ремонт и сборка коробки передач автомобиля КамАЗ – 5320 Кинематика. Виды движения
Кинематика. Виды движения