Содержание
- 2. Масса фотона Масса покоя фотона равна нулю. Массу движущегося фотона найдем из закона взаимосвязи массы и
- 3. Импульс фотона
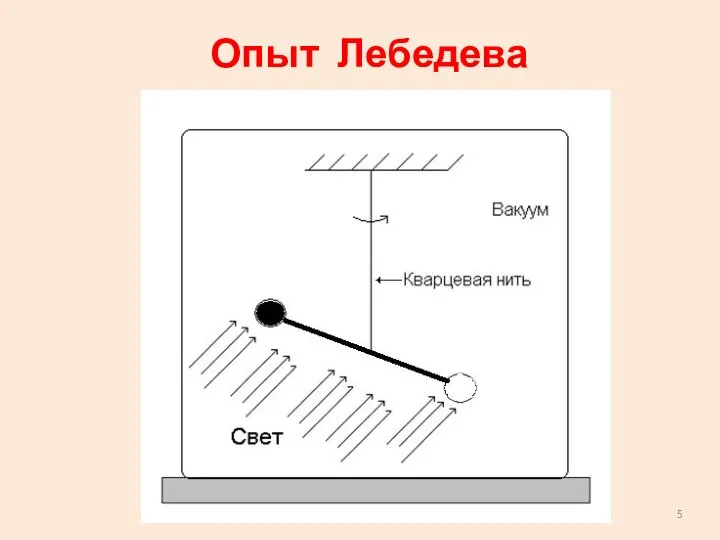
- 4. Давление света Петр Николаевич ЛЕБЕДЕВ (1866—1912) Основатель выдающейся школы физиков Московского университета. Блестящий экспериментатор. Первым измерил
- 5. Опыт Лебедева
- 6. Если в единицу времени на единицу площади поверхности с коэффициентом отражения ρ падает N фотонов, то
- 7. Е - энергия N фотонов, падающих на 1 м2 в 1 с. Давление света
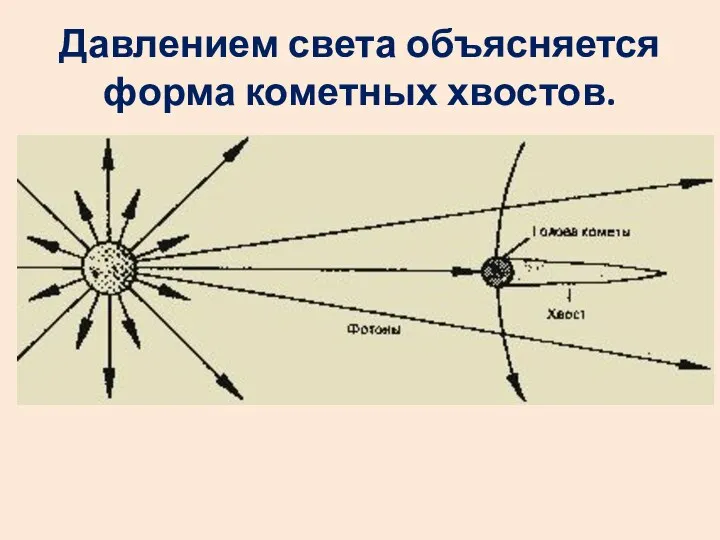
- 8. Давлением света объясняется форма кометных хвостов.
- 9. Солнечный парус
- 10. Гипотеза де Бройля В 1924 г. Луи де Бройль выдвинул гипотезу об универсальности корпускулярно-волнового дуализма: не
- 11. Связь величин, описывающих корпускулярные и волновые свойства частиц та же, что и для фотонов:
- 12. Длина волны де Бройля тем меньше, чем больше масса частицы и ее скорость. Пусть m =
- 13. Для электрона с энергиями от 10 эВ до 104 эВ длины волн де Бройля лежат в
- 14. Первое экспериментальное подтверждение гипотезы де Бройля было получено в 1927 году в опытах К. Дэвиссона и
- 15. Опыт В.А. Фабриканта (1949 г.)
- 16. Дифракция электронов при прохождении через очень тонкий слой серебра
- 17. Дифракция нейтронов
- 18. Соотношение неопределенностей Гейзенберга
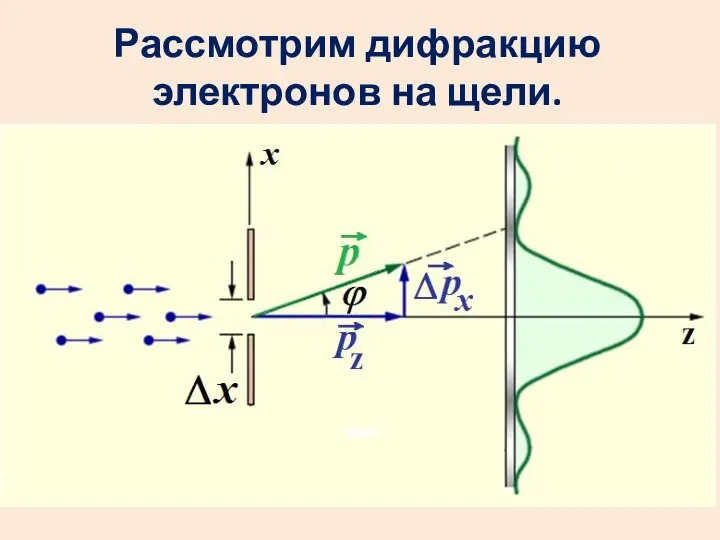
- 19. Рассмотрим дифракцию электронов на щели.
- 20. Пусть условно все электроны летят в центральный максимум. Координата х каждого электрона точно не известна. Неопределенность
- 21. Запишем условие первого минимума:
- 22. Получим: С учетом других максимумов произведение будет больше.
- 23. Соотношения неопределенностей Гейзенберга:
- 24. Для квантовой частицы неправомерно говорить об одновременных значениях ее координаты и импульса. Чем точнее определена какая-либо
- 25. Если ΔX→0, то ΔP→ Если ΔP→0, то ΔX→
- 26. Для энергии частицы W и времени: Если Δt→0, то ΔW→
- 27. ВОДОРОДОПОДОБНЫЕ АТОМЫ
- 28. Гипотеза о том, что вещества состоят из атомов, впервые была высказана Левкиппом и Демокритом примерно в
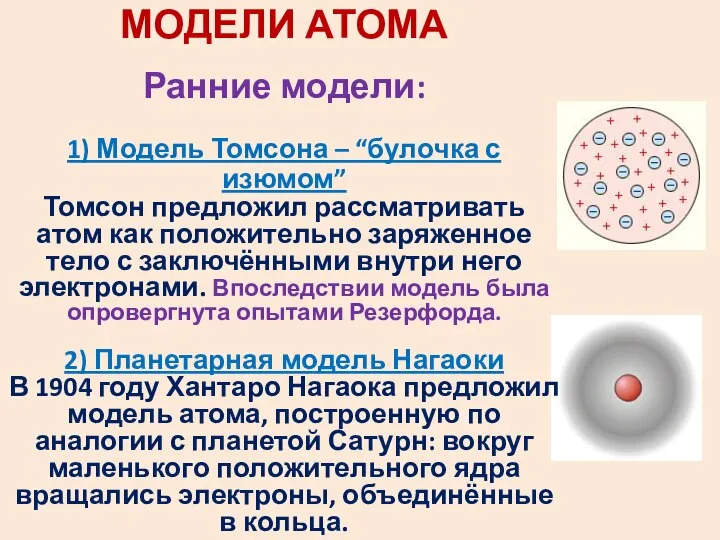
- 29. МОДЕЛИ АТОМА Ранние модели: 1) Модель Томсона – “булочка с изюмом” Томсон предложил рассматривать атом как
- 30. Опыт Резерфорда по рассеянию α-частиц Эрнст Резерфорд
- 31. Альфа-частица образована 2-мя протонами и 2-мя нейтронами, заряжена положительно. Идентична ядру атома гелия (4He2+).
- 32. Резерфорд направил поток α-частиц на золотую фольгу толщиной около 0,1 мкм. Большинство частиц пролетели сквозь фольгу,
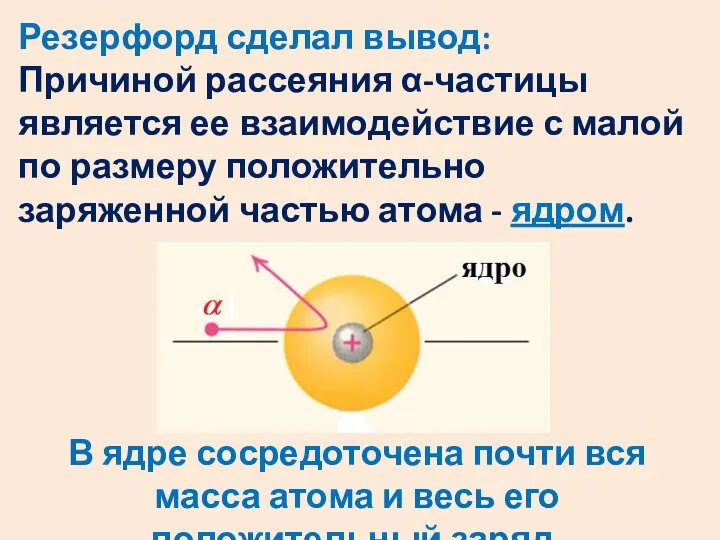
- 33. Резерфорд сделал вывод: Причиной рассеяния α-частицы является ее взаимодействие с малой по размеру положительно заряженной частью
- 34. Планетарная модель атома Резерфорда Атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам
- 35. Неустойчивость атома Резерфорда Согласно классической электродинамике электрон при движении с центростремительным ускорением должен излучать электромагнитные волны
- 36. Для объяснения стабильности атомов Нильсу Бору пришлось ввести особые предположения – постулаты.
- 37. Теория водородоподобного атома по Бору При построении теории Бор опирался на опыт Резерфорда и данные по
- 38. Водородоподобный атом – это атом с одним внешним электроном: Na, K, Rb, Cs. Спектр атома –
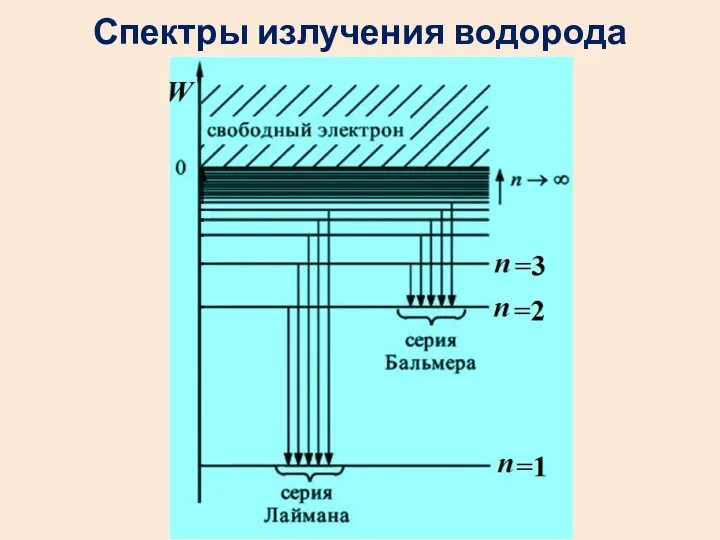
- 39. Спектр атома водорода образован сериями линий. Линии сгущаются к высокочастотной границе серии. В видимой области наблюдается
- 40. Бальмер подобрал формулу для частот спектральных линий: Для серии Бальмера m = 2, n = 3,
- 41. Постулаты Бора Атом может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует
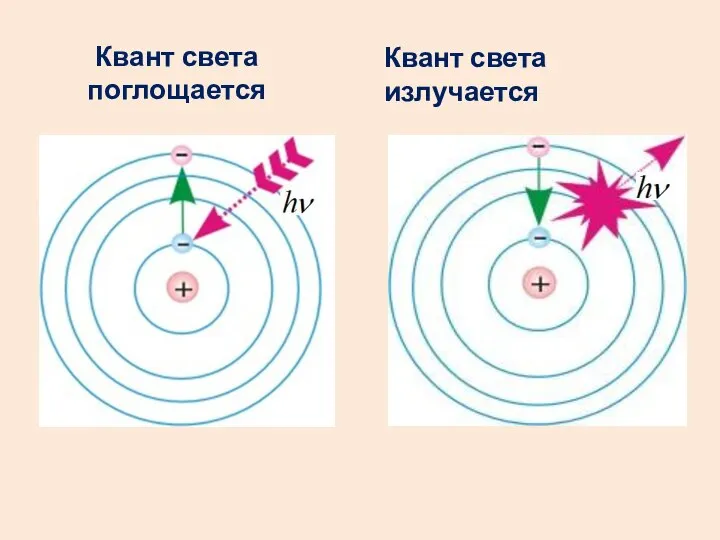
- 42. Второй постулат Бора (правило частот) При переходе атома из одного стационарного состояния с энергией Wn в
- 43. Квант света поглощается Квант света излучается
- 44. Третий постулат (квантование орбит) Момент импульса электрона в атоме принимает только дискретные значения, кратные постоянной Планка:
- 45. Бор вычислил радиусы орбит:
- 46. Радиус ближайшей к ядру орбиты называют первым боровским радиусом. заряд ядра,
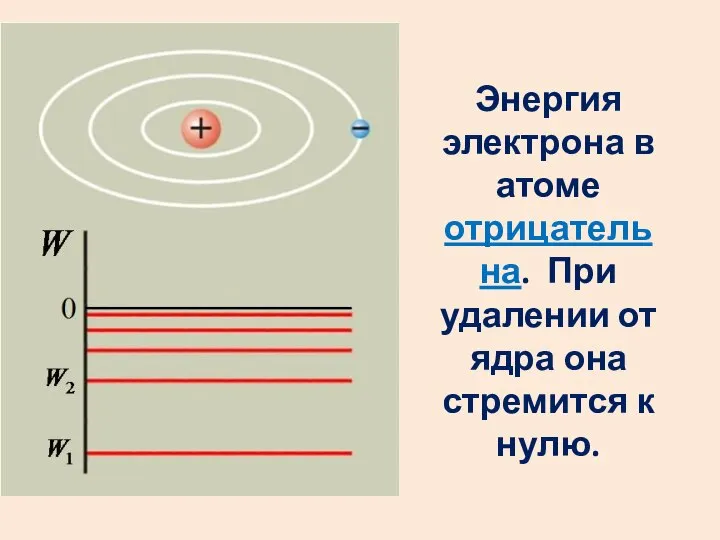
- 47. Полная энергия электрона в атоме: Энергия электрона на первой боровской орбите в атоме водорода:
- 48. Энергия электрона в атоме отрицательна. При удалении от ядра она стремится к нулю.
- 49. Частота излучения при переходе с n-го на m-й уровень энергии: R=3,3∙1015 Гц - частотная константа Ридберга,
- 50. Спектры излучения водорода
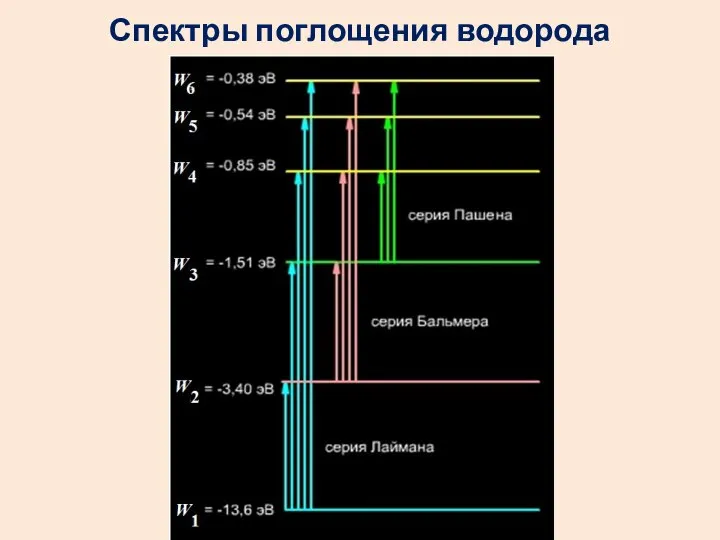
- 51. Спектры поглощения водорода
- 53. Скачать презентацию

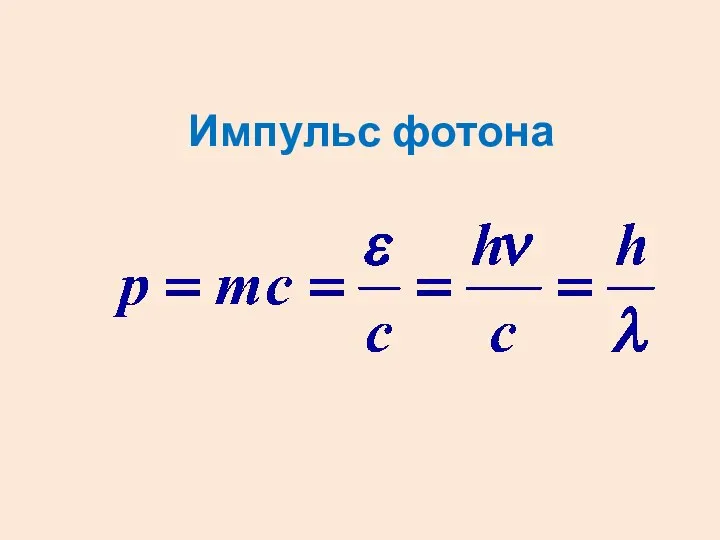


















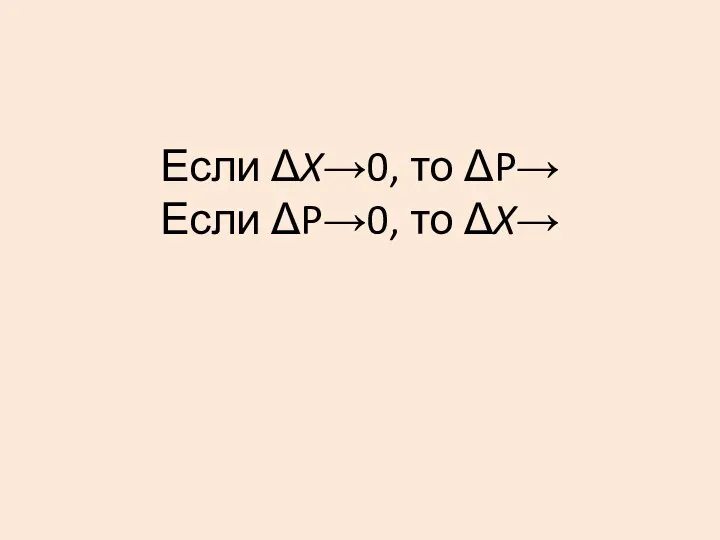




















 Закон Архимеда
Закон Архимеда Electricity in nature
Electricity in nature Електромагнітні коливання. Електричний коливальний контур. Коливальний контур
Електромагнітні коливання. Електричний коливальний контур. Коливальний контур Черникова Наталия Валентиновна учитель физики ГБОУ СОШ № 296 г. Москвы
Черникова Наталия Валентиновна учитель физики ГБОУ СОШ № 296 г. Москвы  Проверочные работы по физике для 7 – 8 класса (3 часть)
Проверочные работы по физике для 7 – 8 класса (3 часть) Инерциальные навигационные системы
Инерциальные навигационные системы Physical optics
Physical optics Закон Кулона
Закон Кулона infrakrasnoe_shishkina_izluenie_(1)[1]
infrakrasnoe_shishkina_izluenie_(1)[1] Люмінесценція
Люмінесценція  Судоремонтные предприятия
Судоремонтные предприятия Функціональні системи вертольота Ми-2. Гідравлічна система
Функціональні системи вертольота Ми-2. Гідравлічна система Понятие светового поля ( лекция 4 )
Понятие светового поля ( лекция 4 ) Решение задач по теме «Основы термодинамики»
Решение задач по теме «Основы термодинамики» Элементы квантовой механики. Лекция 12
Элементы квантовой механики. Лекция 12 Оптическая когерентная томография (ОКТ)
Оптическая когерентная томография (ОКТ) Презентация по физике "«Давление в жидкостях и газах»" - скачать
Презентация по физике "«Давление в жидкостях и газах»" - скачать  Какие бывают электростанции? Иванова Маша 10 класс
Какие бывают электростанции? Иванова Маша 10 класс  Аттестационная работа. Использование проектно - исследовательской деятельности на уроках физики
Аттестационная работа. Использование проектно - исследовательской деятельности на уроках физики Сходящаяся система сил
Сходящаяся система сил Презентация по физике "Формула Ньютона-Лейбница" - скачать
Презентация по физике "Формула Ньютона-Лейбница" - скачать  Тема: Взаємодія тіл. «Виштовхувальна сила. Закон Архімеда»
Тема: Взаємодія тіл. «Виштовхувальна сила. Закон Архімеда» Аттестационная работа. Методическая разработка по разделу физики сила трения в 9 классе
Аттестационная работа. Методическая разработка по разделу физики сила трения в 9 классе Магнитные свойства вещества
Магнитные свойства вещества РАБОТА И МОЩНОСТЬ ЭЛЕКТРИЧЕСКОГО ТОКА Ладанова Ирина Владимировна МБОУ «Верх-Жилинская ООШ» Косихинский район Алтайский край
РАБОТА И МОЩНОСТЬ ЭЛЕКТРИЧЕСКОГО ТОКА Ладанова Ирина Владимировна МБОУ «Верх-Жилинская ООШ» Косихинский район Алтайский край Воздушные стрелки. Схемы связи проводов цепных подвесок на воздушных стрелках
Воздушные стрелки. Схемы связи проводов цепных подвесок на воздушных стрелках ФИЗИКА ВНУТРИ НАС ИССЛЕДОВАТЕЛЬСКИЙ ПРОЕКТ
ФИЗИКА ВНУТРИ НАС ИССЛЕДОВАТЕЛЬСКИЙ ПРОЕКТ Физиология обменных процессов. (Лекция 17)
Физиология обменных процессов. (Лекция 17)