Содержание
- 2. Мгновенная скорость гомогенной реакции, т.е. скорость реакции в данный момент времени и соответственно при данной концентрации
- 3. Скоростью гетерогенной химической реакции определяется как изменение количества вещества, вступающего в реакцию или образующегося при реакции
- 4. Классификация химических реакций 1. Простые (элементарные) – реакции, которые осуществляются за однократное столкновение частиц. ↓ Молекулярность
- 5. 2. Сложные – реакции, протекающие более чем в одну стадию. Последовательные – вещества, образующиеся в результате
- 6. Скорость химической реакции зависит от : Природы реагирующих веществ; Концентрации реагирующих веществ; Температуры; Наличия катализатора; Величины
- 7. Влияние природы реагентов на скорость реакции Необходимое условие осуществления реакции – реагирующие частицы в момент столкновения
- 8. Зависимость скорости химической реакции от концентрации Закон действующих масс (ЗДМ): Скорость химической реакции при постоянной температуре
- 9. Зависимость скорости химической реакции от концентрации для простой реакции: Для газообразных веществ в закон действующих масс
- 10. Уравнения, связывающие скорость химической реакции с концентрациями, а также выражающие зависимость концентраций от времени, называются кинетическими
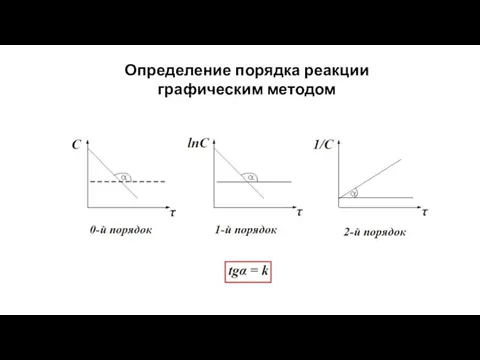
- 11. Определение порядка реакции графическим методом
- 12. Зависимость скорости химической реакции от температуры При повышении температуры скорость реакции, как правило, возрастает. Это обусловлено
- 13. Математическое выражение правила Вант-Гоффа: где υ1 и υ2 – скорости химической реакции, k2 и k1 -
- 14. уравнение Аррениуса: где k - константа скорости при температуре Т (в К), R – универсальная газовая
- 15. k2 и k1 - константы скоростей при температурах Т2 и Т1, соответственно. Расчет энергии активации Аналитический
- 16. Катализ Катализ – явление изменения скорости реакции в присутствии веществ, состояние и количество которых после реакции
- 17. Закономерности катализа Катализатор активно, за счет химических связей или электростатического взаимодействия участвует в элементарном акте реакции.
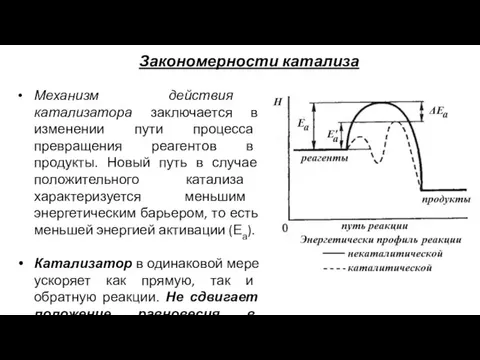
- 18. Закономерности катализа Механизм действия катализатора заключается в изменении пути процесса превращения реагентов в продукты. Новый путь
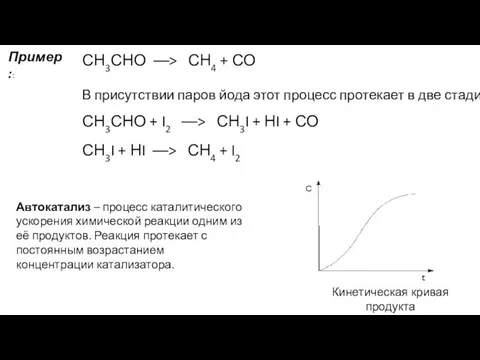
- 20. Пример:: СН3СНО ––> СН4 + СО В присутствии паров йода этот процесс протекает в две стадии:
- 21. Гетерогенный катализ Выделяют следующие стадии гетерогенной каталитической реакции: Подвод реагентов к границе раздела фаз Адсорбция Собственно
- 22. Ферментативный катализ Ферменты – вещества, катализирующие биохимические реакции в организмах. Ферменты являются полимерами (белками), или комплексами
- 23. Особенности ферментативных реакций Высокая селективность, комплементарность Чувствительность к pH Значительное уменьшение энергии активации Зависимость от наличия
- 24. Фотохимия Фотохимические реакции - реакции, в которых активация частиц является результатом их взаимодействия с квантами электромагнитного
- 26. Скачать презентацию




















 Техническое состояние и работоспособность автомобилей
Техническое состояние и работоспособность автомобилей А.В. Бурдаков. Физика плазмы
А.В. Бурдаков. Физика плазмы Дисперсия света. Дифракция света
Дисперсия света. Дифракция света Профессиональная направленность физики при подготовке обучающихся по профессии «Помощник машиниста локомотива»
Профессиональная направленность физики при подготовке обучающихся по профессии «Помощник машиниста локомотива» Презентация по физике "Сила. Сила тяжести" - скачать
Презентация по физике "Сила. Сила тяжести" - скачать  Фотоэлектронды көбейткіш, фототеристор, фототранзистор, оптотрон интегралды микросхема. Датчиктер – олардың түрлері
Фотоэлектронды көбейткіш, фототеристор, фототранзистор, оптотрон интегралды микросхема. Датчиктер – олардың түрлері История создания радио.
История создания радио.  Модели на основе ДУ в частных производных и метод конечных разностей
Модели на основе ДУ в частных производных и метод конечных разностей Производство, передача и использование электрической энергии
Производство, передача и использование электрической энергии Демонтаж систем охлаждения и смазки двигателей
Демонтаж систем охлаждения и смазки двигателей Основы активационного метода детектирования нейтронов
Основы активационного метода детектирования нейтронов АРАГО ДОМИНИК ФРАНСУА (Arago, Dominique Fran ois Jean) (1786–1853) выполнила Цыркина Н.Н
АРАГО ДОМИНИК ФРАНСУА (Arago, Dominique Fran ois Jean) (1786–1853) выполнила Цыркина Н.Н Рівномірний рух по колу
Рівномірний рух по колу Электричество и магнетизм. Лекция 7. Законы постоянного тока. Электрические схемы постоянного тока
Электричество и магнетизм. Лекция 7. Законы постоянного тока. Электрические схемы постоянного тока Георг Ом. Закон Ома для полной цепи
Георг Ом. Закон Ома для полной цепи Пневмоприводы. Их особенности и разновидности
Пневмоприводы. Их особенности и разновидности Примеры расчета индукции магнитного поля
Примеры расчета индукции магнитного поля Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов
Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов Машины постоянного тока. Устройство, материалы и принцип действия. Карточка 16
Машины постоянного тока. Устройство, материалы и принцип действия. Карточка 16 Рентгеновское излучение
Рентгеновское излучение Тема 3. Движение квазичастиц электронов в электрическом поле
Тема 3. Движение квазичастиц электронов в электрическом поле Кинематика точки
Кинематика точки Плоско-параллельное движение твердого тела
Плоско-параллельное движение твердого тела Презентация по физике "Сила Ампера" - скачать
Презентация по физике "Сила Ампера" - скачать  Химические реакторы
Химические реакторы Электрический ток в газах
Электрический ток в газах Инженерное образование на современном этапе
Инженерное образование на современном этапе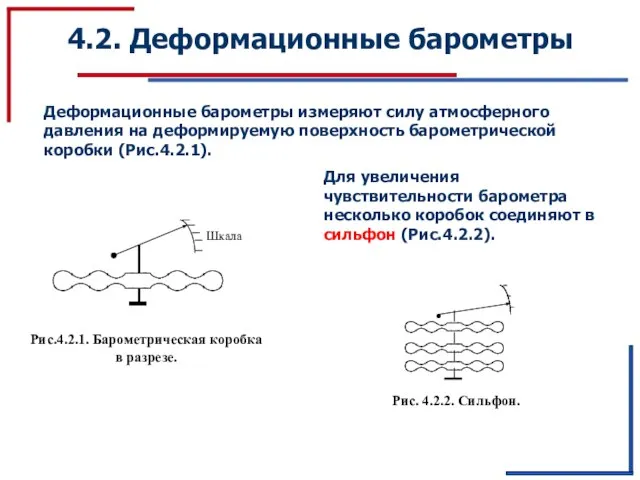 Презентация по физике "Деформационные барометры" - скачать
Презентация по физике "Деформационные барометры" - скачать