Содержание
- 2. Темы 5.3 - 5.4 5.3 Кинетическая модель гетерогенных химических процессов: Гетерогенный химический процесс с текучими фазами
- 3. Тема 5.3.1 Гетерогенный химический процесс с текучими фазами
- 4. Условия гетерогенного процесса параметры состояния каждой из фаз (температура, давление, катализатор, концентрации) параметры взаимодействия фаз (направление
- 5. Способы межфазного взаимодействия в системах Г-Ж и Ж-Ж а) барботаж – диспергирование газа в виде пузырей
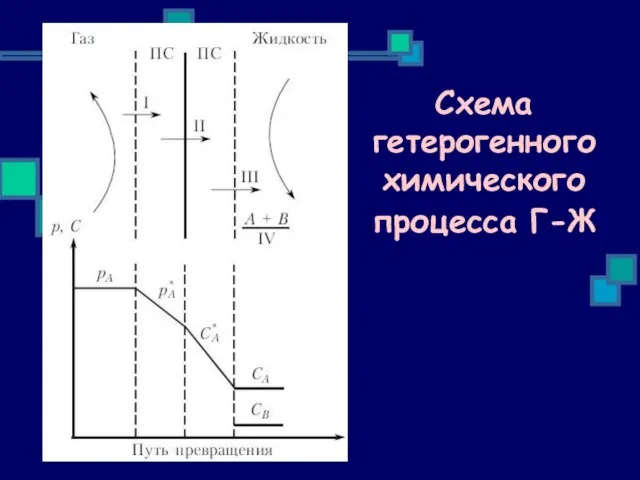
- 6. Схема гетерогенного химического процесса Г-Ж
- 7. Этапы гетерогенного химического процесса Г-Ж этап I – перенос компонента А из объёма газа через газовый
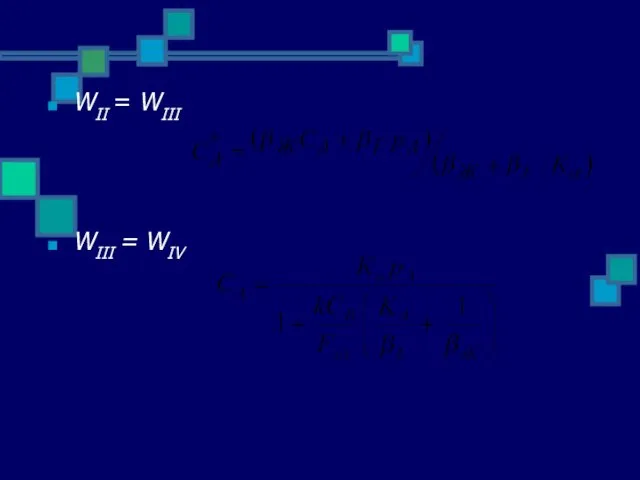
- 8. WII = WIII WIII = WIV
- 9. Зависимость концентрации компонента А в жидкой фазе от параметров системы Уравнение наблюдаемой скорости превращения
- 10. Кинетический режим - определяющей стадией является реакция с максимальной движущей силой (СА=Ка рА ) при WН
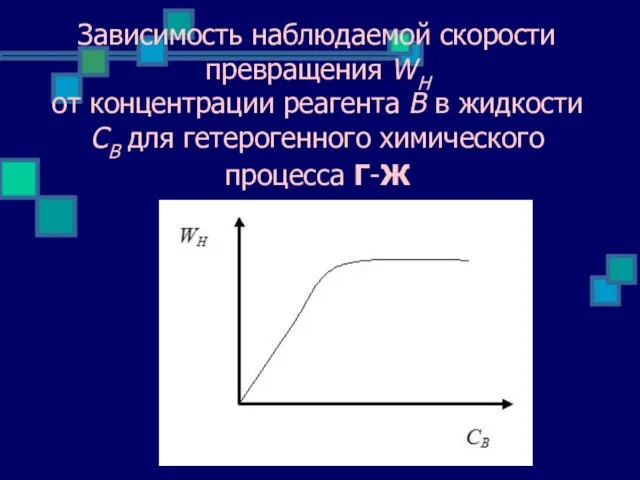
- 11. Зависимость наблюдаемой скорости превращения WН от концентрации реагента В в жидкости СВ для гетерогенного химического процесса
- 12. Тема 5.3.2 Гетерогенный химический процесс с твердым реагентом
- 13. «Сжимающаяся сфера» В результате превращения образуются только газообразные и жидкие продукты, переходящие в текучую фазу и
- 14. «Сжимающееся ядро» Кроме газообразных и жидких образуется твёрдый продукт, остающийся на поверхности твёрдого реагента и компенсирующий
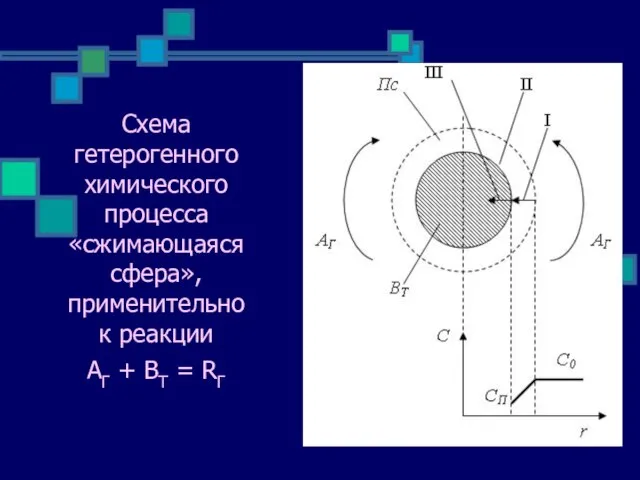
- 15. Схема гетерогенного химического процесса «сжимающаяся сфера», применительно к реакции АГ + ВТ = RГ
- 16. Стадии процесса «сжимающаяся сфера» Этап I. Перенос реагента А из потока к поверхности частицы через пограничный
- 17. Скорость уменьшения размера твёрдой частицы намного медленнее скорости распространения концентраций в пограничном слое Поток компонента А
- 18. Наблюдаемая скорость превращения для реакции первого порядка или Wн =- Kн С0
- 19. Изменение количества твёрдого компонента NВ в единицу времени νВ = νА = 1, WВ = WА
- 20. Время полного превращения (при τ= τк и r=0) τк = R0 n0/(Кн С0) Зависимость радиуса частицы
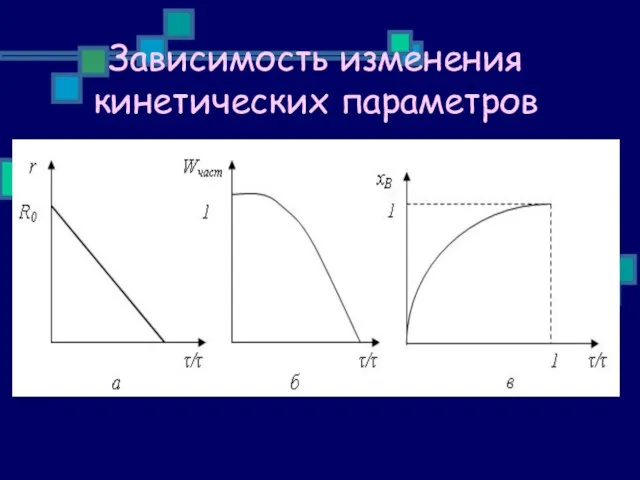
- 21. Зависимость степени превращения от изменения радиуса частицы Зависимость степени превращения от времени
- 22. Анализ гетерогенного процесса «сжимающаяся сфера» Если k Если k >> β, то k/β → ∞, то
- 23. Зависимость изменения кинетических параметров
- 24. Тема 5.4 Гетерогенный химический процесс с твёрдым катализатором
- 25. Катализ — изменение скорости химической реакции в присутствии веществ (катализаторов), многократно вступающих в промежуточное химическое взаимодействие
- 26. Процессы адсорбции и десорбции – необходимые стадии гетерогенных каталитических процессов. Если скорость гетерогенного каталитического процесса не
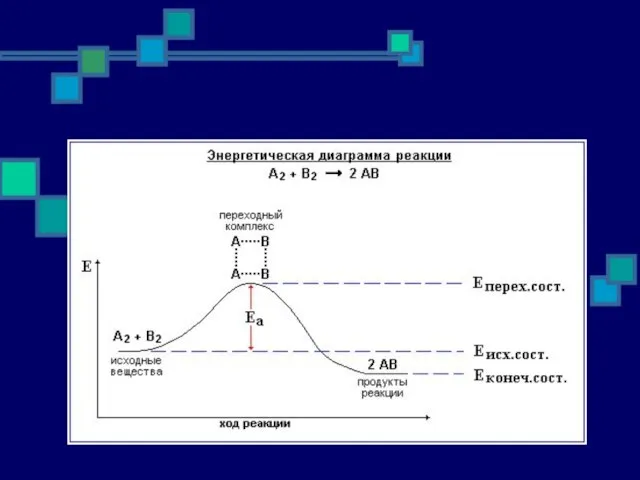
- 27. Активный комплекс - непрерывно изменяющееся переходное состояние, в котором после соударения исходных молекул происходит перераспределение электронной
- 29. Энергетический барьер реакции - разность между значениями средней энергии активных комплексов и исходных молекул. Снижения энергетического
- 30. Промежуточное соединение, в которое входит катализатор, превращается далее в продукты реакции через другой активный комплекс с
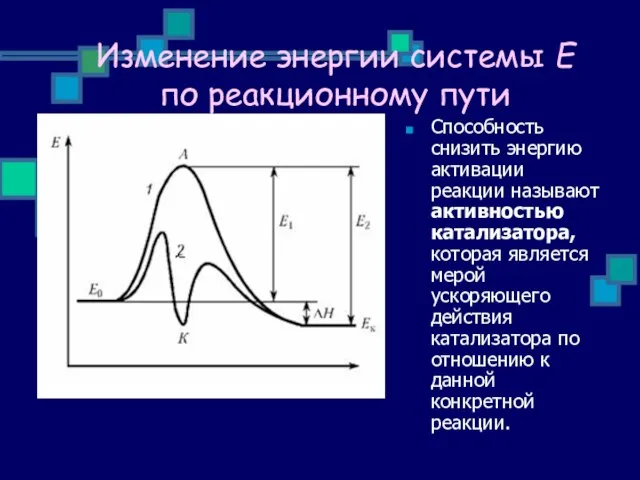
- 31. Изменение энергии системы Е по реакционному пути Способность снизить энергию активации реакции называют активностью катализатора, которая
- 32. В простых реакциях катализатор не влияет на равновесие системы, так как начальное и конечное состояния реагирующей
- 33. По фазовому состоянию каталитические реакции подразделяют на гомогенные, микрогетерогенные и гетерогенные. В гомогенном и микрогетерогенном катализе
- 34. Промышленные твердые катализаторы- сложная смесь (контактная масса), в составе которой выделяют собственно катализирующее вещество, носители, активаторы.
- 35. Показатели, характеризующие эксплуатационную ценность промышленных катализаторов 1) активность — мера ускоряющего действия катализатора по отношению к
- 37. Скачать презентацию



























 Столкновения Абсолютно упругий удар
Столкновения Абсолютно упругий удар  Базовая электрика. Основы
Базовая электрика. Основы Тема 3: ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ 3.1. ЭНЕРГИЯ И ЭНТРОПИЯ Второй закон устанавливает, что самопроизвольные процессы возможн
Тема 3: ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ 3.1. ЭНЕРГИЯ И ЭНТРОПИЯ Второй закон устанавливает, что самопроизвольные процессы возможн Спектроскопия органических соединений
Спектроскопия органических соединений Соединение проводников
Соединение проводников Динамика судна. Общие понятия гидромеханики
Динамика судна. Общие понятия гидромеханики Прямолинейное и криволинейное движение. Движение тела по окружности
Прямолинейное и криволинейное движение. Движение тела по окружности Управління потоками реактивної енергії (вибір потужності компенсуючих установок та їх розміщення у системі електропостачання)
Управління потоками реактивної енергії (вибір потужності компенсуючих установок та їх розміщення у системі електропостачання) « МОУ Липковская Средняя Школа №3» Презентация на тему: « Диффузия» ПОДГОТОВИЛИ: НИКИТИНА НАДЕЖДА И ХАЛИМОВА ЕКАТЕРИНА
« МОУ Липковская Средняя Школа №3» Презентация на тему: « Диффузия» ПОДГОТОВИЛИ: НИКИТИНА НАДЕЖДА И ХАЛИМОВА ЕКАТЕРИНА Электр тізбектеріндегі өтпелі үрдістер
Электр тізбектеріндегі өтпелі үрдістер Законы постоянного тока
Законы постоянного тока Плавление тел
Плавление тел Сила трения
Сила трения Лазер. Области применения лазеров
Лазер. Области применения лазеров Arduino. Электрическая схема
Arduino. Электрическая схема Задачи по физике
Задачи по физике харчування під час радіоактивної небезпеки Підготувала учениця 302 групи Авіакосмічного ліцею ім.І.Сікорського НАУ Гріднєва А
харчування під час радіоактивної небезпеки Підготувала учениця 302 групи Авіакосмічного ліцею ім.І.Сікорського НАУ Гріднєва А Методы травления материалов электронной техники
Методы травления материалов электронной техники Электрические цепи постоянного тока
Электрические цепи постоянного тока Энергетические ресурсы Мирового океана
Энергетические ресурсы Мирового океана Макс Планк Презентация по физике ученицы 12а класса Рижской Гризинькалнской средней шк. им. И. Г. Гердера Максимовой Татьяны
Макс Планк Презентация по физике ученицы 12а класса Рижской Гризинькалнской средней шк. им. И. Г. Гердера Максимовой Татьяны  Уравнение адиабатического процесса для идеального газа
Уравнение адиабатического процесса для идеального газа Закон Архимеда
Закон Архимеда Турбины ТЭС и АЭС. Теория теплового процесса. Основные уравнения теории
Турбины ТЭС и АЭС. Теория теплового процесса. Основные уравнения теории Вес тела
Вес тела Парообразование. Конденсация
Парообразование. Конденсация Презентация по физике "Физика-наука о природе" - скачать
Презентация по физике "Физика-наука о природе" - скачать  Презентация по физике на тему «Производство электроэнергии. Передача электроэнергии на расстоянии.» Ученицы 9 класса «В» Зениной
Презентация по физике на тему «Производство электроэнергии. Передача электроэнергии на расстоянии.» Ученицы 9 класса «В» Зениной