Содержание
- 2. ОБЩИЕ АСПЕКТЫ СПЕКТРОСКОПИИ
- 3. СПЕКТР ЭЛЕКТРОМАГНИТНЫХ ВОЛН
- 4. Характеристики электромагнитного излучения Частота излучения(ν) [c-1] Длинна волны (λ) [м] Волновое число (ν~ ) [м-1] Скорость
- 5. КВАНТОВАНИЕ ИЗЛУЧЕНИЯ Постулат Планка: излучение распространяется в пространстве и времени не непрерывным потоком, а отдельными порциями
- 6. Основные взаимосвязи между характеристиками излучения С = λν (2) ν~ = 1/λ (3) Е = hν
- 7. Происхождение спектров
- 8. Составляющие энергии молекулы Емол = Еэл + Екол + Евр Емол - энергия молекулы; Еэл –
- 9. Иерархия энергетических уровней молекулы
- 10. Разновидности спектральных методов
- 11. УФ и видимая – спектроскопия (UV-VIS)
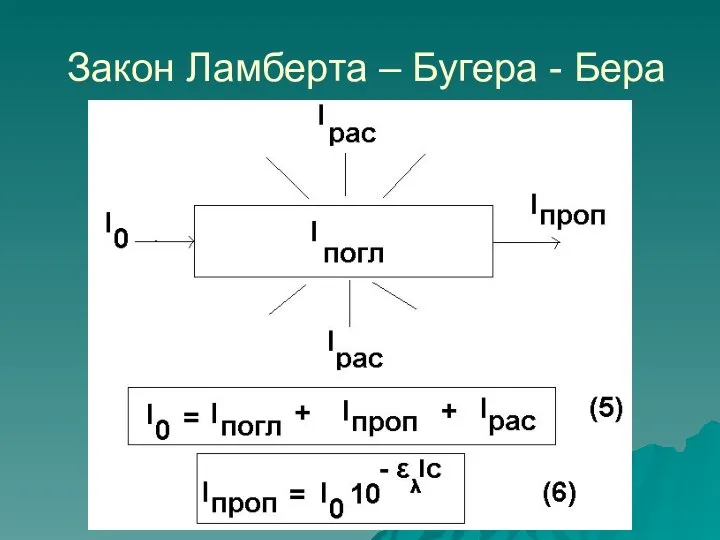
- 12. Закон Ламберта – Бугера - Бера
- 14. Оптическая плотность и пропускание Оптическая плотность A = lg(I0/I) Пропускание Т = I/I0 Закон Ламберта –
- 15. Закон Бугера – Ламберта – Бера справедлив: Для монохроматического света, т.е. света с постоянной длиной волны.
- 16. УФ - видимым спектром называется зависимость оптической плотности поглощения вещества или молярного коэффициента поглощения от длины
- 17. Характеристики полос поглощения в УФ - спектрах
- 18. Классификация полос поглощения по интенсивности 1. Интенсивное поглощение (ελ > 104); 2. Поглощение средней интенсивности (103
- 19. Основные определения Под влиянием различных факторов (изменение заместителей, растворителя, температуры) возможно изменение как интенсивности поглощения, так
- 21. Качественный анализ в УФ - спектроскопии
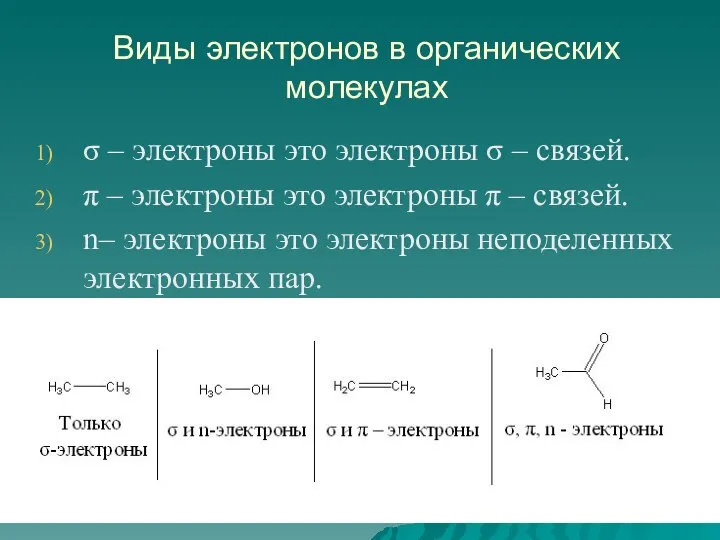
- 22. Виды электронов в органических молекулах σ – электроны это электроны σ – связей. π – электроны
- 23. Диаграмма энергетических уровней
- 24. Соотношение энергий электронных переходов
- 25. Спектроскопия УФ- и видимого диапазона Общая картина переходов
- 26. Спектроскопия УФ- и видимого диапазона Общая картина переходов
- 27. По причине поглощения кислорода и азота атмосферы при длинах волн меньших 180нм УФ и видимые –
- 28. σ-σ* - переходы Требуют значительного количества энергии, проявляются при наиболее коротких волнах в дальней УФ –
- 29. n-σ* - переходы Характерны для насыщенных органических соединений, содержащих гетероатомы: галогенопроизводных, спиртов, аминов, тиолов, сульфидов и.т.д.
- 30. 3) Чем меньше разница в энергиях σ* и n – уровней, тем в более длинноволновой области
- 32. Определения Хромофор – ковалентно ненасыщенная группа обуславливающая поглощение (С=С, С=О, С=NН, С≡N). Ауксохром – насыщенная группа,
- 33. Хромофоры: 1) Обуславливают интенсивное поглощение за счет реализации π - π* - переходов. 2) Если строение
- 35. Поглощение обусловленное изолированными хромофорами Поглощение изолированных (несопряженных) хромофоров характеристично. УФ – спектр молекулы, содержащей только изолированные
- 38. Типы полос поглощения в УФ-спектрах R-полосы Обусловлены запрещенным n - π* - переходом. Малоинтенсивны (ελ Проявляются
- 39. К-полосы Обусловлены разрешенными π - π* - переходами. Высокоинтенсины (ελ > 104 ) Проявляются при меньших
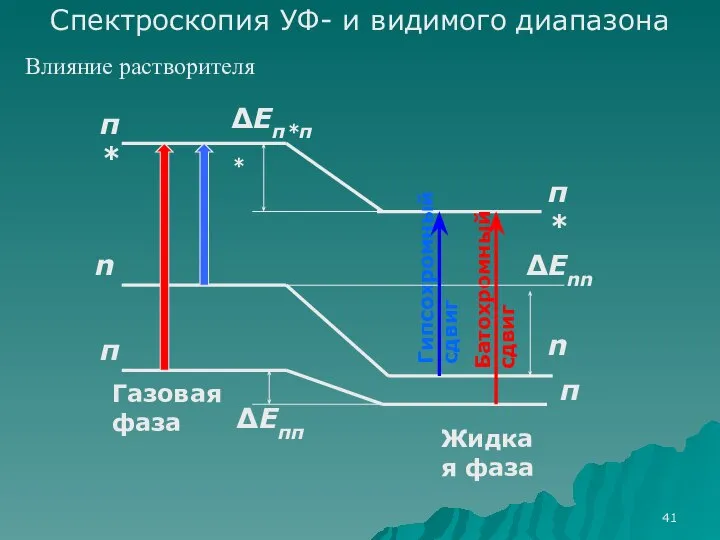
- 41. π π* π* π n n Газовая фаза Жидкая фаза Батохромный сдвиг Гипсохромный сдвиг ΔEππ ΔEπ*π*
- 42. 230 237 238 244 λ, нм 305 312 315 326 327 λ, нм гексан диэтиловый эфир
- 44. В и Е полосы Являются специфическими и проявляются в ароматических соединениях (бензолах). Обусловлены π– π* -
- 45. Орбитали π – сопряженных систем 1) Являются решениями уравнения Шредингера для молекулы: Нψ = Еψ 2)
- 46. А) Ациклические π-системы Число орбиталей равно числу атомов находящихся в сопряжение. Каждый атом углерода сопряженной системы
- 47. 5) Чем больше протяженность π – системы, тем меньше различие в энергиях π-орбиталей, входящих в сопряженную
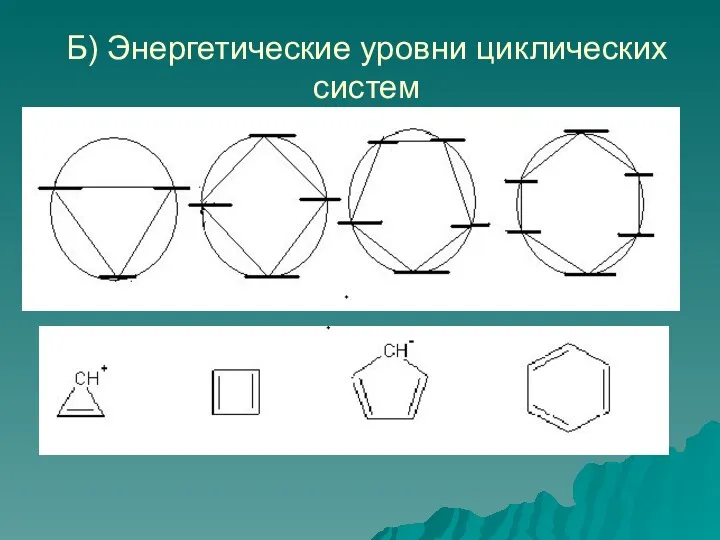
- 49. Б) Энергетические уровни циклических систем
- 50. Поглощение сопряженных хромофоров Эффект сопряжения приводит к уменьшению энергетической щели между ВЗМО и НСМО и способствует
- 51. Этиленовый хромофор Этилен имеет две области поглощения: интенсивное при 165нм и малоинтенсивное при 200нм. Такое поглощение
- 52. Введение ауксохромов приводит к батохромному сдвигу с гиперхромным эффектом, причем тем большим по величине, чем больше
- 53. 4) Индуктивный эффект и эффект гиперконьюгации способствуют батахромному сдвигу с гиперхромным эффектом. Вопрос лишь в соотношении
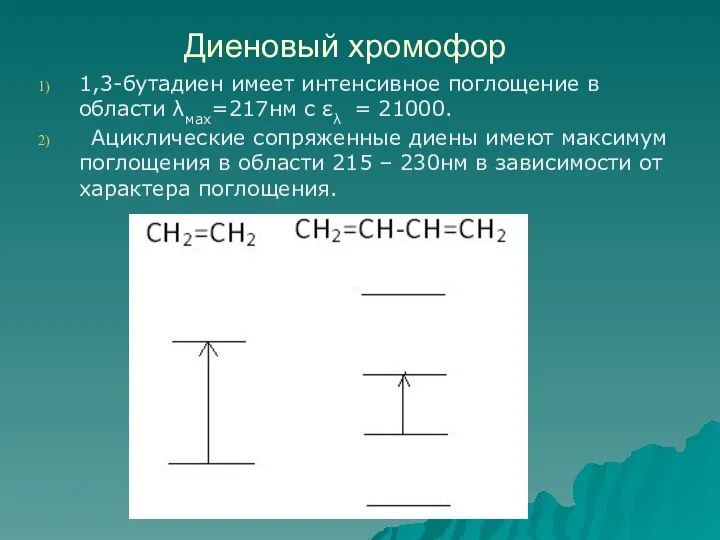
- 54. Диеновый хромофор 1,3-бутадиен имеет интенсивное поглощение в области λмах=217нм с ελ = 21000. Ациклические сопряженные диены
- 55. Правила Вудворда 1) Введение каждой алкильной группы в диеновый хромофор приводит к батохромному сдвигу полосы поглощения
- 56. Примеры применения правила Вудворда
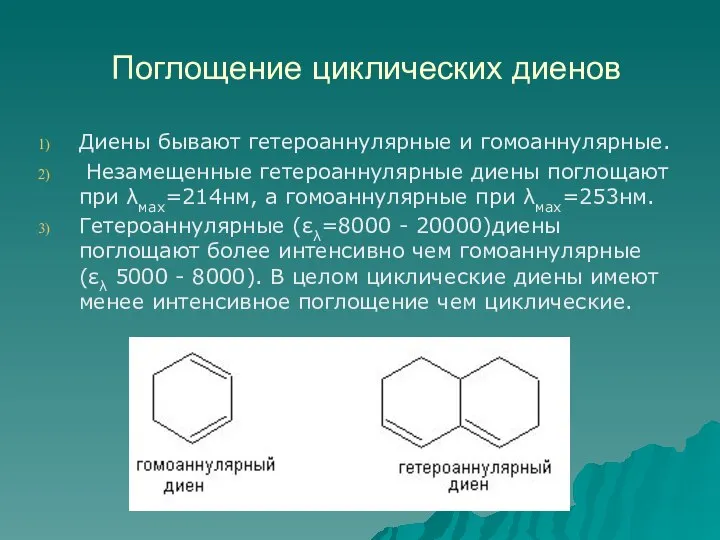
- 58. Поглощение циклических диенов Диены бывают гетероаннулярные и гомоаннулярные. Незамещенные гетероаннулярные диены поглощают при λмах=214нм, а гомоаннулярные
- 59. Инкременты для расчета поглощения циклических диенов
- 60. Карбонильный хромофор Карбонильный хромофор проявляет две полосы поглощения, коротковолновую обуславливает π-π* - переход (К-полоса около 190нм),
- 62. 3) Наибольшее значение для идентификации карбонильных соединений имеет R- полоса. Замещение атомов водорода на алкильную или
- 63. H H λ,нм 204 214 235 275 290 295 290 275 235 214 204 CH3 CH3
- 64. Еноновый хромофор Еноновый хромофор обладает длинноволновой R-полосой (310-330нм) низкой интенсивности и интенсивной К-полосой (215-250нм, ελ=10000 –
- 66. > C=C - связь π π* > C=O - связь π π* Сопряжение > C=C-C=O π
- 68. Примеры УФ - спектров
- 69. Спектроскопия УФ- и видимого диапазона Правило Вудворда и Физера
- 70. Бензойный хромофор Незамещенный бензол имеет три полосы поглощения (Е1,Е2,В), обусловленные π - π* -переходами, две из
- 71. Энергетические уровни бензола
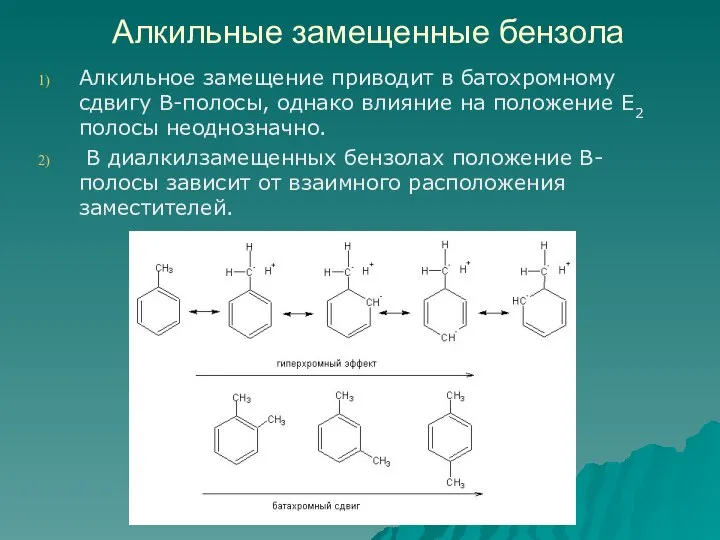
- 75. Алкильные замещенные бензола Алкильное замещение приводит в батохромному сдвигу В-полосы, однако влияние на положение Е2 полосы
- 76. Ауксохромное замещение 1) Ауксохромное замещение приводит к батахромному сдвигу как В, так и Е2-полосы. 2) Поглощение
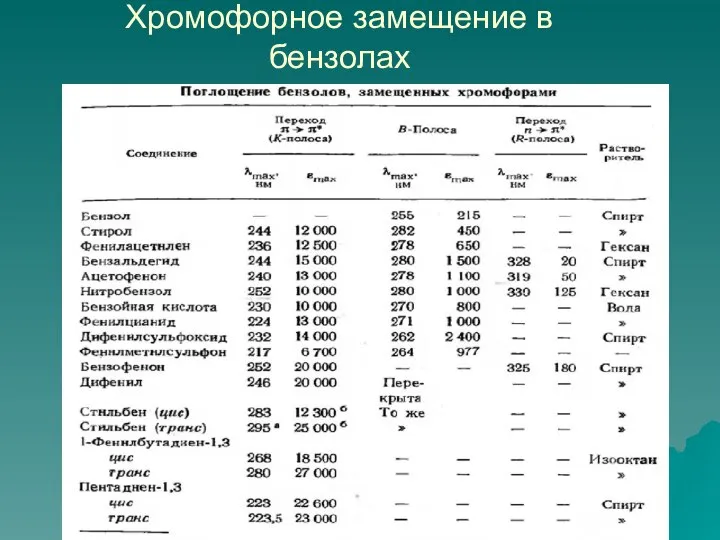
- 80. Хромофорное замещение в бензолах
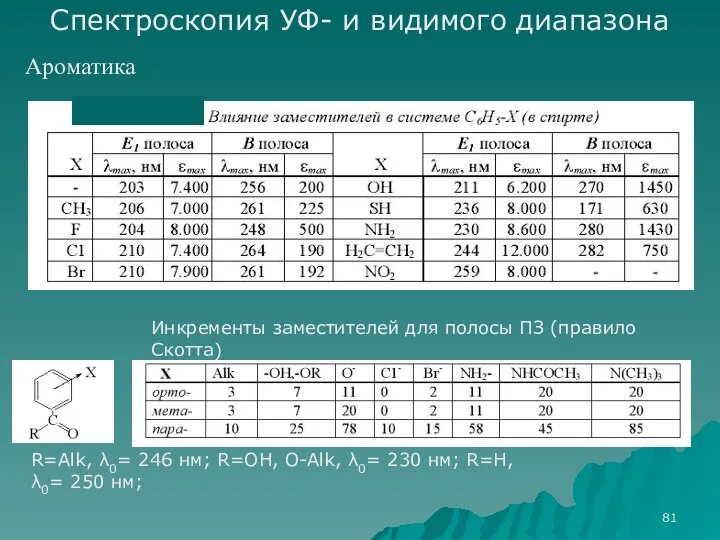
- 81. Спектроскопия УФ- и видимого диапазона Ароматика Инкременты заместителей для полосы ПЗ (правило Скотта) R=Alk, λ0= 246
- 82. Спектроскопия УФ- и видимого диапазона N-содержащие соединения.
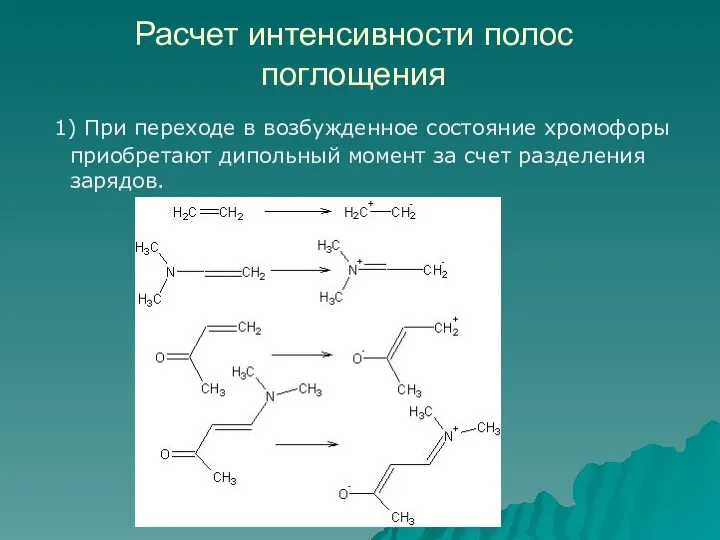
- 83. Расчет интенсивности полос поглощения 1) При переходе в возбужденное состояние хромофоры приобретают дипольный момент за счет
- 86. 2) Разрешенным переходом называется такой переход, для которого квадрат дипольного момента перехода не равен нулю. А)
- 87. Сила осциллятора и интегральная интенсивность поглощения Сила осциллятора (f) которая характеризует число осцилляторов с массой m
- 88. Расчет длины волны поглощения
- 90. Скачать презентацию


![Характеристики электромагнитного излучения Частота излучения(ν) [c-1] Длинна волны (λ) [м] Волновое](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/754451/slide-3.jpg)










































































 Правила построения изображений, даваемых линзой
Правила построения изображений, даваемых линзой Электромагнитные волны
Электромагнитные волны Электрическое поле. Напряжённость электрического поля
Электрическое поле. Напряжённость электрического поля Динамика. Динамика точки и механической системы
Динамика. Динамика точки и механической системы Солнечные батареи
Солнечные батареи Электричество и магнетизм. Лекция 7. Законы постоянного тока. Электрические схемы постоянного тока
Электричество и магнетизм. Лекция 7. Законы постоянного тока. Электрические схемы постоянного тока Ультразвуковые технологии
Ультразвуковые технологии Background radiation
Background radiation Проекция силы на ось
Проекция силы на ось L23 - Зачем нужна программа Гарантии Качества в лучевой терапии
L23 - Зачем нужна программа Гарантии Качества в лучевой терапии Принцип действия ламп накаливания это преобразование электрической энергии в световую энергию. Вольфрамовая нить разогревае
Принцип действия ламп накаливания это преобразование электрической энергии в световую энергию. Вольфрамовая нить разогревае Бытовая швейная машина
Бытовая швейная машина Теплопроводность
Теплопроводность Сила трения
Сила трения Гармонические колебания
Гармонические колебания Отличии реальных и идеальных газов
Отличии реальных и идеальных газов Упругие волны. (Тема 5)
Упругие волны. (Тема 5) Светодиоды и полупроводниковые лазеры
Светодиоды и полупроводниковые лазеры Виды излучений
Виды излучений Механические колебания и волны
Механические колебания и волны Автоматизация процесса регулировки манометров
Автоматизация процесса регулировки манометров Физико-технические основы создания ЭГК для термоэмиссионных ЯЭУ различного назначения
Физико-технические основы создания ЭГК для термоэмиссионных ЯЭУ различного назначения Геометрическая оптика
Геометрическая оптика Использование комплекта «Я сдам ЕГЭ» для подготовки к экзамену по физике
Использование комплекта «Я сдам ЕГЭ» для подготовки к экзамену по физике Способи збереження енергетичних ресурсів
Способи збереження енергетичних ресурсів Внутренняя энергия
Внутренняя энергия Экранирование, гальваническая развязка, источники питания
Экранирование, гальваническая развязка, источники питания МЭМС и НЭМС: электронные системы, жидкостные вентили, насосы и биомедицинские системы
МЭМС и НЭМС: электронные системы, жидкостные вентили, насосы и биомедицинские системы