Содержание
- 2. Масс-спектрометрия – метод исследования вещества путём определения масс ионов этого вещества (чаще отношений масс ионов к
- 3. ИСТОРИЯ ОТКРЫТИЯ МАСС-СПЕКТРОМЕТРИИ Масс-спектральный анализ для определения характеристик веществ давно и успешно применяется в химическом анализе.
- 4. Лишь с 1960 г. началось реальное практическое внедрение масс-спектрометрии, вскоре ставшей стандартным методом современной аналитики. На
- 9. Основы метода Метод основан на переводе частиц исследуемого вещества в состояние ионизированного газа с последующим их
- 11. Состав масс-спектра Масс-спектр может включать пики нескольких типов ионов (продуктов ионизации): 1. Молекулярный ион 2. Перегруппировочные
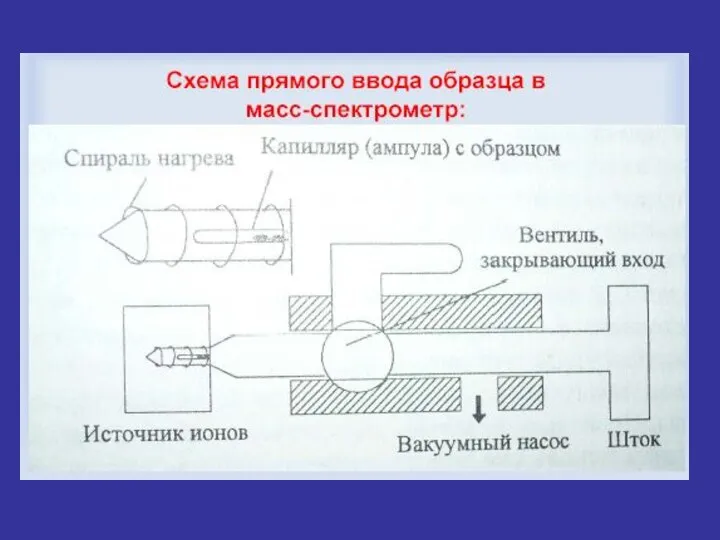
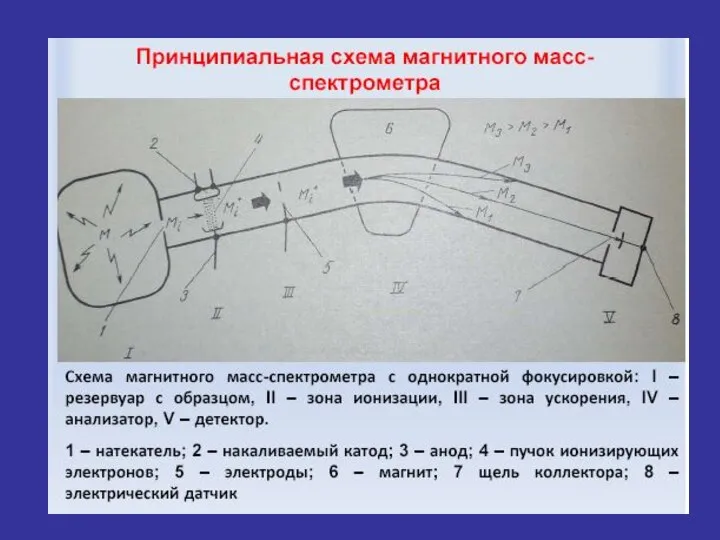
- 12. I Система напуска пробы Важное условие напуска пробы – количество вводимой пробы не должно превышать нескольких
- 14. Теоретические основы метода Физический принцип масс-спектрального анализа основан на законе лоренцевой силы F, согласно которому заряженные
- 15. Кинетическая энергия заряженной частицы массы m, движущейся под действием разности потенциалов V со скорость v……………………………………………………… Величина
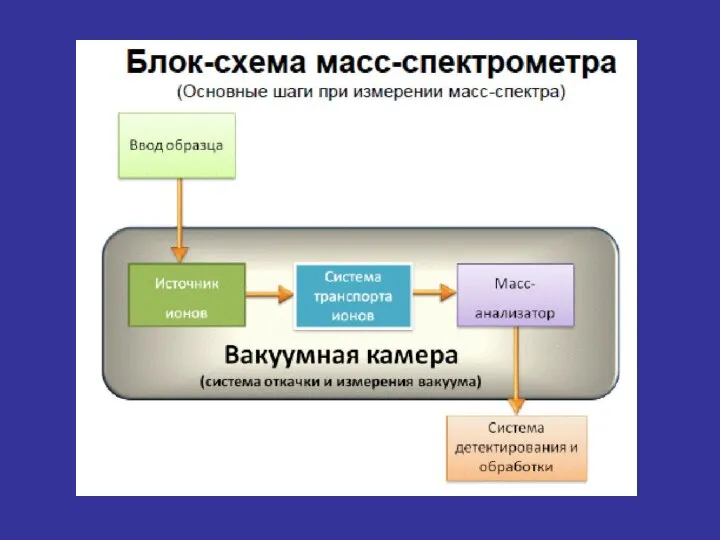
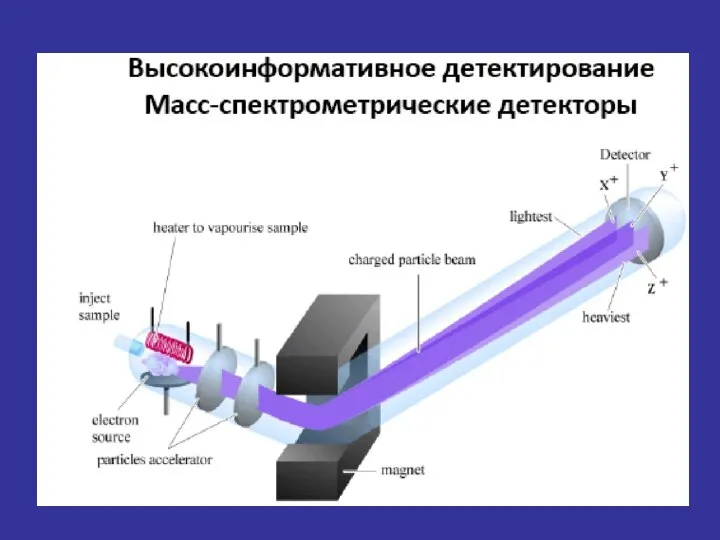
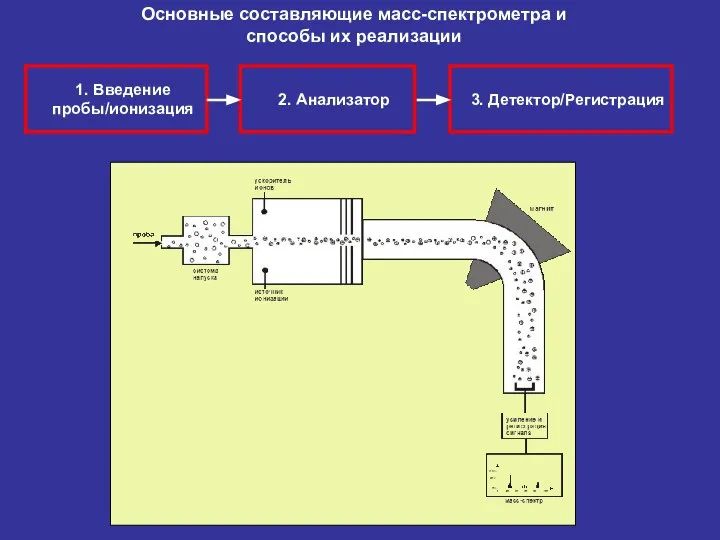
- 22. 2. Анализатор 3. Детектор/Регистрация 1. Введение пробы/ионизация Основные составляющие масс-спектрометра и способы их реализации
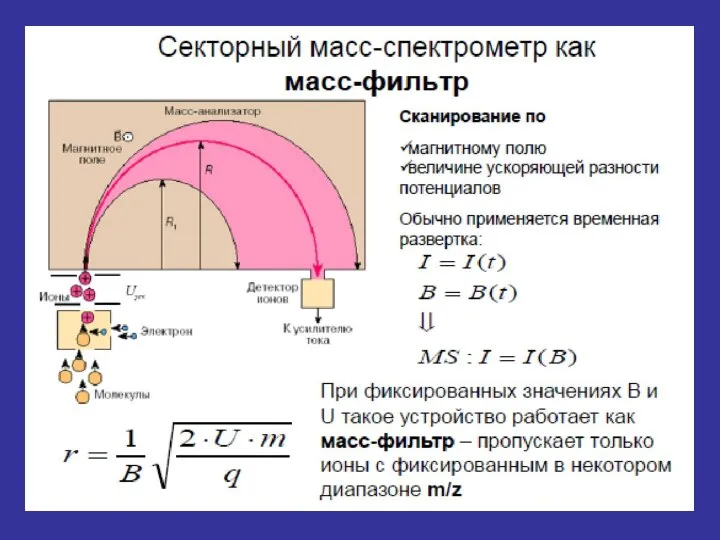
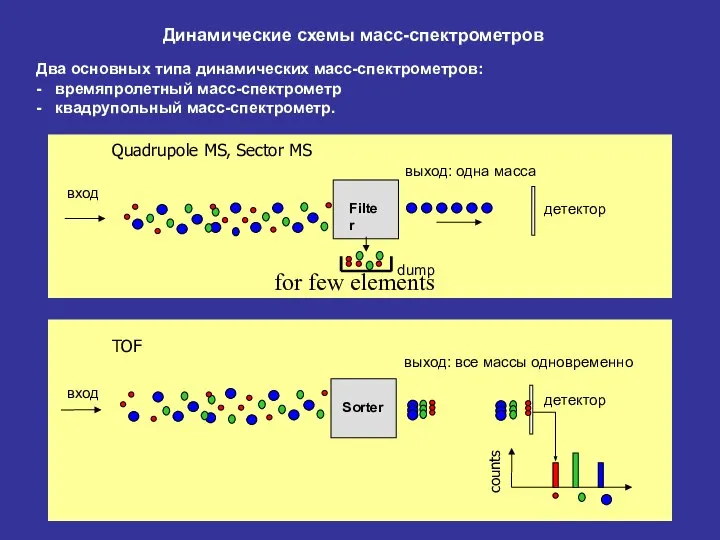
- 23. Динамические схемы масс-спектрометров Два основных типа динамических масс-спектрометров: - времяпролетный масс-спектрометр - квадрупольный масс-спектрометр.
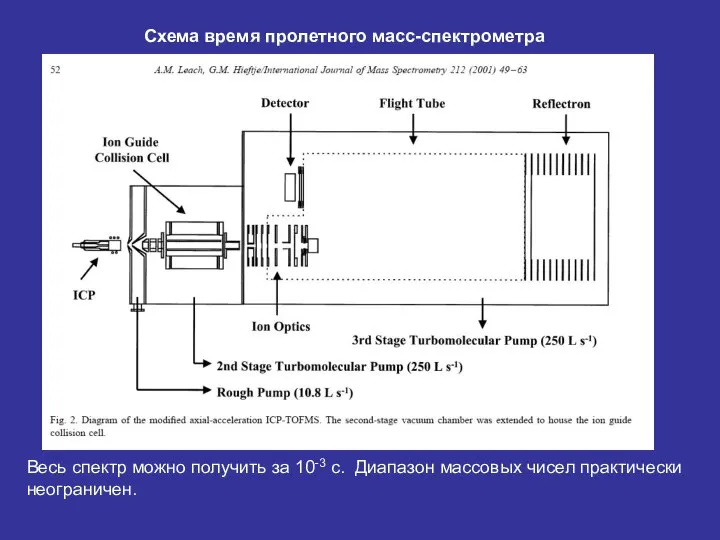
- 25. Схема время пролетного масс-спектрометра Весь спектр можно получить за 10-3 с. Диапазон массовых чисел практически неограничен.
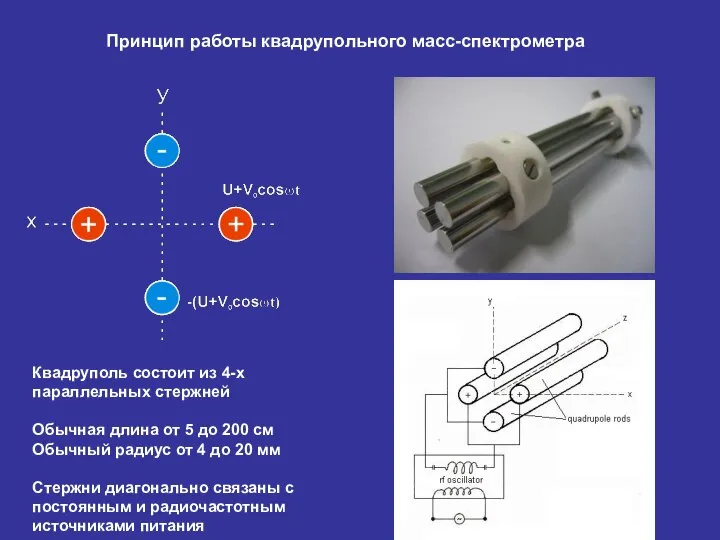
- 27. Квадруполь состоит из 4-х параллельных стержней Обычная длина от 5 до 200 см Обычный радиус от
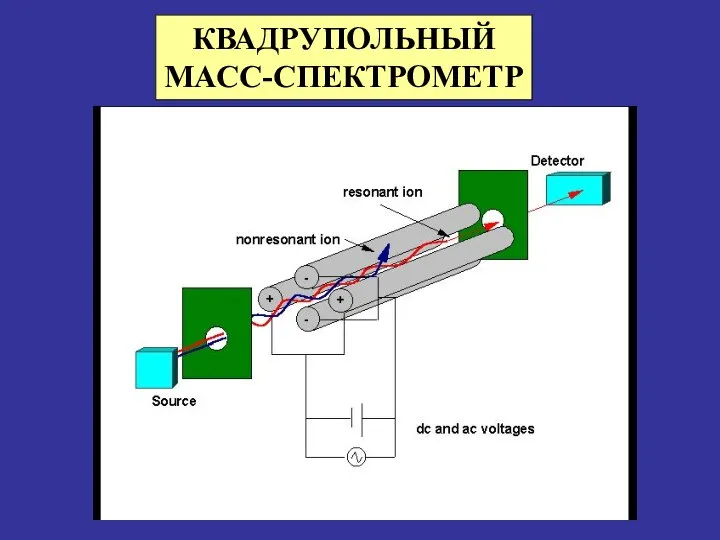
- 28. КВАДРУПОЛЬНЫЙ МАСС-СПЕКТРОМЕТР
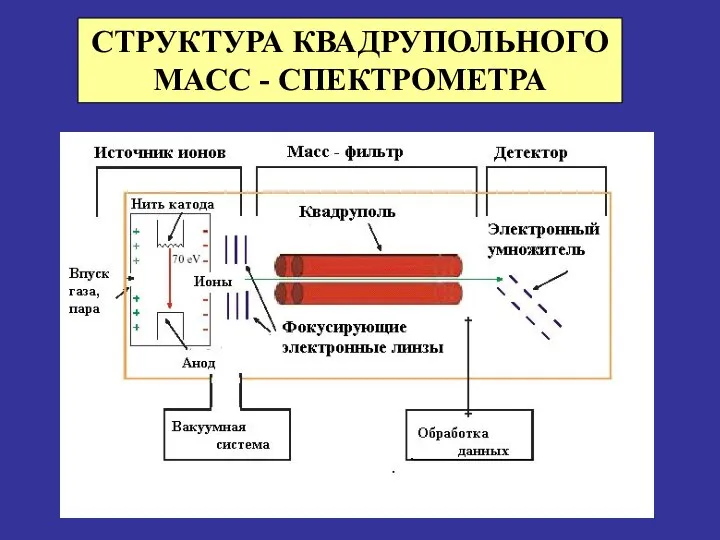
- 29. СТРУКТУРА КВАДРУПОЛЬНОГО МАСС - СПЕКТРОМЕТРА
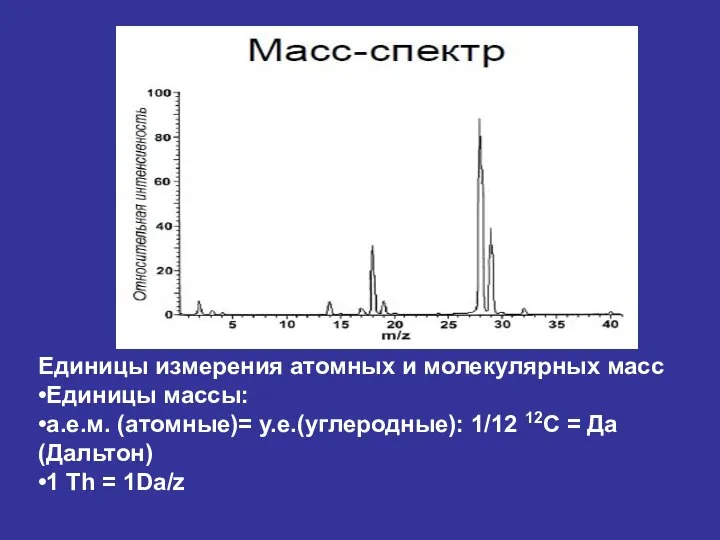
- 30. Единицы измерения атомных и молекулярных масс •Единицы массы: •а.е.м. (атомные)= у.е.(углеродные): 1/12 12C = Да (Дальтон)
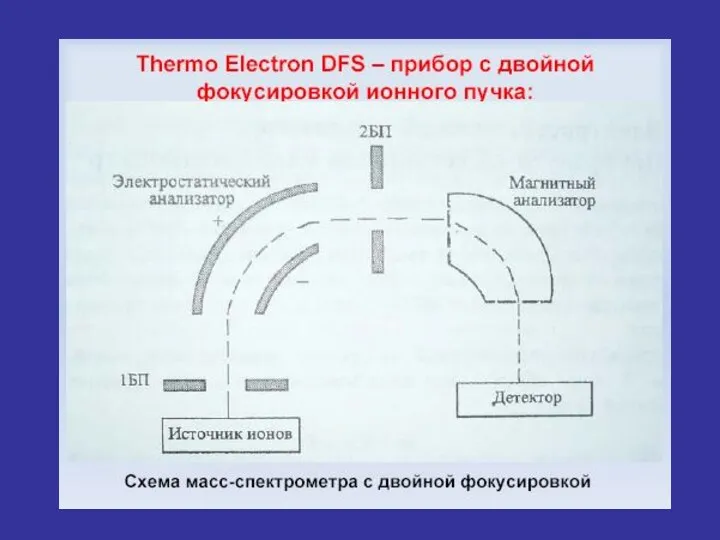
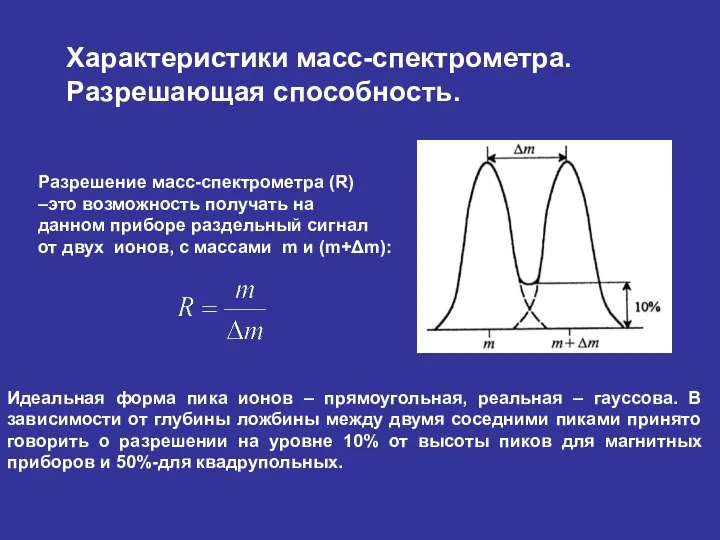
- 31. Характеристики масс-спектрометра. Разрешающая способность. Разрешение масс-спектрометра (R) –это возможность получать на данном приборе раздельный сигнал от
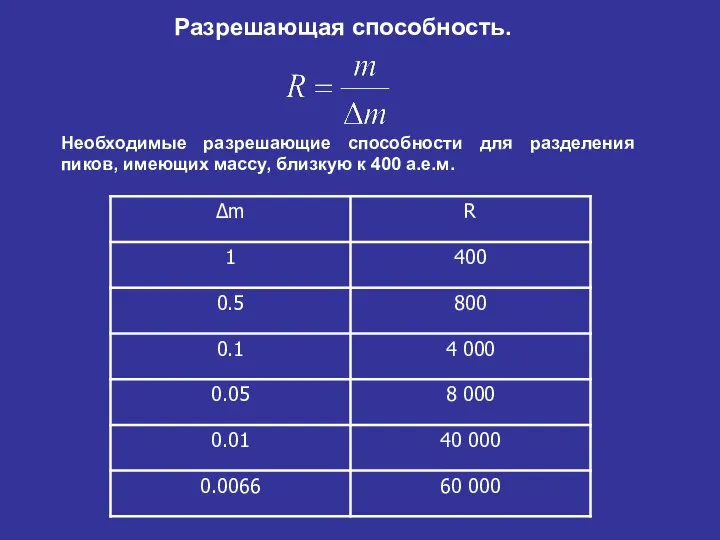
- 32. Разрешающая способность. Необходимые разрешающие способности для разделения пиков, имеющих массу, близкую к 400 а.е.м.
- 33. Установлено, что на разрешение в масс-спектрометрии влияют в основном следующие параметры: Пространственная расходимость пучка ионов Разброс
- 34. Разрешение масс-спектрометра • 12С=12.00000000 а.е.м. • 1H = 1.00782506 а.е.м. • 14N=14.00307407 а.е.м. • 16O=15.99491475 а.е.м.
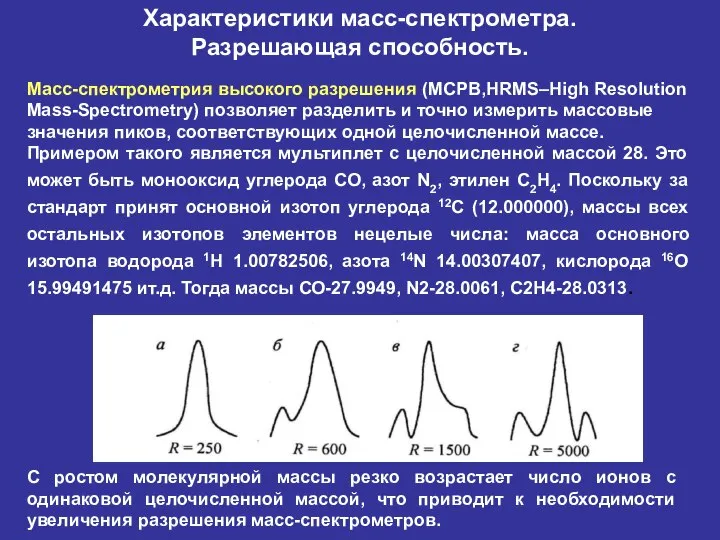
- 35. Характеристики масс-спектрометра. Разрешающая способность. Масс-спектрометрия высокого разрешения (МСРВ,HRMS–High Resolution Mass-Spectrometry) позволяет разделить и точно измерить массовые
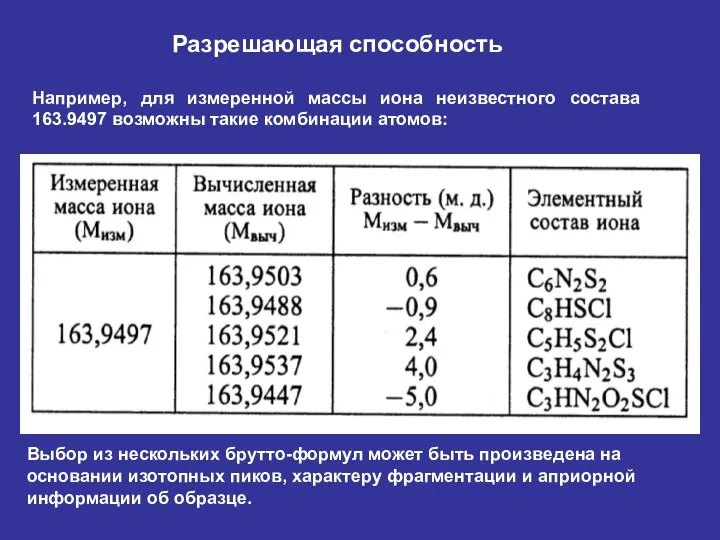
- 36. Разрешающая способность Например, для измеренной массы иона неизвестного состава 163.9497 возможны такие комбинации атомов: Выбор из
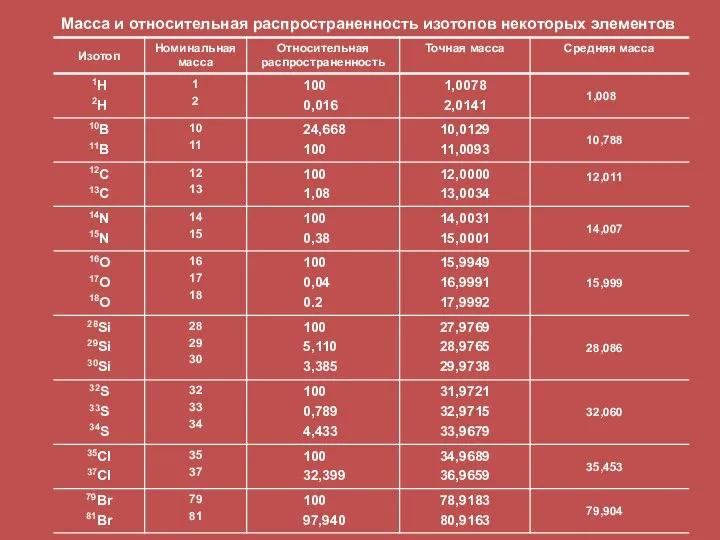
- 37. Масса и относительная распространенность изотопов некоторых элементов
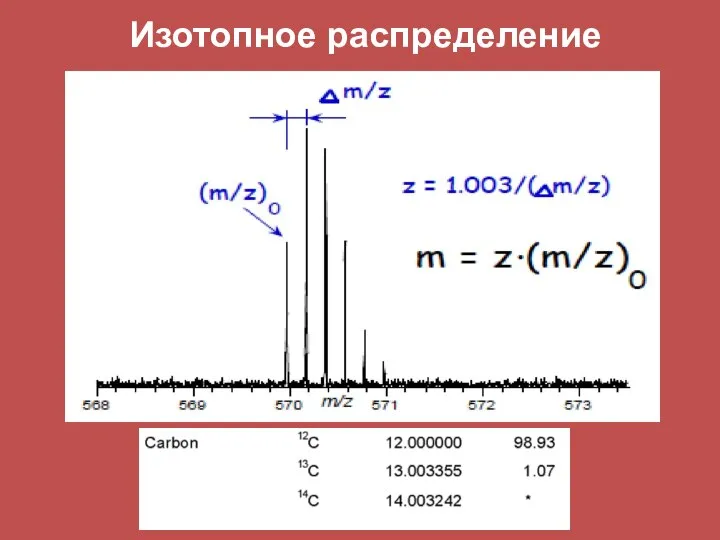
- 38. Изотопное распределение
- 40. Скачать презентацию















 Взаимосвязь электрического сопротивления графита с его положением в пространстве
Взаимосвязь электрического сопротивления графита с его положением в пространстве «Работа и мощность постоянного тока. Электродвижущая сила. Закон Ома для полной цепи.» Учиться определять работу, мощность пост
«Работа и мощность постоянного тока. Электродвижущая сила. Закон Ома для полной цепи.» Учиться определять работу, мощность пост Силы в механике
Силы в механике Квантовая физика. Фотоэффект. Теория фотоэффекта
Квантовая физика. Фотоэффект. Теория фотоэффекта Razele x
Razele x Ценностные и правовые регулятивы развития новых технологий и направлений науки. Тема 5
Ценностные и правовые регулятивы развития новых технологий и направлений науки. Тема 5 Преломление света
Преломление света Технология магнитопорошкового метода контроля
Технология магнитопорошкового метода контроля Конструкция авотмобиля
Конструкция авотмобиля Принцип относительности Галилея и электромагнитные явления
Принцип относительности Галилея и электромагнитные явления Атомная электростанция
Атомная электростанция Виды диэлектриков и их поляризация
Виды диэлектриков и их поляризация Презентация по физике "танчики физика механика" - скачать бесплатно
Презентация по физике "танчики физика механика" - скачать бесплатно «Причину же свойств силы тяготения я до сих пор не мог вывести из явлений, гипотез же я не измышляю». И. Ньютон
«Причину же свойств силы тяготения я до сих пор не мог вывести из явлений, гипотез же я не измышляю». И. Ньютон  Промышленная акустика. Инженерная акустика
Промышленная акустика. Инженерная акустика Қатты дененің динамикасы
Қатты дененің динамикасы Мощность. Механическая мощность
Мощность. Механическая мощность Электромагнетизм. (Лабораторные работы 4.1 - 4.6)
Электромагнетизм. (Лабораторные работы 4.1 - 4.6) Рівновага тіл. Види рівноваги тіл. Центр тяжіння
Рівновага тіл. Види рівноваги тіл. Центр тяжіння Цвет и его характеристики
Цвет и его характеристики Первый закон термодинамики. Тепловые двигатели и КПД тепловых двигателей
Первый закон термодинамики. Тепловые двигатели и КПД тепловых двигателей Тепловлажностный и воздушный режимы зданий, методы и средства их обеспечения. (Тема 2)
Тепловлажностный и воздушный режимы зданий, методы и средства их обеспечения. (Тема 2) Кристалдану үдерісі
Кристалдану үдерісі Магнит өрісі
Магнит өрісі Уравнения Максвелла. Вихревое электрическое поле
Уравнения Максвелла. Вихревое электрическое поле Определение гамма-излучения в Челябинском городском бору
Определение гамма-излучения в Челябинском городском бору Изучение последовательного и параллельного соединения проводников
Изучение последовательного и параллельного соединения проводников Взаимодействие тел. Масса тела. Единицы массы
Взаимодействие тел. Масса тела. Единицы массы