Содержание
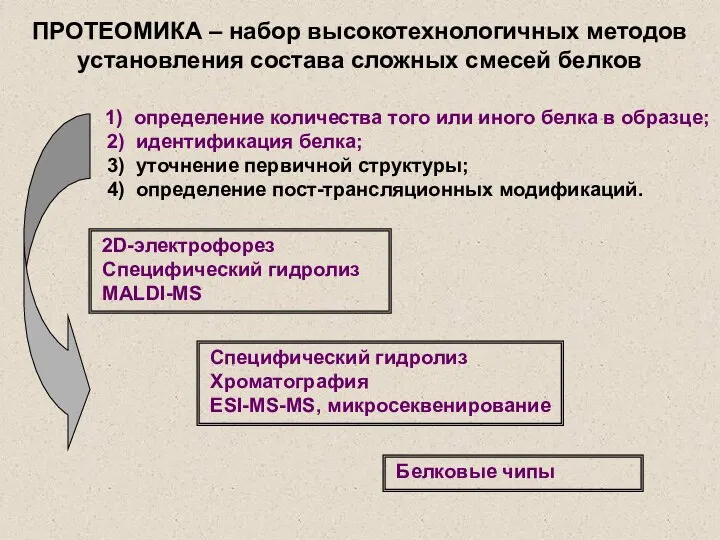
- 2. 1) определение количества того или иного белка в образце; 2) идентификация белка; 3) уточнение первичной структуры;
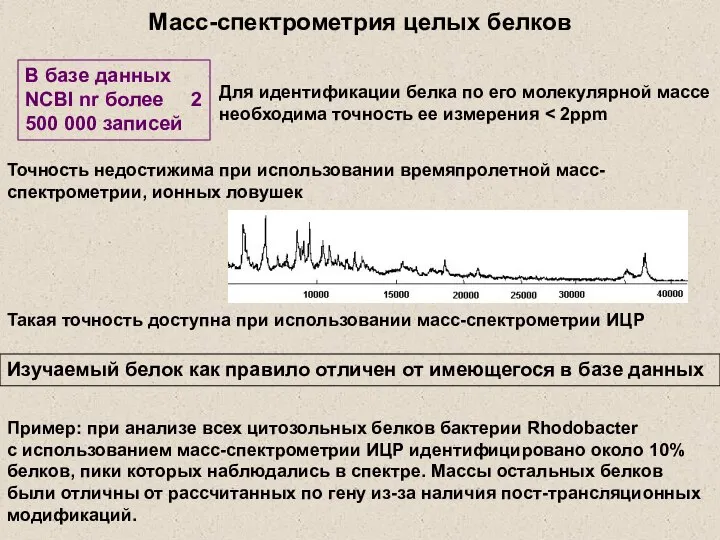
- 3. Масс-спектрометрия целых белков Точность недостижима при использовании времяпролетной масс-спектрометрии, ионных ловушек Изучаемый белок как правило отличен
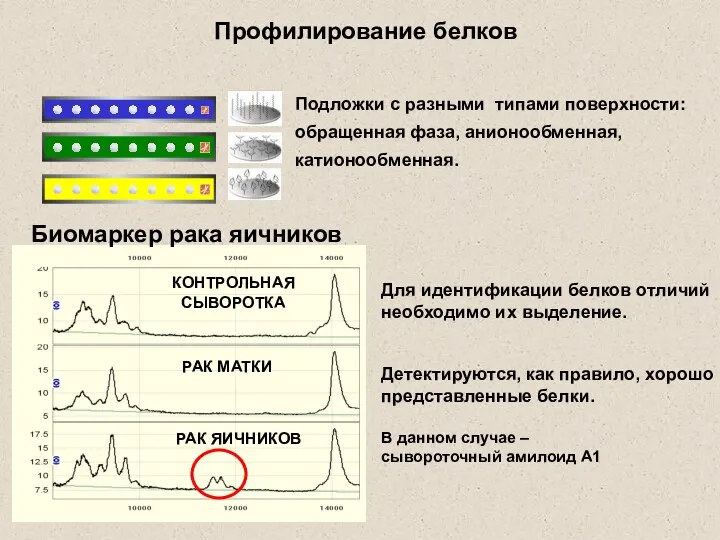
- 4. Профилирование белков КОНТРОЛЬНАЯ СЫВОРОТКА РАК МАТКИ РАК ЯИЧНИКОВ Подложки с разными типами поверхности: обращенная фаза, анионообменная,
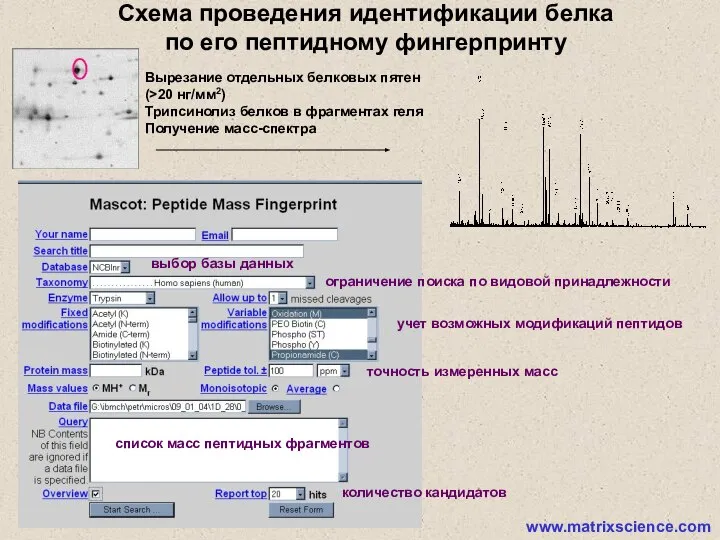
- 5. 2D электрофорез белков Компьютерный анализ изображений гелей Вырезание и трипсинолиз белков в фрагментах геля Экстракция пептидов
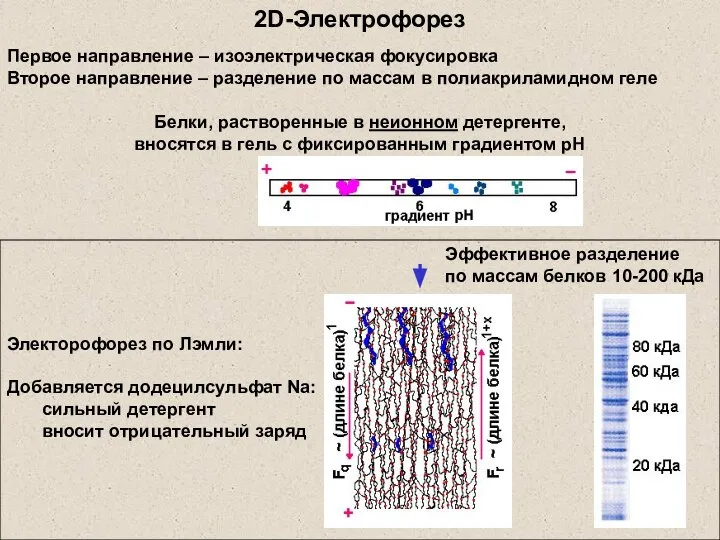
- 6. 2D-Электрофорез Электорофорез по Лэмли: Добавляется додецилсульфат Na: сильный детергент вносит отрицательный заряд Эффективное разделение по массам
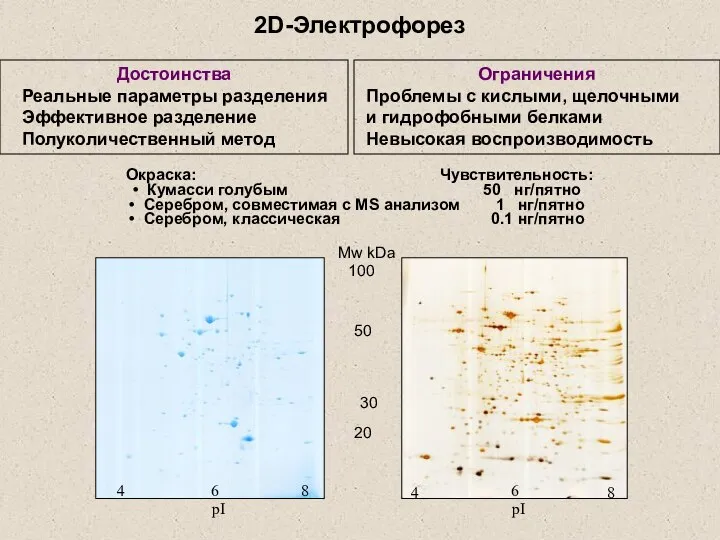
- 7. 2D-Электрофорез 30 Достоинства Реальные параметры разделения Эффективное разделение Полуколичественный метод Ограничения Проблемы с кислыми, щелочными и
- 8. 2D-Электрофорез Окраска DIGE Cy3/Cy5 Электрофорез 2-х предварительно окрашенных белков Mycoplasma gallisepticum проводится на одном геле. Зеленым
- 9. ограничение поиска по видовой принадлежности выбор базы данных учет возможных модификаций пептидов точность измеренных масс список
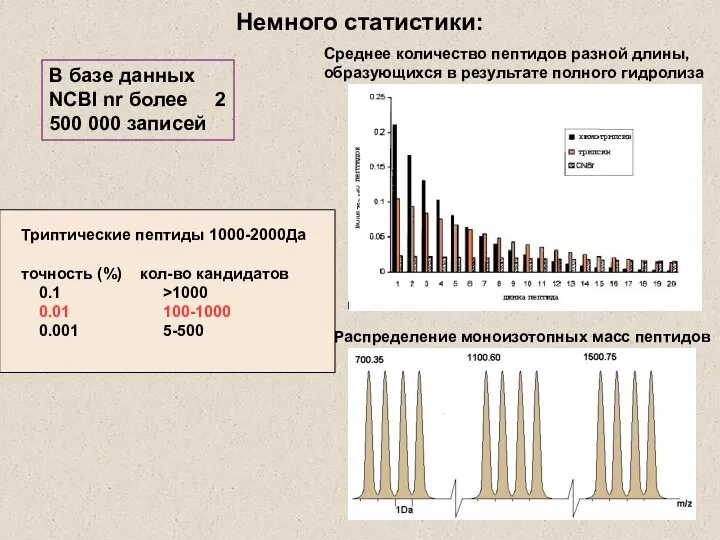
- 10. Немного статистики: Среднее количество пептидов разной длины, образующихся в результате полного гидролиза Распределение моноизотопных масс пептидов
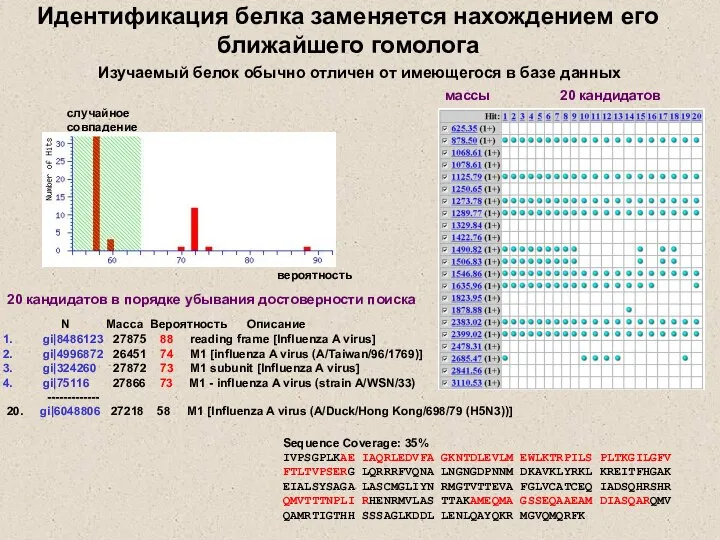
- 11. Критерии достоверности поиска белков в базах данных: peptide fingerprint количество «совпавших» пептидов, в предположении одного белка
- 12. N Масса Вероятность Описание gi|8486123 27875 88 reading frame [Influenza A virus] gi|4996872 26451 74 M1
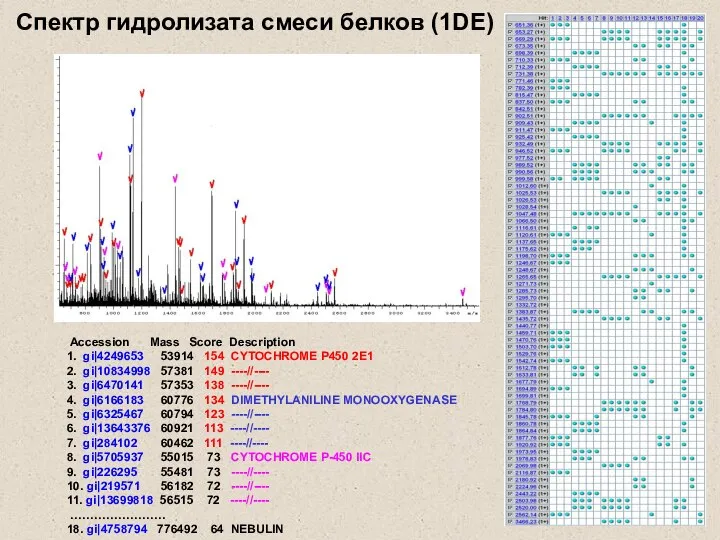
- 13. Accession Mass Score Description 1. gi|4249653 53914 154 CYTOCHROME P450 2E1 2. gi|10834998 57381 149 ----//----
- 14. 2DE + MALDI-MS - результаты Белковых пятен > 400 Проанализировано >150 Индивидуальных белков Mycoplasma gallisepticum 105
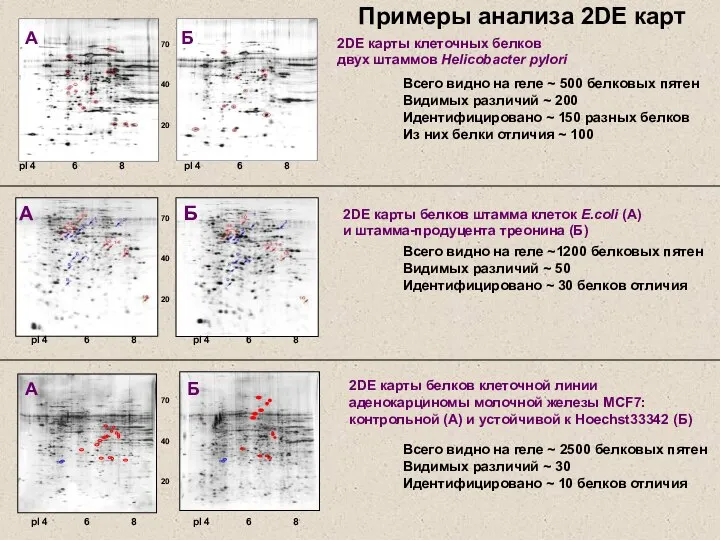
- 15. 70 40 20 pI 4 6 8 А Б 2DЕ карты белков клеточной линии аденокарциномы молочной
- 16. Стратегия анализа: 1D - LC + ESI-MS/MS Получение масс-спектров пептидов и их фрагментации Объединение данных и
- 17. Способы фрагментации пептидов LID – фрагментация, индуцированная лазером CID – фрагментация, индуцированная столкновениями ECD – фрагментация,
- 18. Интерпретация спектров распада пептидов TIGTHPSSSAGLK [MH]2+
- 19. Отбор из базы данных всех кандидатов, содержащих триптические пептиды указанных m/z 2. «Примерка» спектров фрагментации (MS/MS)
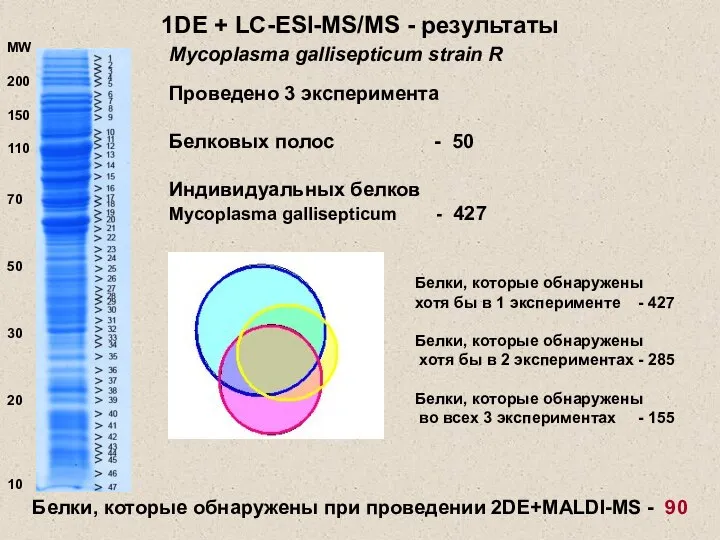
- 20. 1DE + LC-ESI-MS/MS - результаты Проведено 3 эксперимента Белковых полос - 50 Индивидуальных белков Mycoplasma gallisepticum
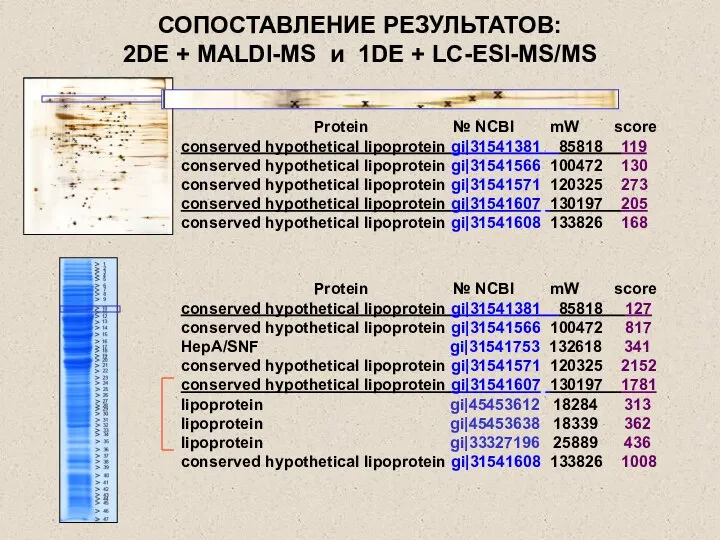
- 21. СОПОСТАВЛЕНИЕ РЕЗУЛЬТАТОВ: 2DE + MALDI-MS и 1DE + LC-ESI-MS/MS Protein № NCBI mW score conserved hypothetical
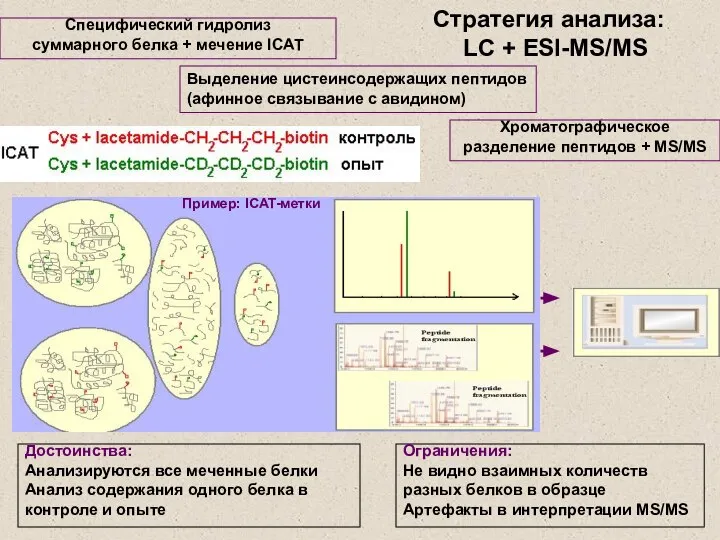
- 22. Стратегия анализа: LC + ESI-MS/MS Специфический гидролиз суммарного белка + мечение ICAT Хроматографическое разделение пептидов +
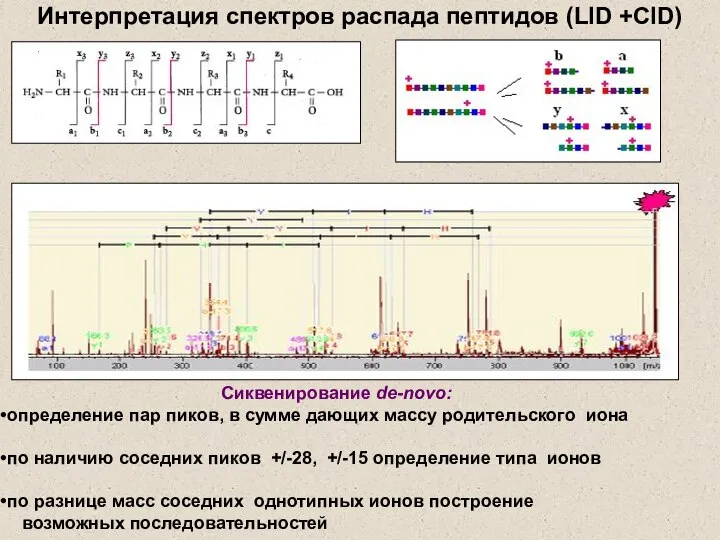
- 23. Интерпретация спектров распада пептидов (LID +CID) Сиквенирование de-novo: определение пар пиков, в сумме дающих массу родительского
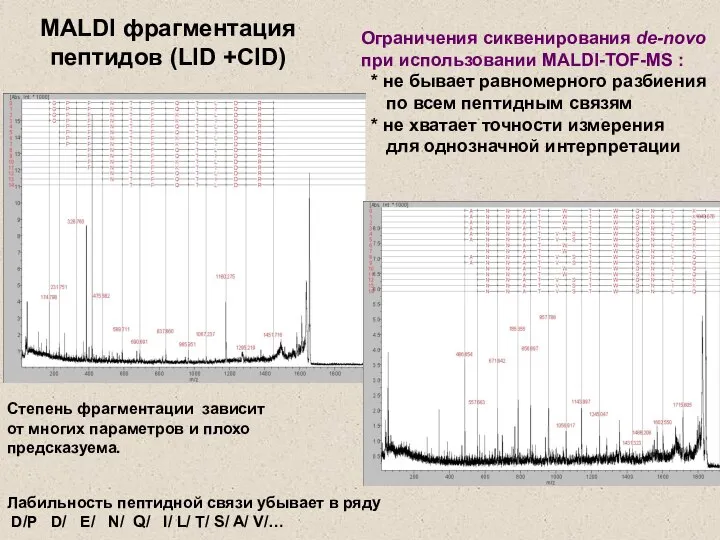
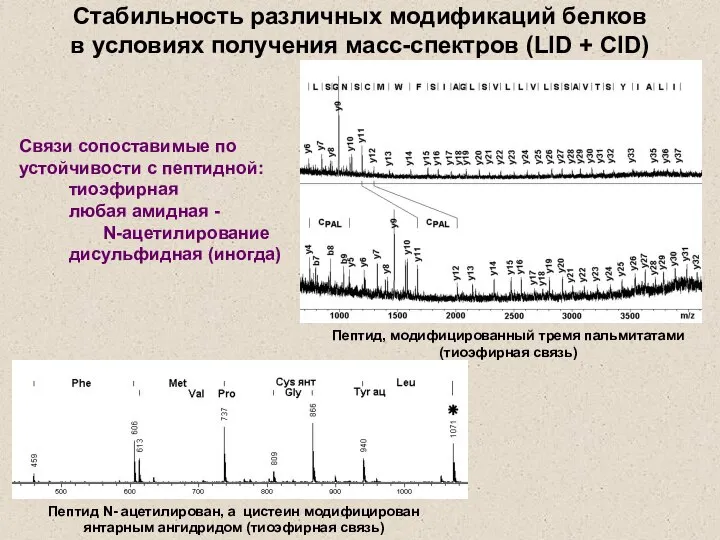
- 24. Лабильность пептидной связи убывает в ряду D/P D/ E/ N/ Q/ l/ L/ T/ S/ A/
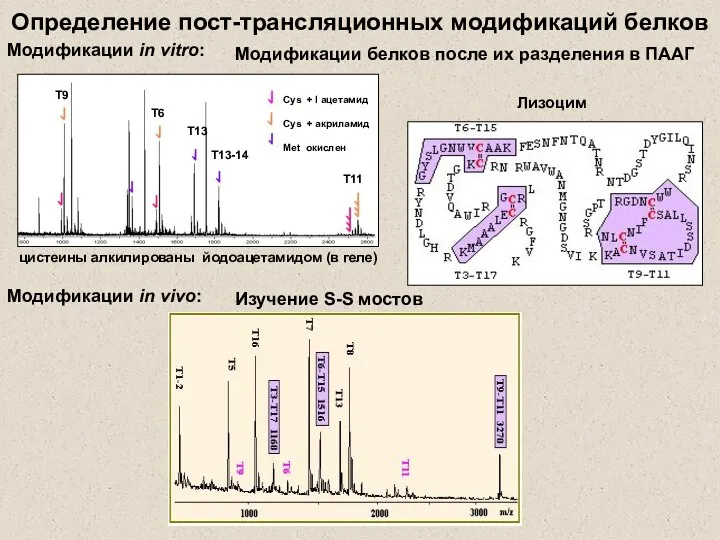
- 25. Определение пост-трансляционных модификаций белков Модификации in vitro: Модификации белков после их разделения в ПААГ цистеины алкилированы
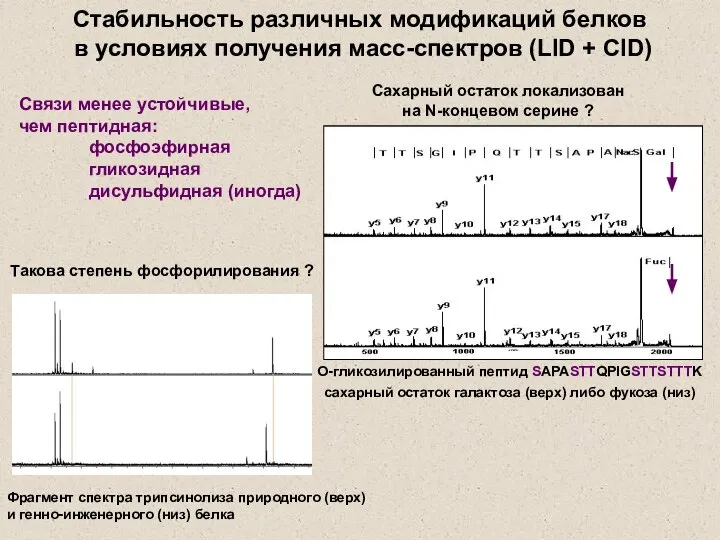
- 26. О-гликозилированный пептид SAPASTTQPIGSTTSTTTK сахарный остаток галактоза (верх) либо фукоза (низ) Сахарный остаток локализован на N-концевом серине
- 27. Стабильность различных модификаций белков в условиях получения масс-спектров (LID + CID) Связи сопоставимые по устойчивости с
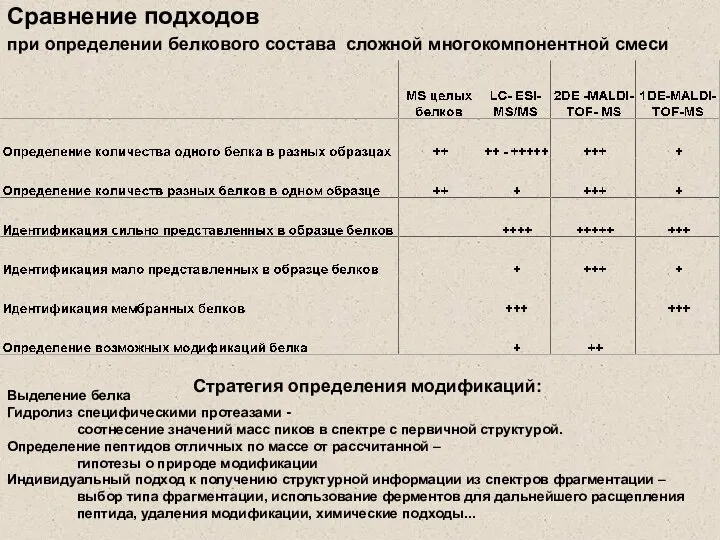
- 28. Сравнение подходов при определении белкового состава сложной многокомпонентной смеси Выделение белка Гидролиз специфическими протеазами - соотнесение
- 30. Скачать презентацию






![Интерпретация спектров распада пептидов TIGTHPSSSAGLK [MH]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1471131/slide-17.jpg)

 Электростатика. Электродинамика
Электростатика. Электродинамика Локальные системы молниезащиты объектов электроэнергетики
Локальные системы молниезащиты объектов электроэнергетики Квантово-полевая картина мира
Квантово-полевая картина мира Ренгенофлуоресцентный анализ
Ренгенофлуоресцентный анализ Биофизика, как наука. История и методология биофизики. Кинетика биологических процессов. Термодинамика биологических процессов
Биофизика, как наука. История и методология биофизики. Кинетика биологических процессов. Термодинамика биологических процессов Релейный регулятор для движения по границе черного и белого
Релейный регулятор для движения по границе черного и белого Космические скорости
Космические скорости Строение тел. Агрегатные состояния вещества и фазовые переходы. Законы термодинамики
Строение тел. Агрегатные состояния вещества и фазовые переходы. Законы термодинамики Модели распространения радиоволн, методы предсказания напряжённости поля и потерь распространения, применяемые МСЭ-R Модели расп
Модели распространения радиоволн, методы предсказания напряжённости поля и потерь распространения, применяемые МСЭ-R Модели расп Постоянный электрический ток. Характеристики электрической цепи. Действие электрического тока и правила техники безопасности
Постоянный электрический ток. Характеристики электрической цепи. Действие электрического тока и правила техники безопасности Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов
Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов Закон Ома для участка цепи
Закон Ома для участка цепи Источники звука. Характеристики звука.
Источники звука. Характеристики звука. Звуковые волны. Урок физики в 9 классе
Звуковые волны. Урок физики в 9 классе Теория электромагнитного поля
Теория электромагнитного поля Элементы машиноведения. Устройство бытовой швейной машины
Элементы машиноведения. Устройство бытовой швейной машины Источники света. Распространение света
Источники света. Распространение света Типовые гидродинамические модели ТОУ
Типовые гидродинамические модели ТОУ Фазированные антенные решетки и их назначение
Фазированные антенные решетки и их назначение Гидродинамика. Уравнение Бернулли. Подъемная сила. Течение вязкой жидкости. Формула Стокса. Обтекание тел
Гидродинамика. Уравнение Бернулли. Подъемная сила. Течение вязкой жидкости. Формула Стокса. Обтекание тел Шкала Р.А. Реомюра
Шкала Р.А. Реомюра Podstawowe pojęcia z zakresu RADIOMETRII
Podstawowe pojęcia z zakresu RADIOMETRII Основные понятия кинематики. Тест №1. 9 класс
Основные понятия кинематики. Тест №1. 9 класс Турбина, первичный двигатель с вращательным движением рабочего органа
Турбина, первичный двигатель с вращательным движением рабочего органа Частота. Маятник
Частота. Маятник Вывод формул веществ по массовым долям элементов
Вывод формул веществ по массовым долям элементов Новое состояние материи – кварк-глюонная плазма
Новое состояние материи – кварк-глюонная плазма Двигатель внутреннего сгорания
Двигатель внутреннего сгорания