Содержание
- 2. План лекції Розподіл Максвелла для молекул ідеального газу за швидкостями. Середня арифметична, середня квадратична та найімовірніша
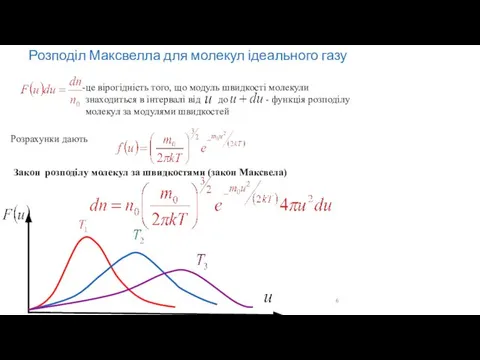
- 3. Функція Максвела має різний вигляд для молекул різної маси: чим більшою є маса частинок, тим гостріший
- 4. Функція Максвелла, визначає відносну кількість молекул, яка припадає на одиничний інтервал швидкостей Розподіл Максвелла для молекул
- 5. Розподіли молекул ідеального газу за швидкостями (розподіли Максвела) для трьох різних температур. Функція Максвела f(v) показує
- 6. Розподіл Максвелла для молекул ідеального газу
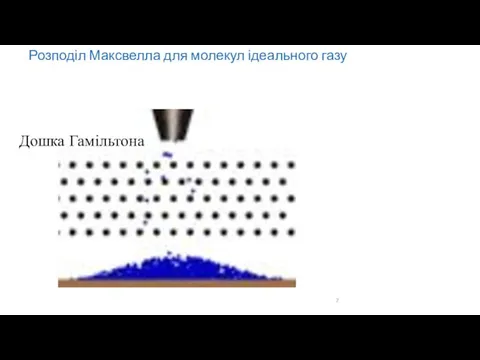
- 7. Розподіл Максвелла для молекул ідеального газу Дошка Гамільтона
- 8. називається найімовірнішою швидкістю називається середньою арифметичною швидкістю називається середньою квадратичною швидкістю Розподіл Максвелла для молекул ідеального
- 9. Розподіл Больцмана Барометрична формула Розподіл Больцмана – розподіл молекул за значеннями потенціальної енергії
- 10. Розподіл Больцмана Ілюстрація розподілу молекул у полі сил земного тяжіння – розподілу Больцмана. Чим вище –
- 11. Числом ступенів вільності тіла називається найменше число незалежних координат, які необхідно задати, щоб повністю визначити положення
- 12. За допомогою статистичного методу Больцман вивів закон рівномірного розподілу енергії за ступенями вільності молекул: у стані
- 13. Термодинаміка вивчає: закони взаємних перетворень різних видів енергії, та їх залежність від різних факторів. переходи енергії
- 14. Внутрішня енергія, робота, теплота Термодинамічна система (ТДС) – це фізична система, що складається з великої кількості
- 15. Обмін енергією ТДС із зовнішнім середовищем може відбуватися двома способами: при силовій взаємодії (шляхом виконання роботи)
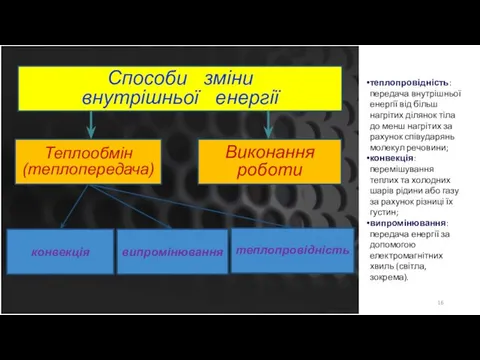
- 16. Способи зміни внутрішньої енергії Теплообмін (теплопередача) Виконання роботи конвекція теплопровідність випромінювання теплопровідність: передача внутрішньої енергії від
- 17. Робота у загальному випадку: МЕХАНІЧНА РОБОТА
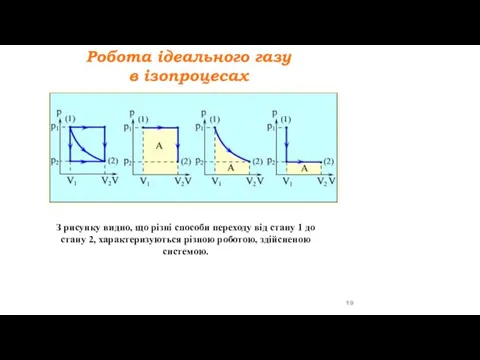
- 18. Робота ідеального газу в ізопроцесах ІЗОБАРНИЙ ПРОЦЕС ІЗОТЕРМІЧНИЙ ПРОЦЕС ІЗОХОРНИЙ ПРОЦЕС
- 19. З рисунку видно, що різні способи переходу від стану 1 до стану 2, характеризуються різною роботою,
- 20. Кількість теплоти - це енергія, яка передається тілу в процесі теплопередачі ззовні. Теплопередача – це такий
- 21. Кількість теплоти, яку потрібно надати одному молю речовини, щоб підвищити його температуру на один Кельвін називається
- 22. Розглянемо термодинамічну систему (газ), яка переходить із одного стану, що характеризується параметрами (P1,V1,T1), в інший (P2,V2,T2):
- 23. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ де dU - повний диференціал, δQ та δ A – функціонали. Різниця між
- 24. Застосування І закону термодинаміки до ізопроцесів 1. ІЗОБАРНИЙ ПРОЦЕС:
- 25. Рівняння Маєра: 2. ІЗОТЕРМІЧНИЙ ПРОЦЕС: 3. ІЗОХОРНИЙ ПРОЦЕС:
- 26. АДІАБАТНИЙ ПРОЦЕС
- 28. Рівняння адіабати: Адіабата спадає крутіше ніж ізотерма. Це пояснюється тим, що при адіабатичному стисненні збільшення тиску
- 30. Скачать презентацию























 Фізичні основи функціонування систем радіолокації та радіонавігації
Фізичні основи функціонування систем радіолокації та радіонавігації Введение в тему урока Повторение материала, необходимого на уроке
Введение в тему урока Повторение материала, необходимого на уроке Работа газа и пара при расширении. Двигатель внутреннего сгорания
Работа газа и пара при расширении. Двигатель внутреннего сгорания Кипение. Процесс кипения. Температура кипения
Кипение. Процесс кипения. Температура кипения Теорія електричних та магнітних кіл (лекція 1)
Теорія електричних та магнітних кіл (лекція 1) Атомы: от Демокрита до Томсона
Атомы: от Демокрита до Томсона Магнитные материалы (магнетики)
Магнитные материалы (магнетики) Выживание в море в случае оставления судна. Общие положения и введение в курс. Тема 1.1
Выживание в море в случае оставления судна. Общие положения и введение в курс. Тема 1.1 Особенности распространения радиоволн коротковолнового диапазона
Особенности распространения радиоволн коротковолнового диапазона Лекция 15. Тема: Закон Био-Савара - Лапласа
Лекция 15. Тема: Закон Био-Савара - Лапласа Конструкция и расчет зуборезного инструмента
Конструкция и расчет зуборезного инструмента Взаимодействие излучения с полупроводниками
Взаимодействие излучения с полупроводниками Замедляющие структуры
Замедляющие структуры Спиральность нейтрино
Спиральность нейтрино Кинематика вращательного движения. Поступательное движение твердого тела. Теорема о движении центра масс. Работа и энергия
Кинематика вращательного движения. Поступательное движение твердого тела. Теорема о движении центра масс. Работа и энергия Релаксация спинового ансамбля
Релаксация спинового ансамбля Под геофизическими полями понимают физические поля образованные планетой ЗЕМЛЯ
Под геофизическими полями понимают физические поля образованные планетой ЗЕМЛЯ 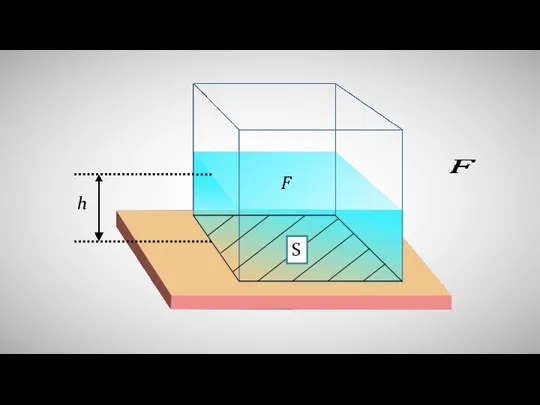 Расчёт давления жидкости на дно и стенки сосуда
Расчёт давления жидкости на дно и стенки сосуда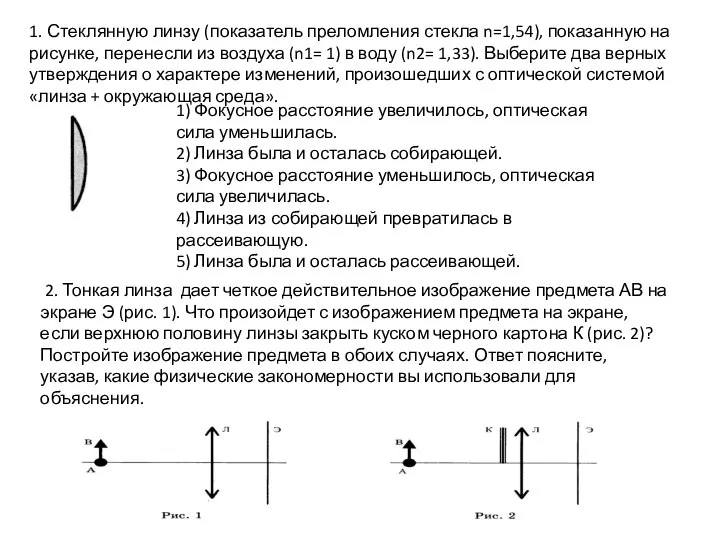 Линза. Фокусное расстояние
Линза. Фокусное расстояние Розвиток судного та повітряного плавання. Дослід Торрічеллі
Розвиток судного та повітряного плавання. Дослід Торрічеллі Аттестационная работа. Уроки - исследования по физике Выталкивающая сила. Закон Архимеда
Аттестационная работа. Уроки - исследования по физике Выталкивающая сила. Закон Архимеда Нужны ли нам частицы
Нужны ли нам частицы Исследование возникновения и развития скольжения в поликристаллических образцах алюминия с помощью лазерной методики
Исследование возникновения и развития скольжения в поликристаллических образцах алюминия с помощью лазерной методики Приемники оптического излучения. Способы их крепления
Приемники оптического излучения. Способы их крепления חומרים אלקטרונים הרצאה מס' 7
חומרים אלקטרונים הרצאה מס' 7 Теплові двигуни
Теплові двигуни Методы решения физических задач
Методы решения физических задач Лабораторная работа. Кривошипно-шатунный механизм
Лабораторная работа. Кривошипно-шатунный механизм