Содержание
- 2. Первое начало термодинамики (разные формулировки) «Энергия в природе не уничтожается и не возникает вновь, а переходит
- 3. Закон Гесса – следствие 1 начала термодинамики. Закон Гесса: тепловые эффекты химической реакции QV и QP,
- 4. Задача 1-А. Предсказать, возможны ли самопроизвольные превращения (если да, то какие) в закрытых сосудах, в которых
- 5. Задача 1-А. Предсказать, возможны ли самопроизвольные превращения (если да, то какие) в закрытых сосудах, в которых
- 6. Задача 1-А. Предсказать, возможны ли самопроизвольные превращения (если да, то какие) в закрытых сосудах, в которых
- 7. Задача №3-1. Согласно термохимическому уравнению реакции CH4 (газ)+ 2O2 (газ) = CO2 (газ) +2H2O (жидк.) +
- 8. Задача №3-1. Согласно термохимическому уравнению реакции CH4 (газ)+ 2O2 (газ) = CO2 (газ) +2H2O (жидк.) +
- 9. Задача 3-2. Стандартная энтальпия реакции СаСO3(тв) = СаО(тв) + СO2(г), протекающей в открытом сосуде при температуре
- 10. Задача 3-2. Стандартная энтальпия реакции СаСO3(тв) = СаО(тв) + СO2(г), протекающей в открытом сосуде при температуре
- 11. Задача 3. Рассчитайте стандартную внутреннюю энергию образования жидкого бензола при 298 К. если стандартная энтальпия его
- 12. Задача 3-3. Рассчитайте стандартную внутреннюю энергию образования жидкого бензола при 298 К. если стандартная энтальпия его
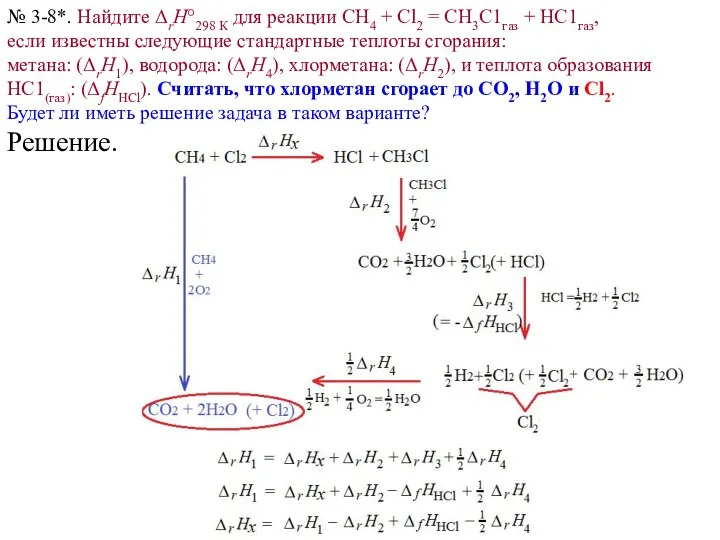
- 13. Задача 3-8. Найдите ΔrH°298 К для реакции СН4 + Сl2 = СН3С1газ + НС1газ, если известны
- 14. Задача 3-8. Найдите ΔrH°298 К для реакции СН4 + Сl2 = СН3С1газ + НС1газ, если известны
- 15. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 16. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 17. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 18. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 19. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 20. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 21. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 22. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 23. № 3-8. Решение. «II способ». Есть реакция: СН4 + Сl2 = СН3С1газ + НС1газ. Получим те
- 24. Задача 3-8*. Изменим последнюю строчку условия Найдите ΔrH°298 К для реакции СН4 + Сl2 = СН3С1газ
- 25. № 3-8*. Найдите ΔrH°298 К для реакции СН4 + Сl2 = СН3С1газ + НС1газ, если известны
- 27. Скачать презентацию























 Гидравлический пресс
Гидравлический пресс Первый закон термодинамики
Первый закон термодинамики Материалы к уроку по теме Механические волны
Материалы к уроку по теме Механические волны Механические колебания
Механические колебания Этапы проектирования цифровых фильтров
Этапы проектирования цифровых фильтров Николя Леонар Сади Карно
Николя Леонар Сади Карно Параметры звукового поля
Параметры звукового поля Агрегатные состояния вещества. 7 класс
Агрегатные состояния вещества. 7 класс Газы и их свойства
Газы и их свойства Newton’s Third Law of Motion
Newton’s Third Law of Motion Коллоидты химия. Беттік керілу. Беттік керілу ұғымы. Беттік керілу, оны анықтау әдістері
Коллоидты химия. Беттік керілу. Беттік керілу ұғымы. Беттік керілу, оны анықтау әдістері Греет ли снег?
Греет ли снег? Наномеханика. Кривизна и неустойчивость тонких пленок
Наномеханика. Кривизна и неустойчивость тонких пленок Квантовая радиофизика. Лекция 4. Спектроскопия ЯМР
Квантовая радиофизика. Лекция 4. Спектроскопия ЯМР Совет мудрецов
Совет мудрецов Управление колебаниями системы маятник-тележка с приводом методом скоростного биградиента
Управление колебаниями системы маятник-тележка с приводом методом скоростного биградиента Гидравлический расчет малых мостов и труб
Гидравлический расчет малых мостов и труб Радиофикация школы. Автор работы: Голунов Александр Викторович ученик 10
Радиофикация школы. Автор работы: Голунов Александр Викторович ученик 10  Схема гидравлического пресса
Схема гидравлического пресса Презентация на тему «Глаз и зрение» 8 класс. Автор Васильева Е.Д.
Презентация на тему «Глаз и зрение» 8 класс. Автор Васильева Е.Д.  Факторы, повышающие интенсивность химического процесса
Факторы, повышающие интенсивность химического процесса Неравновесные процессы. Молекулярная физика и термодинамика
Неравновесные процессы. Молекулярная физика и термодинамика Давление в газах
Давление в газах Ядролык гамма резонанс. Мёссбауэр эффектісі
Ядролык гамма резонанс. Мёссбауэр эффектісі Определение фокусного расстояния рассеивающей линзы
Определение фокусного расстояния рассеивающей линзы Звенья передачи: ведущее, ведомое. Передаточное отношение
Звенья передачи: ведущее, ведомое. Передаточное отношение Свободное падение тел
Свободное падение тел Перспективы развития и использования электроэнергетики в современном мире
Перспективы развития и использования электроэнергетики в современном мире