Ernest Rutherford (1871-1937)
Изотопы -- разновидности атомов какого-либо химического элемента, которые имеют
одинаковый атомный номер, но разные массовые числа.
Химические свойства их почти идентичны, поскольку (как мы знаем сейчас) определяются электронной оболочкой.
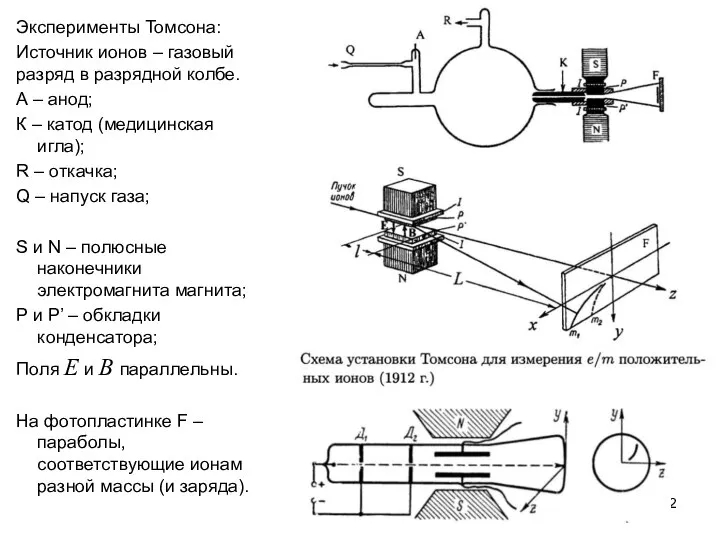
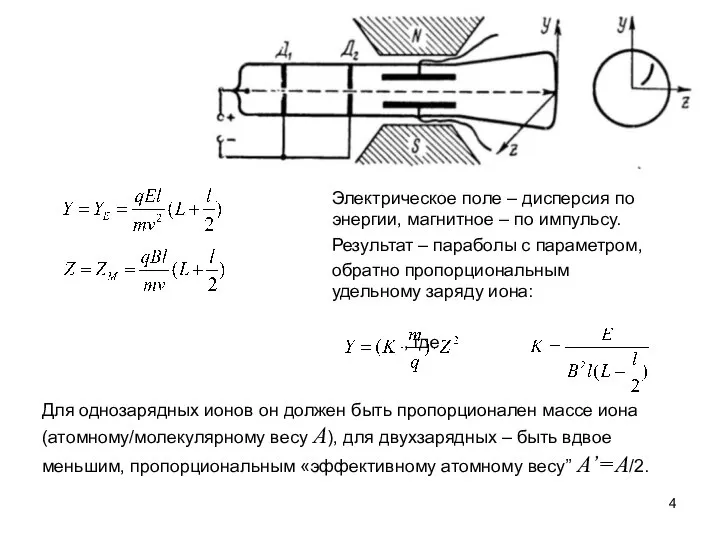
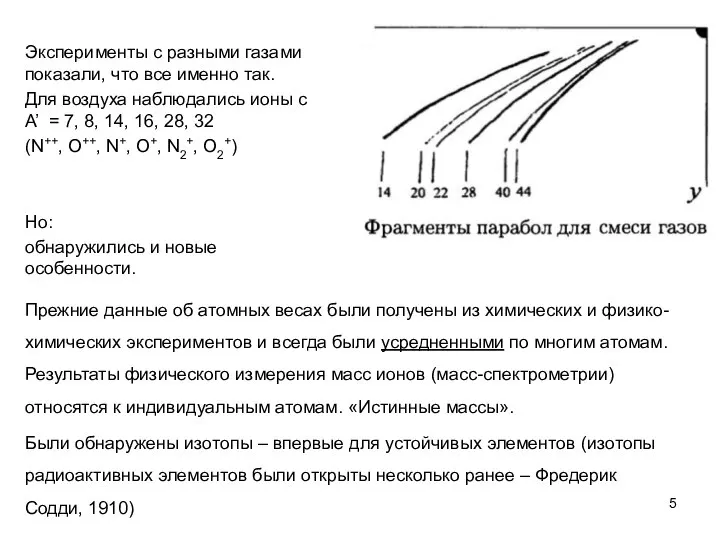
Эксперимент Томсона с неоном:
Обнаружены параболы, соответствующие значениям A’= 20, 22 и 44.
При этом известное «химическое» значение
массового веса неона равно 20.2.
A’ =44 соответствует CO2+ . А 22? Это CO2++?
Удалили CO2 вымораживанием. Но составляющая «A’ =22» осталась. Элемент с таким атомным весом был неизвестен.
Обнаружен новый элемент?
Это не совсем тот рисунок. Но параболы 20, 22 и 44 также присутствуют.




 Кинематика точки. Способы задания движения. Уравнения движения. Траектория. Закон движения точки
Кинематика точки. Способы задания движения. Уравнения движения. Траектория. Закон движения точки Охлаждение, нагревание тел конечных размеров. Нагрев параллелепипеда
Охлаждение, нагревание тел конечных размеров. Нагрев параллелепипеда Создание транспортно-энергетического модуля на основе ядерной энергодвигательной установки мегаваттного класса
Создание транспортно-энергетического модуля на основе ядерной энергодвигательной установки мегаваттного класса Твёрдые тела. Кристаллические и аморфные тела.
Твёрдые тела. Кристаллические и аморфные тела.  Презентация по физике "Реактивное движение и его применение в технике" - скачать
Презентация по физике "Реактивное движение и его применение в технике" - скачать  Законы Ньютона
Законы Ньютона Лекция 01. Геометрическая оптика
Лекция 01. Геометрическая оптика Архимедова
Архимедова Физические характеристики вибрации
Физические характеристики вибрации Законы Ньютона
Законы Ньютона  Решение задач на использование законов фотоэффекта (подготовка к ЕГЭ)
Решение задач на использование законов фотоэффекта (подготовка к ЕГЭ) О МЕТОДАХ СТАТИСТИЧЕСКОГО ОЦЕНИВАНИЯ В ОДНОЙ ЗАДАЧЕ БИОФИЗИКИ. Д. Соколов, Физический факультет МГУ при участии П.Изверовой
О МЕТОДАХ СТАТИСТИЧЕСКОГО ОЦЕНИВАНИЯ В ОДНОЙ ЗАДАЧЕ БИОФИЗИКИ. Д. Соколов, Физический факультет МГУ при участии П.Изверовой Структурный анализ механизмов. Вводная лекция (лекции №1)
Структурный анализ механизмов. Вводная лекция (лекции №1) Электрическая ёмкость проводника. Единица электроёмкости. Конденсатор. Ёмкость плоского конденсатора
Электрическая ёмкость проводника. Единица электроёмкости. Конденсатор. Ёмкость плоского конденсатора Электрические сопротивления
Электрические сопротивления Постоянные магниты. Магнитное поле Земли. 8 класс
Постоянные магниты. Магнитное поле Земли. 8 класс Вывод линейных УУН для сети переменного тока. Идеальный коэффициент трансформации
Вывод линейных УУН для сети переменного тока. Идеальный коэффициент трансформации Презентация Магнитное поле Земли
Презентация Магнитное поле Земли  Технологические требования к конструкции сварных и паяных соединений
Технологические требования к конструкции сварных и паяных соединений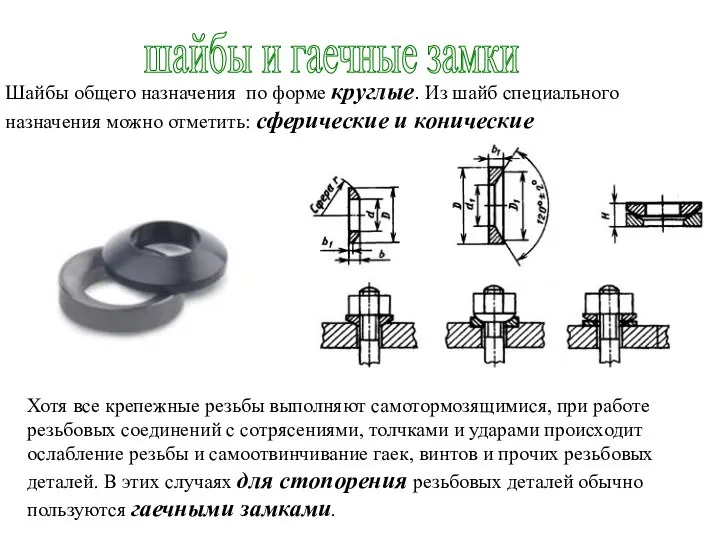 Шайбы и гаечные замки
Шайбы и гаечные замки Элементы квантовой механики. Гипотеза де Бройля. Волновые свойства вещества
Элементы квантовой механики. Гипотеза де Бройля. Волновые свойства вещества Уравнение состояния идеального газа Менделеева-Клапейрона. Газовые законы
Уравнение состояния идеального газа Менделеева-Клапейрона. Газовые законы Применение материалов в кабельных изделиях
Применение материалов в кабельных изделиях Теплофизические свойства полимеров
Теплофизические свойства полимеров Радиоактивный распад
Радиоактивный распад Энергия колебательного движения. (Лекция 7)
Энергия колебательного движения. (Лекция 7) Индукционные и высокочастотные установки
Индукционные и высокочастотные установки Ядерный реактор
Ядерный реактор