Содержание
- 2. Диффузия газов Диффузия от латинского diffusio – распространение, растекание взаимное проникновение соприкасающихся веществ друг в
- 3. 16.12.2016
- 4. 16.12.2016
- 5. Физический смысл знака “ – “ в этом уравнении: поток диффузии всегда направлен в сторону убывания
- 6. Поток частиц : это число молекул, проходящих через площадку S единичной площади, перпендикулярную к их скорости,
- 7. Так как - очень маленькая величина, то концентрации и можно представить следующим образом:
- 8. Из сравнения выражений: находим коэффициент диффузии Зависимость от давления и температуры. при T = const и
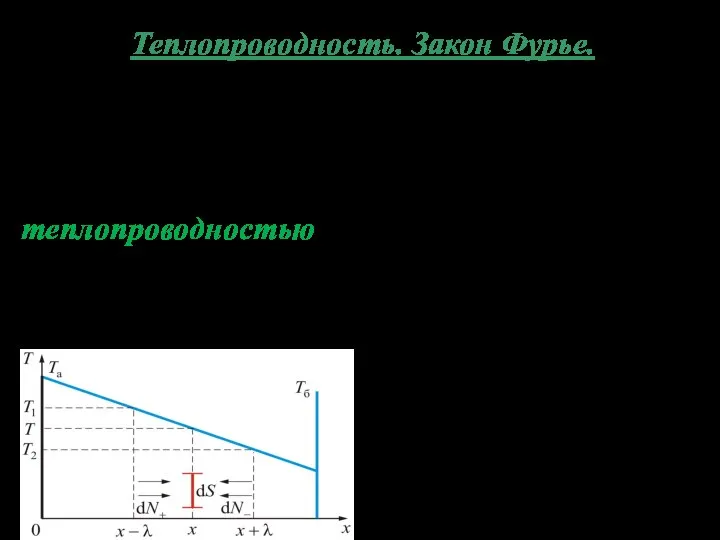
- 9. Теплопроводность. Закон Фурье. Если различные части системы имеют разные температуры (газ неравномерно нагрет), то возника-ет поток
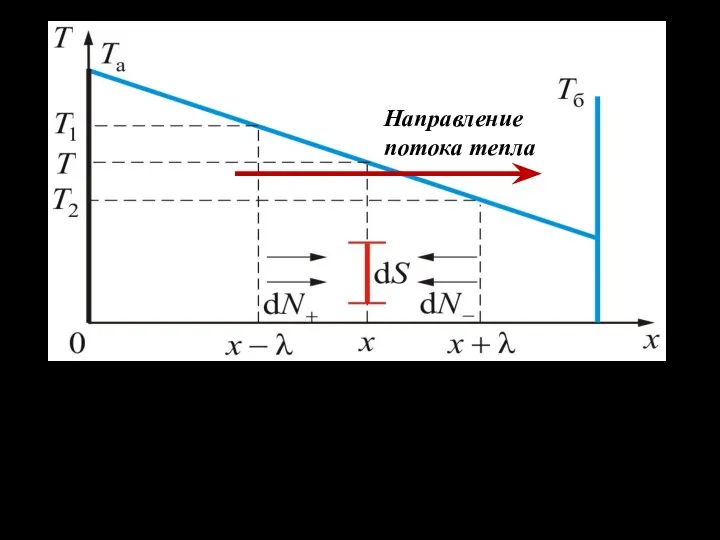
- 10. Направление потока тепла Температура убывает вдоль оси x, то есть существует градиент температуры
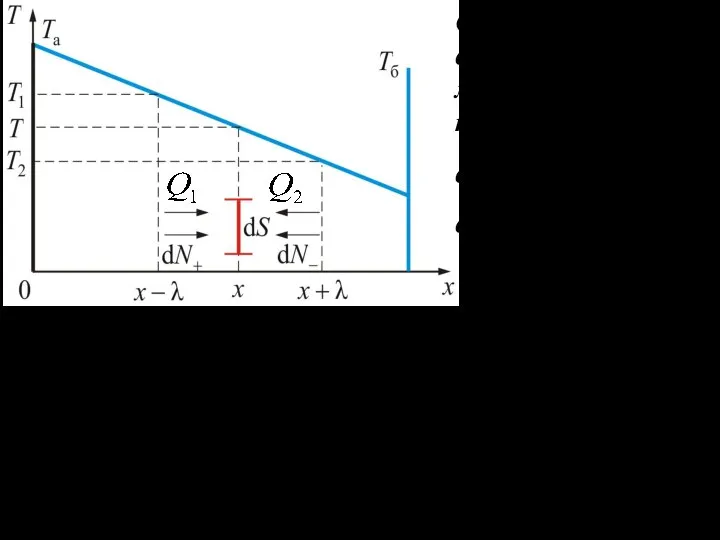
- 11. Экспериментально полученный закон Фурье показывает, что поток тепла через единичную площадку, перпендикулярную направлению потока, равен где
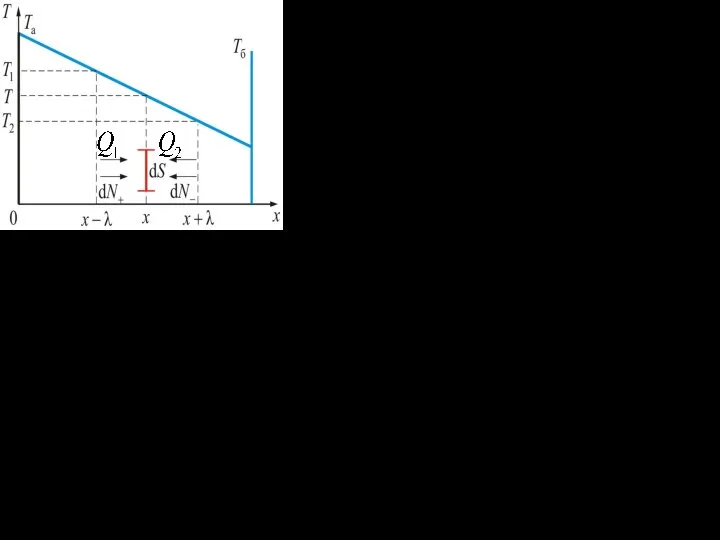
- 12. Отступим влево и вправо на от по- ложения поверхнос- ти, расположенной в точке x. В интер-валах
- 13. Энергия одной молекулы
- 14. Так как , где - молярная теплоем-кость при V=const, а - удельная теплоемкость, то где -
- 15. Окончательно Сравнивая с законом Фурье , получаем выражение для коэффициента теплопроводности
- 16. Зависимость от давления и температуры. Подставим значения и Из полученного выражения можно сделать вывод, что не
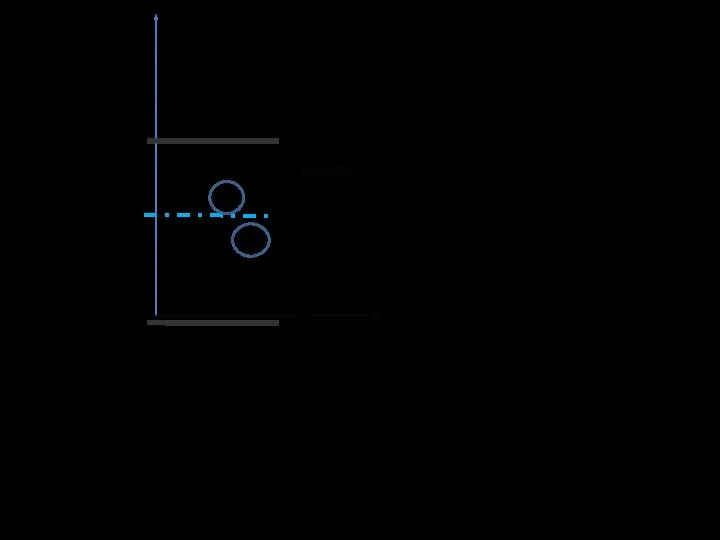
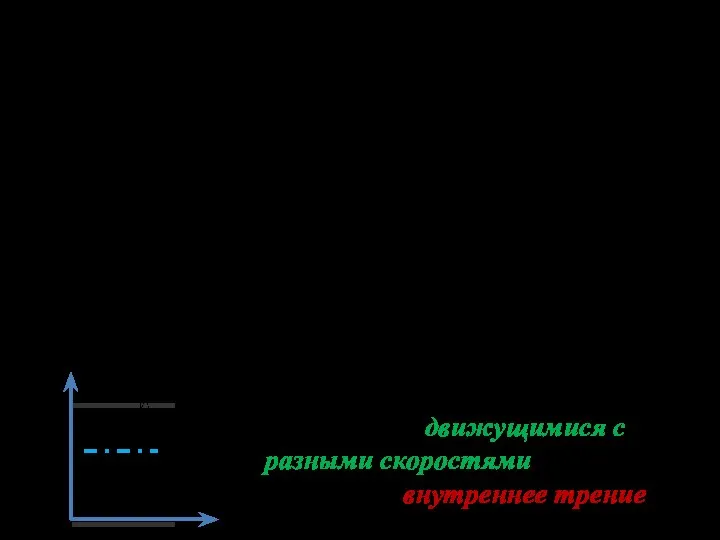
- 17. Внутреннее трение. Вязкость газов Вязкость газов (жидкостей) – это свойство, благо-даря которому выравниваются скорости движения различных
- 18. Раз слои газа движутся с разными скоростями, возникает трение. Выясним причину трения в газе. Каждая молекула
- 19. Средний импульс отдельной молекулы в слое определяется только дрейфовой скоростью слоя Но так как молекулы участвуют
- 20. Обозначим импульс слоя 1 - , слоя 2 - . Сказан- ное запишем математически: , По
- 21. Закон вязкости был открыт И. Ньютоном в 1687 г: Импульс, переносимый за 1с через площадку единичной
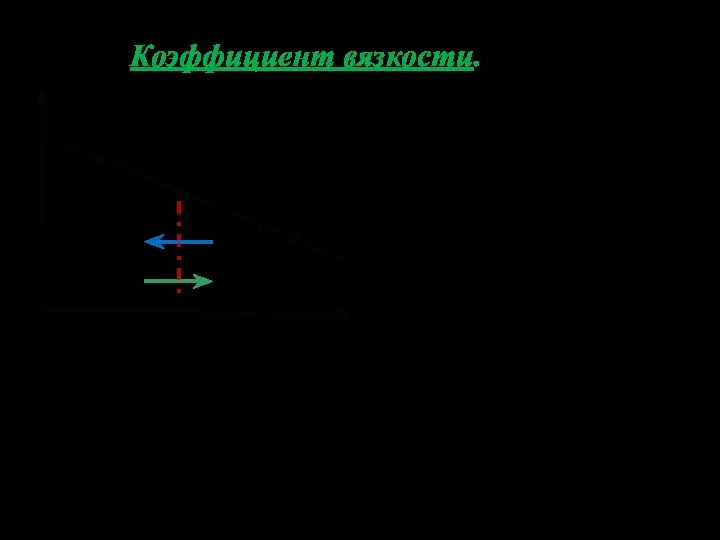
- 22. Коэффициент вязкости. Импульс одной молеку-лы Поток импульса упоря- доченного движения через единичную пло- щадку за единицу
- 23. Так как Коэффициент вязкости
- 24. Зависимость от давления и температуры Подставим значения и Из полученного выражение можно сделать вывод, что не
- 25. СИЛЬНО НЕРАВНОВЕСНЫЕ ОТКРЫТЫЕ СИСТЕМЫ И ПРОЦЕССЫ САМООРГАНИЗАЦИИ Любая закрытая система стремится к состоянию термодинамического равновесия, при
- 26. Открытая система тоже производит энтропию, как и закрытая, но в отличие от закрытой эта энтропия не
- 27. Необходимыми условиями для возникновения самоорганизации в системах являются следующие: система должна быть открытой, потому что закрытая
- 29. Скачать презентацию



















 Голография. Что такое голография
Голография. Что такое голография Требования к оформлению РГР. Диаграммы энергобалансов в масштабе
Требования к оформлению РГР. Диаграммы энергобалансов в масштабе Мастер класс: Реализация системно - деятельностного подхода на уроках физики и во внеурочной деятельности обучающихся Еди
Мастер класс: Реализация системно - деятельностного подхода на уроках физики и во внеурочной деятельности обучающихся Еди Полевая геофизика. Сейсморазведка
Полевая геофизика. Сейсморазведка Трение. (Тема 1.6)
Трение. (Тема 1.6) Фотоэффект құбылысы. Эйнштейн формуласы. Фотоэффект құбылысын техникада пайдалану
Фотоэффект құбылысы. Эйнштейн формуласы. Фотоэффект құбылысын техникада пайдалану Температурный режим воздуха и почвы
Температурный режим воздуха и почвы Механические и электромагнитные колебания и волны. (Раздел 07)
Механические и электромагнитные колебания и волны. (Раздел 07) Нанотехнологии и их применение
Нанотехнологии и их применение Тест-драйв Шевроле
Тест-драйв Шевроле Соударение твердых тел
Соударение твердых тел Кристаллические и аморфные тела
Кристаллические и аморфные тела  Superconductivity
Superconductivity Плотность вещества
Плотность вещества Тема: «Таблица единиц времени. Закрепление»
Тема: «Таблица единиц времени. Закрепление» Презентация по физике "Свет и его законы" - скачать
Презентация по физике "Свет и его законы" - скачать  Конвекция. Естественная (свободная)
Конвекция. Естественная (свободная) Онлайн Электрик: Расчет и анализ установившихся режимов электрических сетей
Онлайн Электрик: Расчет и анализ установившихся режимов электрических сетей Магнитное поле и его графическое изображение. Неоднородное и однородное магнитное поле
Магнитное поле и его графическое изображение. Неоднородное и однородное магнитное поле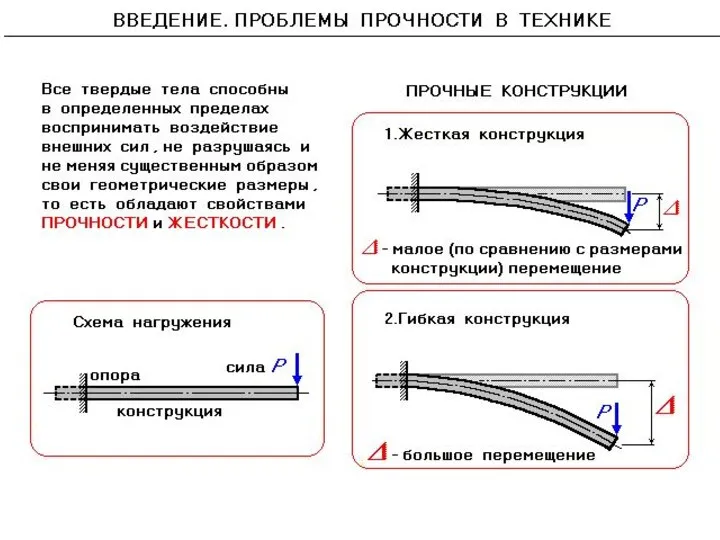 Проблемы прочности в технике
Проблемы прочности в технике Лекция 12. Изгибные колебания стержня
Лекция 12. Изгибные колебания стержня Магнитные материалы. Магнитное поле в веществе
Магнитные материалы. Магнитное поле в веществе Развитие взглядов на природу света Разработка урока по физике выполнена преподавателем ПУ № 108 Загер Надеждой Ивановной
Развитие взглядов на природу света Разработка урока по физике выполнена преподавателем ПУ № 108 Загер Надеждой Ивановной Принципы построения и источники энергии тепловых торпед
Принципы построения и источники энергии тепловых торпед Презентация по физике на тему: «Свойства звуковой волны». Выполнена ученицей 9-1 класса Зайцевой Верой.
Презентация по физике на тему: «Свойства звуковой волны». Выполнена ученицей 9-1 класса Зайцевой Верой. Дыбыс күшейту аппараттуралары
Дыбыс күшейту аппараттуралары Выбор режимов при ручной дуговой сварке
Выбор режимов при ручной дуговой сварке Презентация по физике Электрическое поле
Презентация по физике Электрическое поле