Содержание
- 2. Раздел химии, изучающий скорости и механизмы химических процессов, называется химической кинетикой. Скорость химической реакции определяется изменением
- 3. Для гомогенной (однородной) системы средняя скорость химической реакции измеряется количеством веществ, вступивших в реакцию или образующихся
- 4. Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. 1. Влияние
- 5. Уравнения, выражающие зависимость скорости химических реакций от концентраций реагентов, называют кинетическими. Коэффициент пропорциональности k называют константой
- 6. 2. Зависимость скорости реакции от температуры. При повышении температуры скорость реакции, как правило, увеличивается. Эта закономерность
- 7. Основное влияние температура оказывает на константу скорости реакции. Эта зависимость выражается уравнением Аррениуса: где: k –
- 8. Реакции, подчиняющиеся уравнениям типа: принято классифицировать по признаку кинетического порядка. Общим или суммарным порядком реакции называют
- 9. Молекулярностью реакции называется число молекул, участвующих в одном элементарном акте реакции. Если в элементарном акте участвует
- 10. Реакции I порядка Для реакций I порядка убыль концентрации реагента определяется уравнением: где С – концентрация
- 11. Кинетические уравнения реакций различного порядка. * при равных исходных концентрациях реагирующих веществ
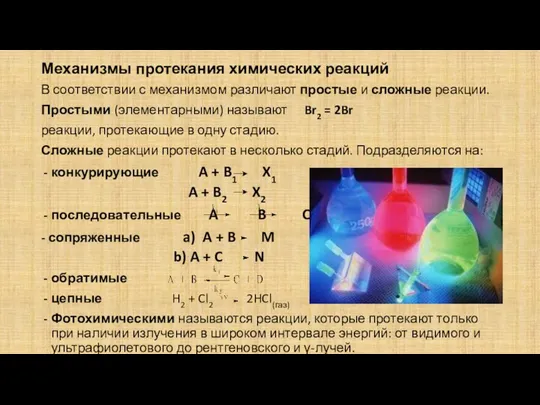
- 12. Механизмы протекания химических реакций В соответствии с механизмом различают простые и сложные реакции. Простыми (элементарными) называют
- 13. Ферментативный катализ Катализатором называется вещество, которое ускоряет реакцию, но само в ходе реакции не расходуется. Реакции,
- 14. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 15. Необратимыми называют реакции, которые протекают только в одном направлении. BaCl2 + K2SO4 BaSO4↓ + 2KCl Na2CO3
- 16. Термодинамика равновесных процессов aA + bB ⇄ cC + dD , при T = const и
- 17. Кинетика равновесных процессов Для гомогенной реакции: aA + bB ⇄ cC + dD, скорость прямой реакции:
- 19. Скачать презентацию















 Интегрированный (физика + музыка) повторительно-обобщающий урок по теме: «Звуковые волны»
Интегрированный (физика + музыка) повторительно-обобщающий урок по теме: «Звуковые волны» Внутрішня енергія
Внутрішня енергія Джерела і приймочі світла. Поглощеніе і розсіювання світла
Джерела і приймочі світла. Поглощеніе і розсіювання світла Линейная и угловая скорость
Линейная и угловая скорость Плоская система сил
Плоская система сил Термодинамические законы
Термодинамические законы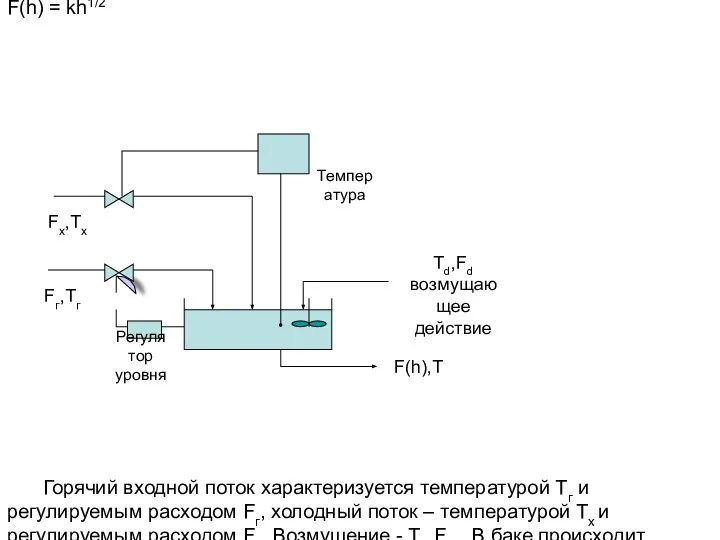 Смесительный бак с регулированием уровня и температуры. Пример
Смесительный бак с регулированием уровня и температуры. Пример Исследовательская работа по теме: «Познай самого себя.» Цель работы: Рассчитать механические характеристики человека: объём т
Исследовательская работа по теме: «Познай самого себя.» Цель работы: Рассчитать механические характеристики человека: объём т Теория относительности
Теория относительности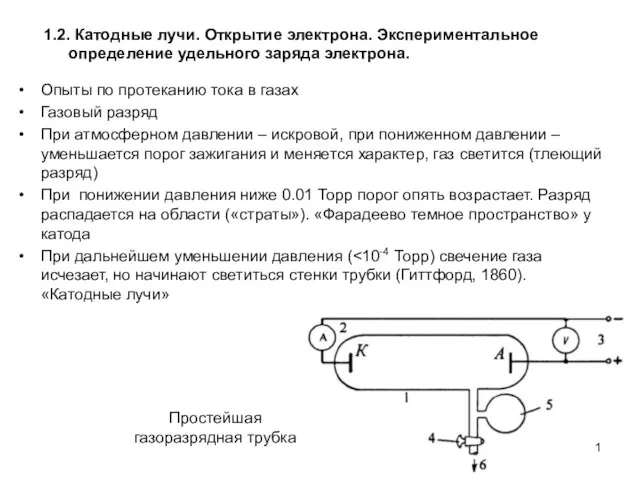 Катодные лучи. Открытие электрона. Экспериментальное определение удельного заряда электрона. АФ1.2
Катодные лучи. Открытие электрона. Экспериментальное определение удельного заряда электрона. АФ1.2 Ультрафиолетовые лучи
Ультрафиолетовые лучи  Электромагнитная совместимость и средства защиты. (Лекция 21)
Электромагнитная совместимость и средства защиты. (Лекция 21) Важнейшие открытия в современном естествознании. Высокотемпературная сверхпроводимость (ВТСП).
Важнейшие открытия в современном естествознании. Высокотемпературная сверхпроводимость (ВТСП). Произвольная плоская система сил
Произвольная плоская система сил Равномерное движение по окружности
Равномерное движение по окружности Развитие электротехники: этапы, направления
Развитие электротехники: этапы, направления Система уравнений Максвелла. Основные уравнения электродинамики
Система уравнений Максвелла. Основные уравнения электродинамики Умови плавання тіл. (Бінарний урок. 7 клас)
Умови плавання тіл. (Бінарний урок. 7 клас) Презентация по физике "Термоэлемент" - скачать
Презентация по физике "Термоэлемент" - скачать  Кинематика материальной точки и поступательного движения твердого тела
Кинематика материальной точки и поступательного движения твердого тела Способи збереження енергетичних ресурсів(енергозберігаючі технології) Учениці 8-А класу Прися
Способи збереження енергетичних ресурсів(енергозберігаючі технології) Учениці 8-А класу Прися СИЛА ТРЕНИЯ ПОКОЯ Силы в механике физика 7 класс
СИЛА ТРЕНИЯ ПОКОЯ Силы в механике физика 7 класс ФИЗИКА – 8 урок №51
ФИЗИКА – 8 урок №51 “Жарық техникасы және жарық көздері” пәні бойынша оқу-әдістемелік кешенін жасақтау
“Жарық техникасы және жарық көздері” пәні бойынша оқу-әдістемелік кешенін жасақтау Законы сохранения в механике
Законы сохранения в механике Тема: «Проводники и диэлектрики в электрическом поле»
Тема: «Проводники и диэлектрики в электрическом поле»  ИК-спектроскопия. История возникновения
ИК-спектроскопия. История возникновения Презентация по физике "Диффузия. Движение молекул" - скачать
Презентация по физике "Диффузия. Движение молекул" - скачать