Содержание
- 2. 15 октября, в пятницу, в 9-00 на СДО состоится Лекционная контрольная по Физической химии. Тема: «Первый
- 3. ОБЪЯСНИТЕ…
- 4. Лекция 10 Фазовые переходы 1-ого и 2-ого рода в однокомпонентной системе. Химический потенциалы «чистых» жидкого и
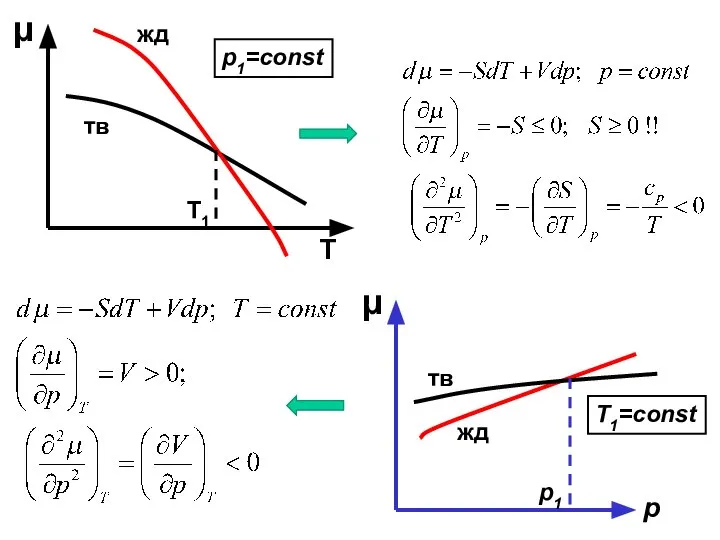
- 5. Химический потенциал компонента в однокомпонентной системе обладает следующими свойствами: 1) Убывает с температурой при постоянном давлении.
- 6. μ Т жд тв Т1 μ р тв жд p1=const T1=const p1 Т3 p1 пар тв
- 7. Какая форма записи уравнения Клаузиуса-Клапейрона для равновесия жидкость-пар в однокомпонентной системе правильная? Пар считайте реальным газом.
- 8. Химические потенциалы в жидких и твердых растворах
- 9. Химический потенциал компонетов в газовой фазе.
- 10. Химический потенциал чистого тв. и жид. компонента
- 11. Двухкомпонентные системы
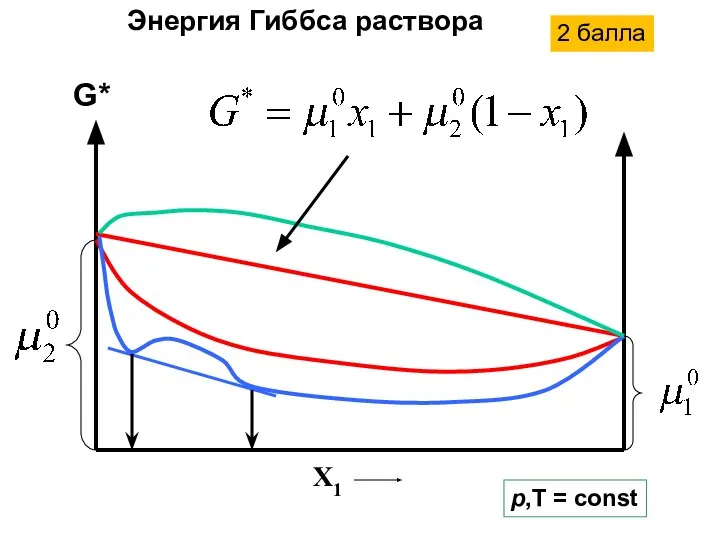
- 12. Энергия Гиббса в двухкомпонентной системе
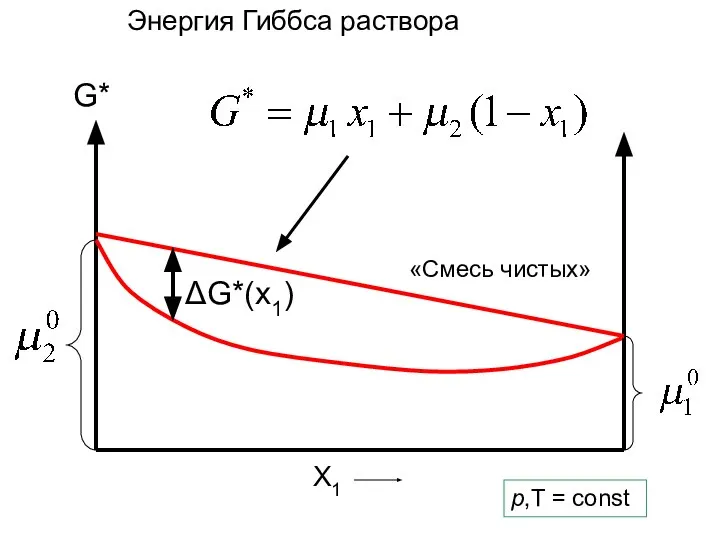
- 13. G* X1 p,T = const Энергия Гиббса раствора 2 балла
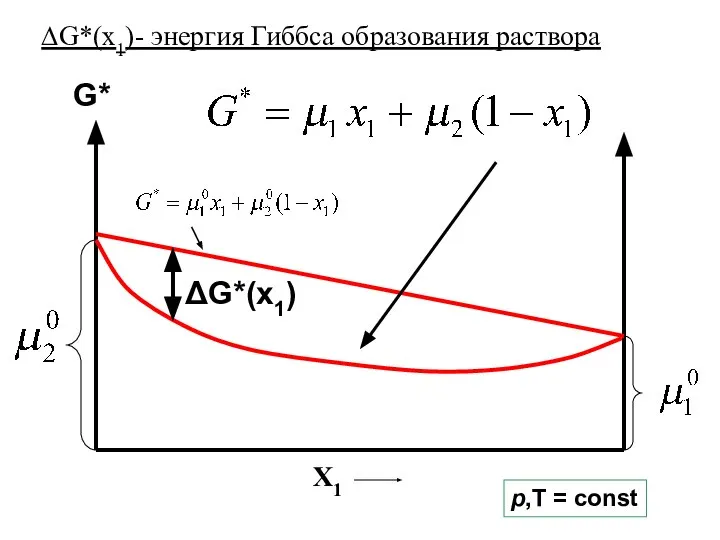
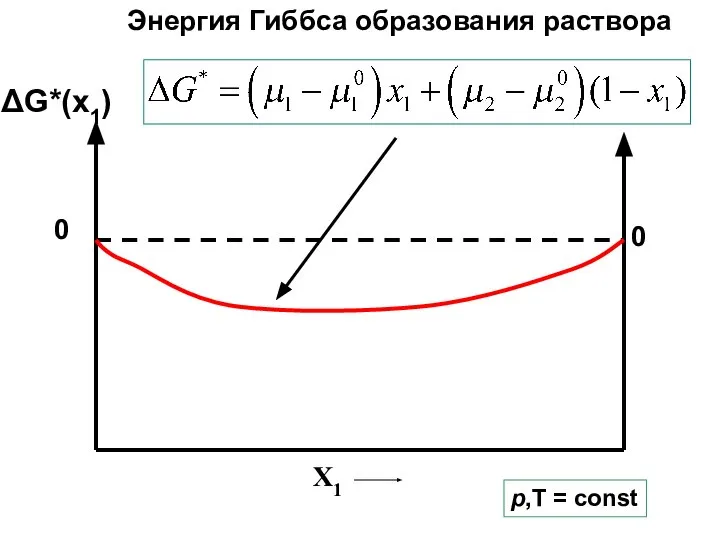
- 14. G* X1 ΔG*(x1) p,T = const ∆G*(x1)- энергия Гиббса образования раствора
- 15. пар Химический потенциал компонента в жидком и твердом растворе. Над чистым компонентом: Над раствором состава x1:
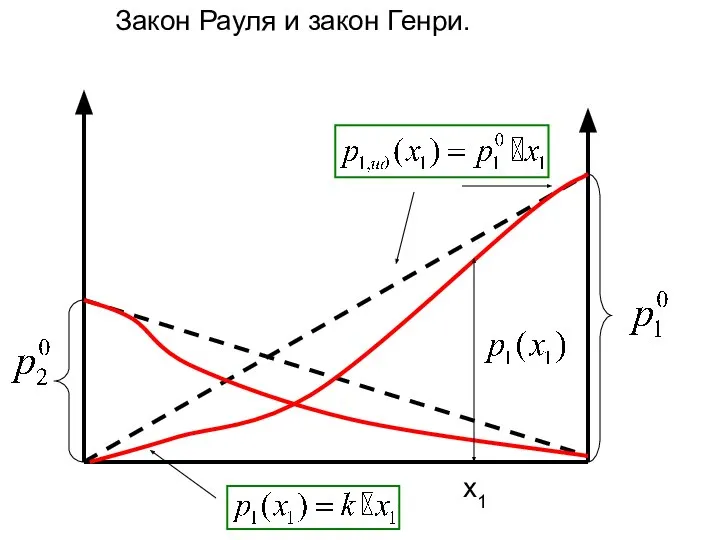
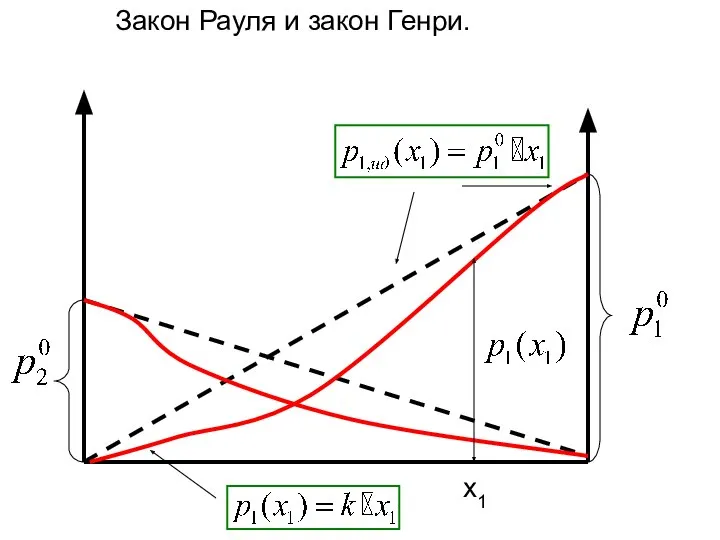
- 16. x1 Закон Рауля и закон Генри.
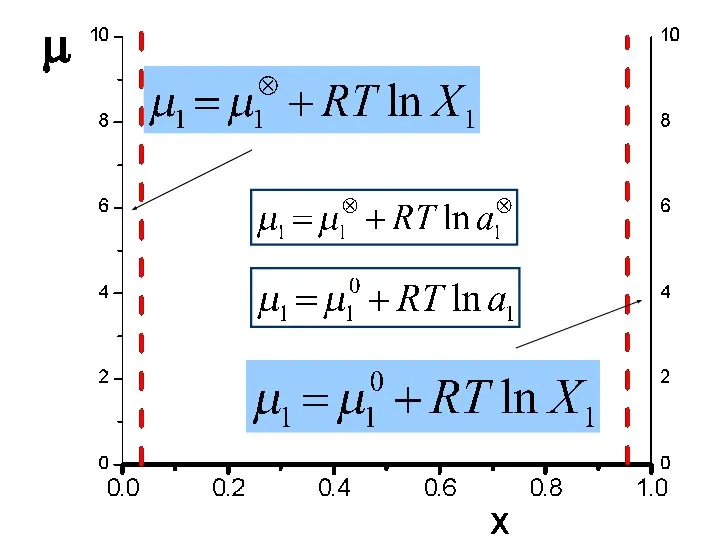
- 17. Химический потенциал компонента в идеальном жидком и твердом растворе Закон Рауля: Над раствора состава x1:
- 18. Химический потенциал компонента в реальном жидком и твердом растворе Способ измерения активности: Над раствора состава x1:
- 19. Химический потенциал компонента в газе и жидком и твердом растворе. Переход от идеального к реальному.. Жидк.,
- 20. x1 Закон Рауля и закон Генри.
- 21. Химический потенциал компонента в разбавленном жидком и (твердом) растворе. Ст. состояние, основанное на законе Генри. Точное
- 22. Зачем нужно стандартное состояние в б.р. р-ре ? Растворенное вещество A: Растворенный газ или тв. в-во,
- 24. Электрохимический потенциал.
- 25. Растворитель !
- 26. Первый закон термодинамики (дифференциальная форма) для закрытой системы, в которой совершается только работа расширения имеет вид:
- 27. В изолированной системе происходит самопроизвольный процесс. В результате этого у системы а) Энтропия может увеличиться; б)Энтропия
- 28. Уравнения Максвелла – это: Равенство производных U и S по естественным переменным; Равенство вторых смешанных производных
- 29. Первый закон термодинамики (дифференциальная форма) для закрытой системы, в которой совершается только работа расширения имеет вид:
- 30. В изолированной системе происходит самопроизвольный процесс. В результате этого у системы а) Энтропия может увеличиться; б)Энтропия
- 31. Уравнения Максвелла – это: Равенство вторых смешанных производных U и S по естественным переменным; Равенство вторых
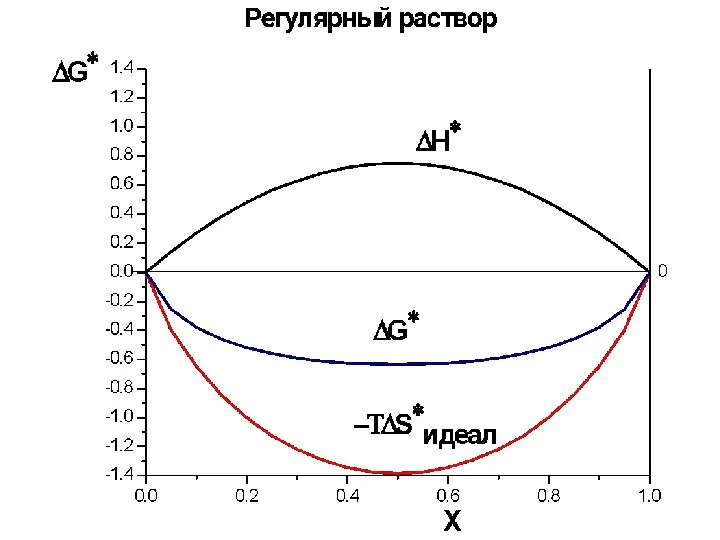
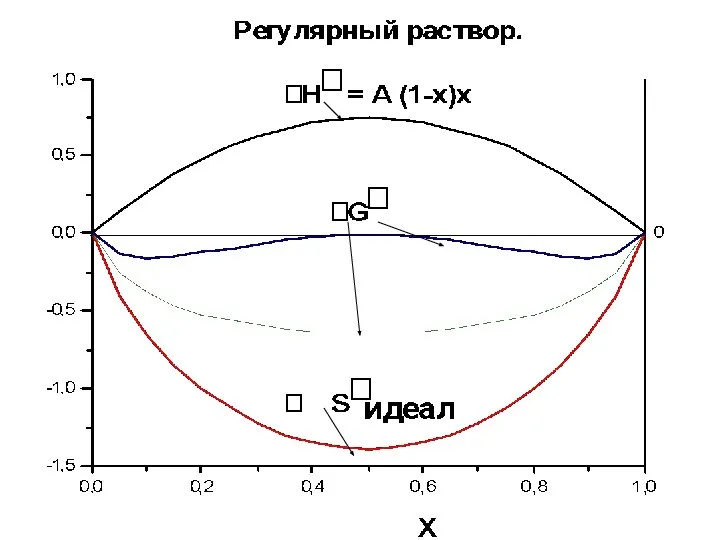
- 32. ТЕРМОДИНАМИЧЕСКИЕ МОДЕЛИ РАСТВОРОВ
- 33. G* X1 ΔG*(x1) p,T = const Энергия Гиббса раствора «Смесь чистых»
- 34. X1 ΔG*(x1) p,T = const Энергия Гиббса образования раствора 0 0
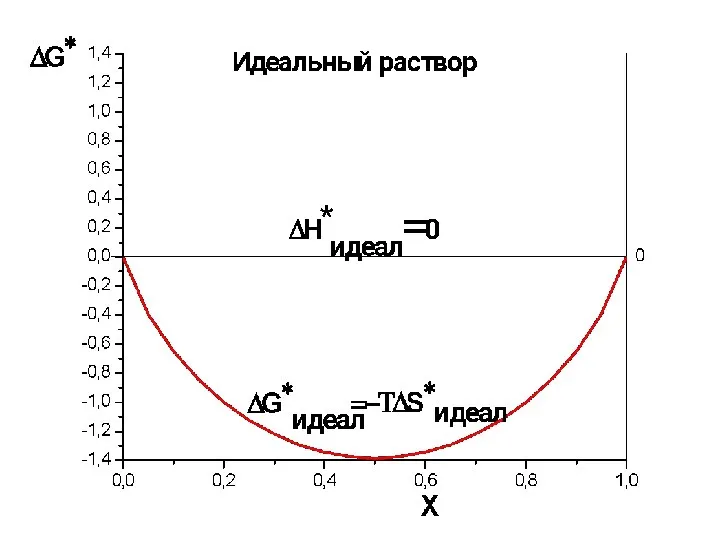
- 35. Термодинамика идеального раствора.
- 37. Избыточная энергия Гиббса
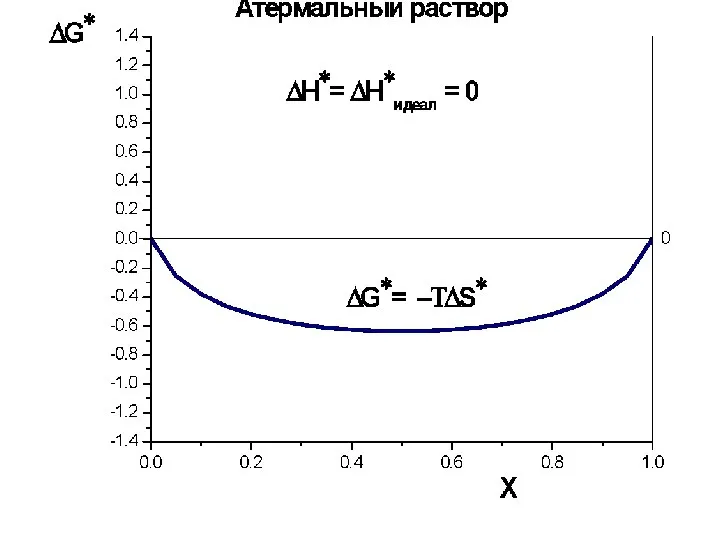
- 38. Избыточные величины Регул. ΔS*изб=0 Атерм. ΔН*изб=0
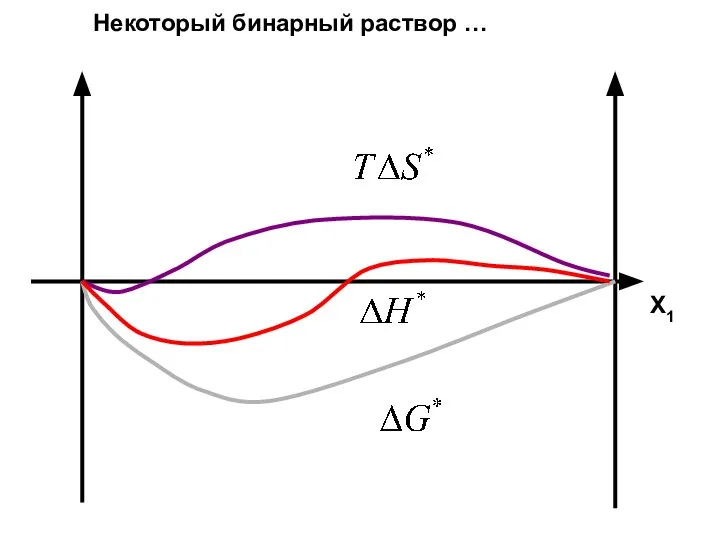
- 42. Х1 Некоторый бинарный раствор …
- 43. Другие модели растворов… Уравнение Дебая-Хюккеля Уравнение NRTL Эмпирические параметры:
- 45. Скачать презентацию

















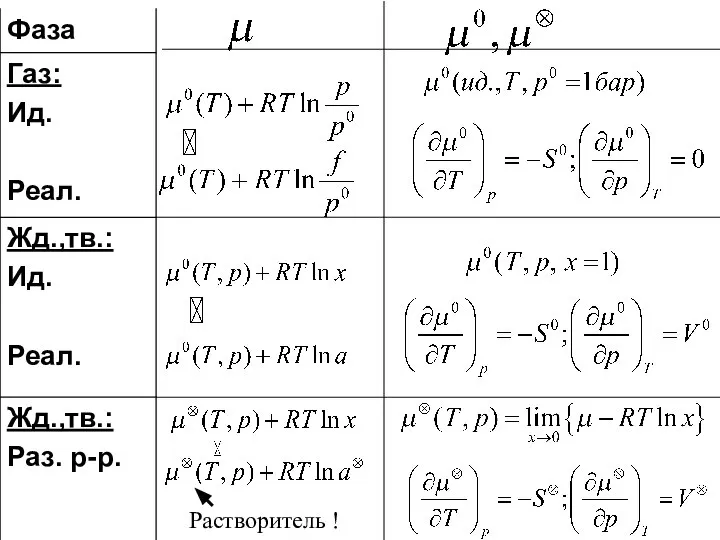











 Магнитное поле Земли
Магнитное поле Земли Принцип суперпозиции полей
Принцип суперпозиции полей Конвекция. Основной закон конвективного теплообмена. Уравнение Ньютона-Рихмана. Коэффициент теплоотдачи. Критерий Нуссельта
Конвекция. Основной закон конвективного теплообмена. Уравнение Ньютона-Рихмана. Коэффициент теплоотдачи. Критерий Нуссельта Электрофизические свойства барьеров Шоттки, на высокоомном арсениде галлия
Электрофизические свойства барьеров Шоттки, на высокоомном арсениде галлия Гелioсейсмологiя. Диференційне обертання і сонячний цикл
Гелioсейсмологiя. Диференційне обертання і сонячний цикл Работа с текстом. Электрический ток в цепи
Работа с текстом. Электрический ток в цепи Химическая эволюция веществ
Химическая эволюция веществ Статика
Статика Пространственная система сил
Пространственная система сил Разработка урока по теме: “Линзы” учитель физики ГОУ СОШ № 994 Чуприкова Т.И.
Разработка урока по теме: “Линзы” учитель физики ГОУ СОШ № 994 Чуприкова Т.И. Презентация по физике "Сокровища царства света" - скачать
Презентация по физике "Сокровища царства света" - скачать  Всемирное тяготение - притяжение всех тел во Вселенной
Всемирное тяготение - притяжение всех тел во Вселенной Электромагнитные колебания
Электромагнитные колебания Опыт Милликена. АФ1.4
Опыт Милликена. АФ1.4 Механизмы переноса тепла: теплопроводность, конвекция, излучение
Механизмы переноса тепла: теплопроводность, конвекция, излучение Электроемкость. Конденсаторы. Виды соединений конденсаторов
Электроемкость. Конденсаторы. Виды соединений конденсаторов Шум. Защита от шума
Шум. Защита от шума Электричество. Потенциал
Электричество. Потенциал Работа и мощность электрического тока
Работа и мощность электрического тока Тепловые двигатели
Тепловые двигатели Колебательный контур. Свободные и вынужденные колебания. Резонанс
Колебательный контур. Свободные и вынужденные колебания. Резонанс Исследование превращения потенциальной энергии упругой деформации в кинетическую энергию 10 класс Лабораторная работа
Исследование превращения потенциальной энергии упругой деформации в кинетическую энергию 10 класс Лабораторная работа  Ингибиторная фаза. Текстурная наследственность
Ингибиторная фаза. Текстурная наследственность Академия Транспортных Технологий
Академия Транспортных Технологий Молекулярная физика. Тепловые явления
Молекулярная физика. Тепловые явления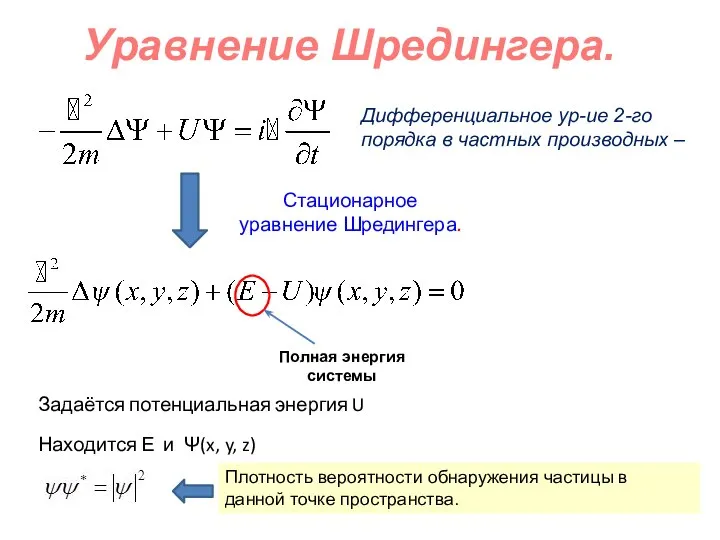 Уравнение Шредингера. Квантовые числа
Уравнение Шредингера. Квантовые числа Виды теплопередачи. Теплопроводность, конвекция, излучение
Виды теплопередачи. Теплопроводность, конвекция, излучение Физика - 7 Коллекция нескучных задач
Физика - 7 Коллекция нескучных задач