Содержание
- 2. Опыт Резерфорда (1911 г.) Опыт проведенный Э.Резерфордом: от радиоактивного источника, заключенного в свинцовый контейнер, α-частицы (ядра
- 3. Ядерная модель строения атомов Атом состоит из массивного положительно заряженного ядра. Вокруг ядра на значительном расстоянии
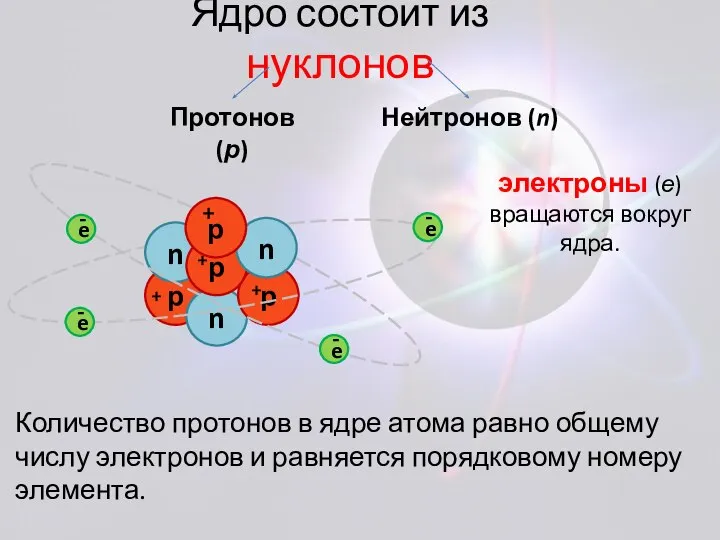
- 4. Ядро состоит из нуклонов Протонов (р) Нейтронов (n) Количество протонов в ядре атома равно общему числу
- 5. Протонно-нейтронная теория (1932 г., Иваненко-Гапон) A = Z + N A – массовое число Z –
- 7. Модель состояния электрона в атоме Быстро движущейся электрон может находиться в любой точке пространства. Различные его
- 8. Электроны, которые движутся в равноудаленных от ядра орбиталях образуют энергетические уровни. Главное квантовое число (n) –
- 9. Форма s-электронной орбитали (максимально возможно 2 электрона) Форма и ориентация р-орбиталей (максимальное количество электронов 6) Количества
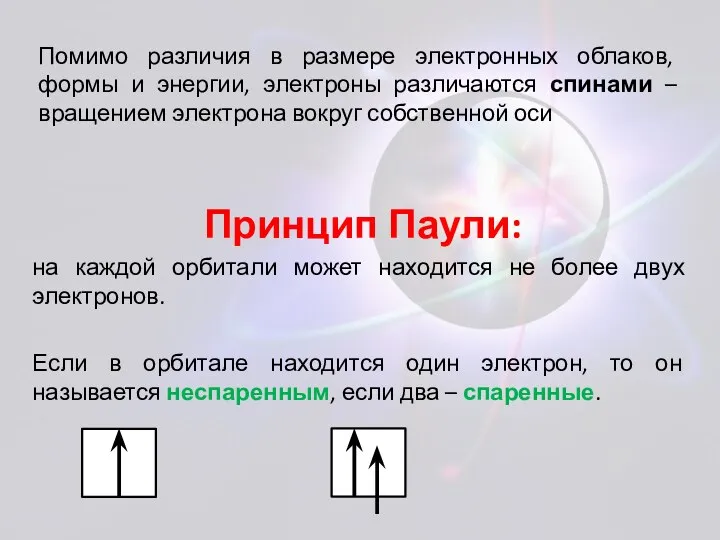
- 10. Принцип Паули: на каждой орбитали может находится не более двух электронов. Если в орбитале находится один
- 11. Принцип наименьшей энергии Порядок заполнения по правилу Хунда: электроны занимают орбитали одного подуровня сначала по одному
- 12. Электронные формулы – показывают расположение электронов на энергетических уровнях и подуровнях. Атом азота: порядковый номер 7
- 13. Наиболее устойчивое состояние – невозбужденное 6С 1s22s22p2 Если электрон переходит на другую орбиталь и приобретает большую
- 14. Валентные электроны принимают участие в образовании химической связи. Наиболее устойчивыми электронными конфигурациями являются электронные конфигурации инертных
- 15. «Проскок» электрона Это переход одного или нескольких электронов с s-подуровня на d-подуровень. При этом происходит частичное
- 17. Скачать презентацию












 Сила тока. Единицы силы тока и её измерение
Сила тока. Единицы силы тока и её измерение Министерство Образования и Науки РФ Муниципальное Общеобразовательное Учреждение Аксайская Средняя Общеобразовательная Школа
Министерство Образования и Науки РФ Муниципальное Общеобразовательное Учреждение Аксайская Средняя Общеобразовательная Школа  Тест по теме «Электромагнитные явления» Баскакова Т. И. Учитель физики МОУ ООШ № 48 г. Архангельск
Тест по теме «Электромагнитные явления» Баскакова Т. И. Учитель физики МОУ ООШ № 48 г. Архангельск  Явление само- и взаимоиндукции
Явление само- и взаимоиндукции Закон сохранения импульса
Закон сохранения импульса Материаловедение. Деформация и разрушение в металлах
Материаловедение. Деформация и разрушение в металлах ЕСДП
ЕСДП Исседоватльская деятельность учащихся на уроках физики
Исседоватльская деятельность учащихся на уроках физики Проект мастерской по ремонту и ТО МТП с организацией пункта диагностики в СХП Путь Ленина
Проект мастерской по ремонту и ТО МТП с организацией пункта диагностики в СХП Путь Ленина Презентация по физике "Ультразвук в медицине" - скачать
Презентация по физике "Ультразвук в медицине" - скачать  Телефон. Изобретение телеграфа и телефона
Телефон. Изобретение телеграфа и телефона Неньютоновские жидкости
Неньютоновские жидкости Радио. История и изобретение радио
Радио. История и изобретение радио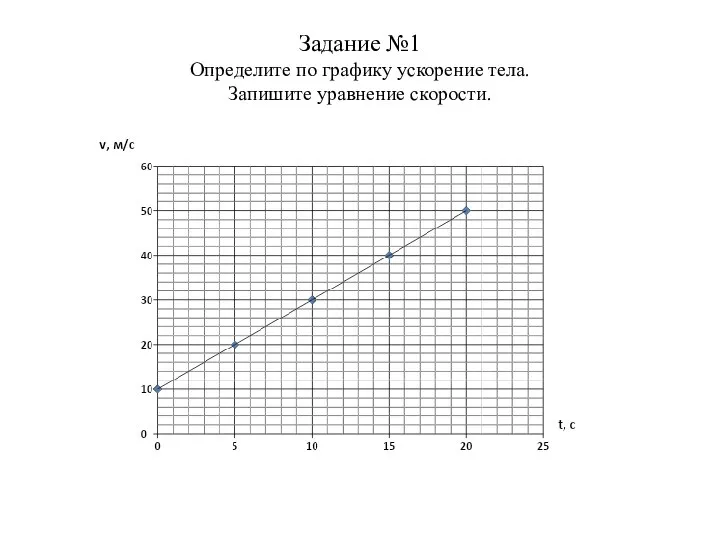 Определите по графику ускорение тела
Определите по графику ускорение тела Нобелевский лауреат Мария Склодовская-Кюри
Нобелевский лауреат Мария Склодовская-Кюри Лекция о работе с рациями
Лекция о работе с рациями Тепловые явления в природе: солнечно-земные связи Презентацию подготовил ученик 8 класса «А» МОУ Аннинский лицей Никулин Иван
Тепловые явления в природе: солнечно-земные связи Презентацию подготовил ученик 8 класса «А» МОУ Аннинский лицей Никулин Иван  Трансмісія об.447А. Приводи керування трансмісією. Механізми розподілу. (Тема 3.3)
Трансмісія об.447А. Приводи керування трансмісією. Механізми розподілу. (Тема 3.3) МОУ вечерняя (сменная) общеобразовательная школа г. Озёры. Школа педагогической, психологической и социальной поддержки учащи
МОУ вечерняя (сменная) общеобразовательная школа г. Озёры. Школа педагогической, психологической и социальной поддержки учащи Електродні процеси, їх біологічна роль та застосування в медицині. (Лекція 6)
Електродні процеси, їх біологічна роль та застосування в медицині. (Лекція 6) Тепловые двигатели
Тепловые двигатели Термодинамические циклы. Второе начало термодинамики. Энтропия. Термодинамические потенциалы
Термодинамические циклы. Второе начало термодинамики. Энтропия. Термодинамические потенциалы Дифракция света. Волновая оптика
Дифракция света. Волновая оптика Использование нестандартных форм проведения уроков физики с целью активизации познавательной деятельности учащихся. Презентаци
Использование нестандартных форм проведения уроков физики с целью активизации познавательной деятельности учащихся. Презентаци Волновое уравнение
Волновое уравнение Электромагнитная совместимость в электроэнергетике
Электромагнитная совместимость в электроэнергетике Ядерный реактор
Ядерный реактор Геометрическая и волновая оптика. Корпускулярно-волновая теория света
Геометрическая и волновая оптика. Корпускулярно-волновая теория света