Содержание
- 2. Struktura hmoty http://www.accessexcellence.org/AE/AEC/CC/historical_background.html Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno
- 3. Hmota a energie Vše je tvořeno základními částicemi hmoty (látkou) a energetickými poli/silami, což též znamená,
- 4. Elementární částice hmoty Elementární (tj. nemající vnitřní strukturu) částice hmoty jsou leptony a kvarky. Jsou označovány
- 5. Čtyři základní interakce / energie / silová pole Uvádí se, že při interakční vzdálenosti objektů řádově
- 6. Fotony Fotony – energetická kvanta elektromagnetického pole, nulová klidová hmotnost, chovají se někdy jako částice Energie
- 7. Částice a energetická kvanta pole Částice látky a energetická kvanta (fotony) mají schopnost vzájemné transformace (např.
- 8. Kvantová mechanika Chování souborů určitého druhu částic lze popsat rovnicemi, které se podobají rovnicím pro popis
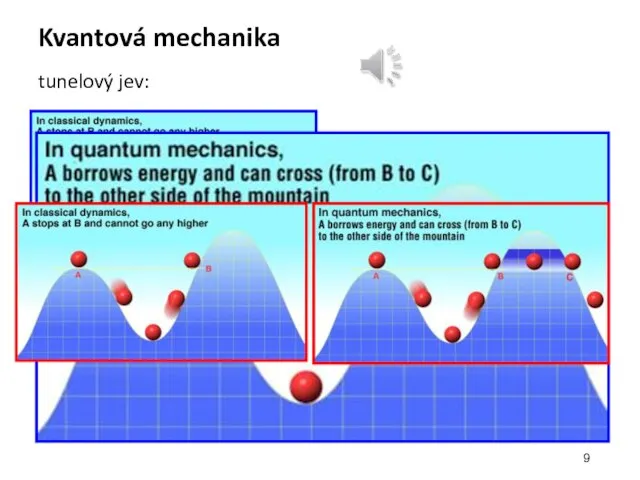
- 9. Kvantová mechanika tunelový jev:
- 10. Kvantová mechanika: Heisenbergovy relace (vztahy) neurčitosti δrδp ≥ h/2π δΕδt ≥ h/2π Poloha r a hybnost
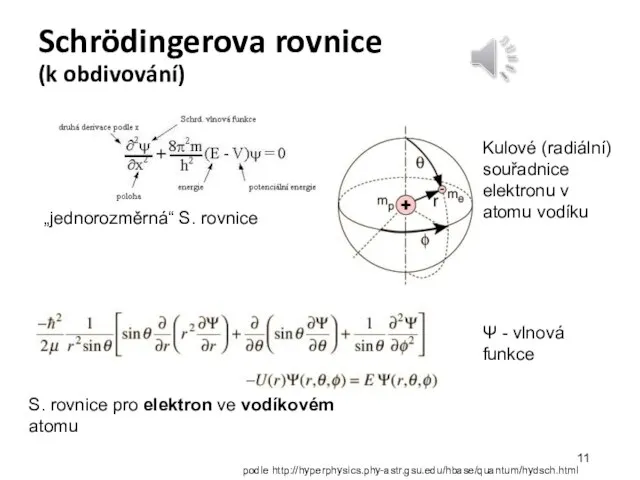
- 11. Schrödingerova rovnice (k obdivování) „jednorozměrná“ S. rovnice Kulové (radiální) souřadnice elektronu v atomu vodíku Ψ -
- 12. Řešení Schrödingerovy rovnice Řešení Schrödingerovy rovnice pro elektron ve vodíkovém atomu vede k hodnotám energie orbitálního
- 13. Kvantová čísla Hlavní n = 1, 2, 3 …. (K, L, M, ….) Vedlejší – pro
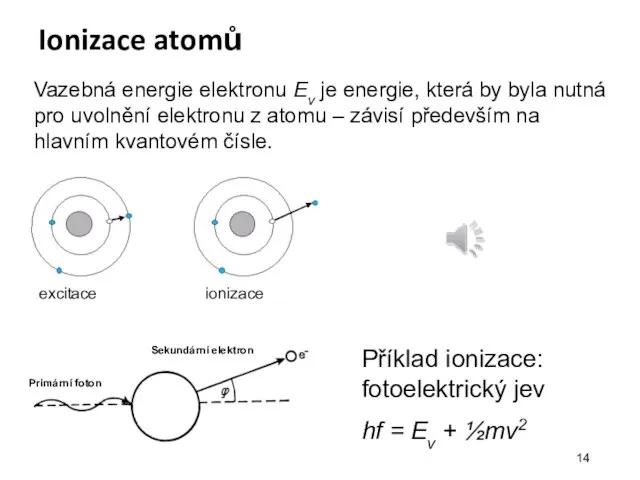
- 14. Ionizace atomů Příklad ionizace: fotoelektrický jev hf = Ev + ½mv2 Vazebná energie elektronu Ev je
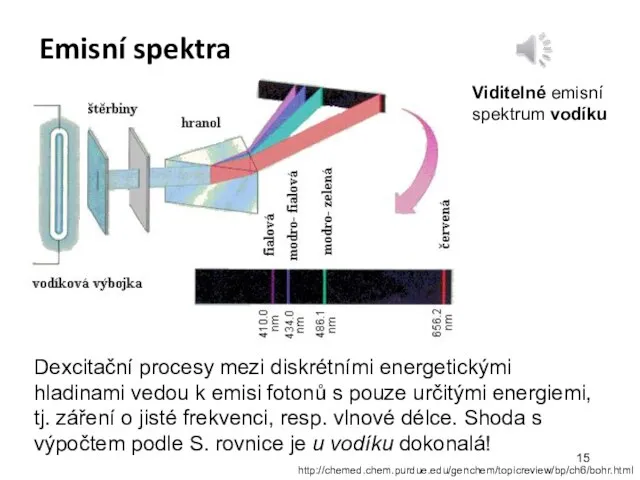
- 15. Emisní spektra Dexcitační procesy mezi diskrétními energetickými hladinami vedou k emisi fotonů s pouze určitými energiemi,
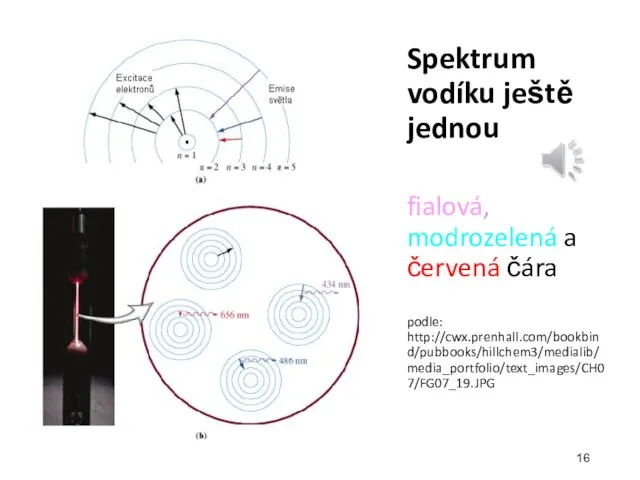
- 16. Spektrum vodíku ještě jednou fialová, modrozelená a červená čára podle: http://cwx.prenhall.com/bookbind/pubbooks/hillchem3/medialib/media_portfolio/text_images/CH07/FG07_19.JPG
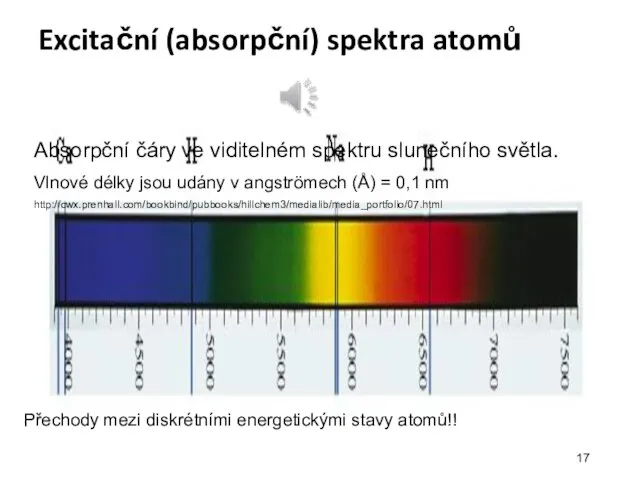
- 17. Excitační (absorpční) spektra atomů Absorpční čáry ve viditelném spektru slunečního světla. Vlnové délky jsou udány v
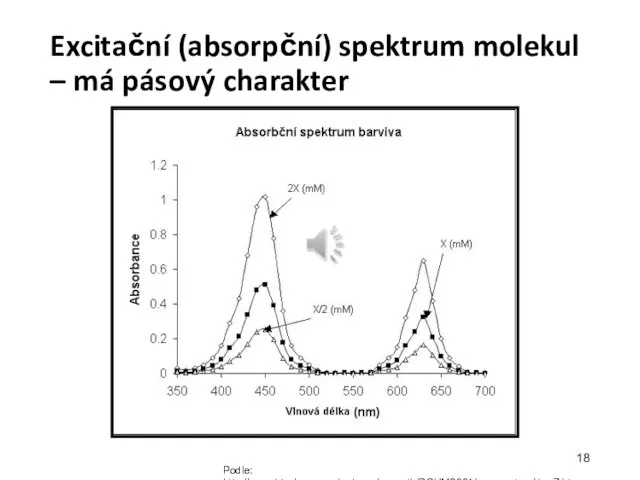
- 18. Excitační (absorpční) spektrum molekul – má pásový charakter Podle: http://www.biochem.usyd.edu.au/~gareth/BCHM2001/pracposters/dyeZ.htm
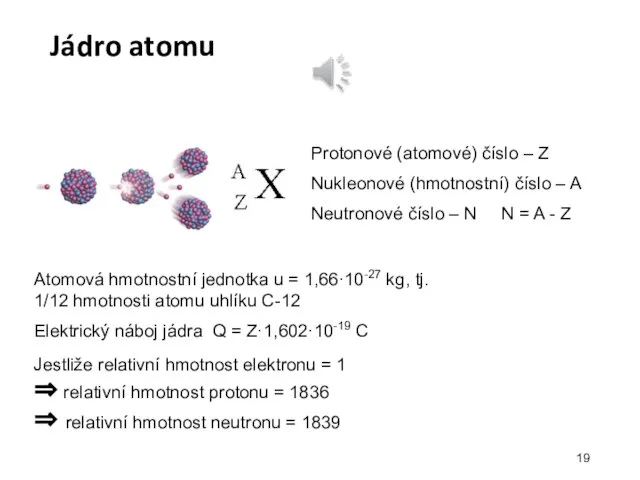
- 19. Jádro atomu Protonové (atomové) číslo – Z Nukleonové (hmotnostní) číslo – A Neutronové číslo – N
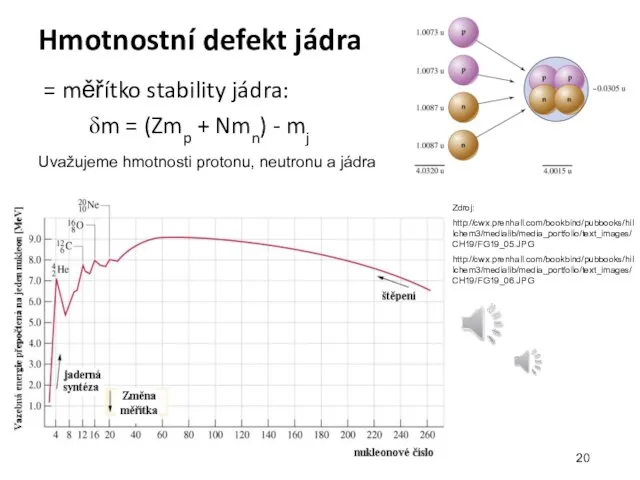
- 20. Hmotnostní defekt jádra = měřítko stability jádra: δm = (Zmp + Nmn) - mj Zdroj: http://cwx.prenhall.com/bookbind/pubbooks/hillchem3/medialib/media_portfolio/text_images/CH19/FG19_05.JPG
- 21. Nuklidy nuklid – jádra se stejnými hodnotami A, Z a energie Izotopy - nuklidy se stejným
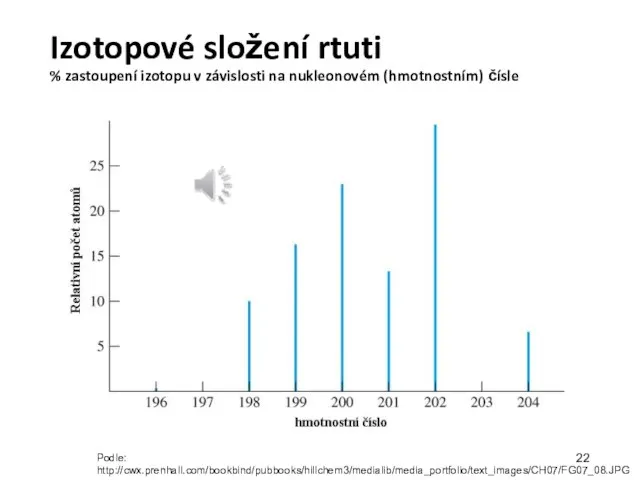
- 22. Izotopové složení rtuti % zastoupení izotopu v závislosti na nukleonovém (hmotnostním) čísle Podle: http://cwx.prenhall.com/bookbind/pubbooks/hillchem3/medialib/media_portfolio/text_images/CH07/FG07_08.JPG
- 23. Co je ještě nutné znát? Radionuklidy – nuklidy schopné radioaktivní přeměny Jaderný spin: Jádra mají vlastnost
- 25. Скачать презентацию











 Методическая разработка раздела «Тепловые явления» 8 класс Выполнил: учитель физики МОУ СОШ № 185 Симонова Т. А.
Методическая разработка раздела «Тепловые явления» 8 класс Выполнил: учитель физики МОУ СОШ № 185 Симонова Т. А.  Региональный чемпионат Молодые профессионалы Москвы по стандартам JuniorSkills
Региональный чемпионат Молодые профессионалы Москвы по стандартам JuniorSkills А.М. НОВИКОВ Д.А. НОВИКОВ МЕТОДОЛОГИЯ НАУЧНОГО ИССЛЕДОВАНИЯ
А.М. НОВИКОВ Д.А. НОВИКОВ МЕТОДОЛОГИЯ НАУЧНОГО ИССЛЕДОВАНИЯ Теплотехника и тепловые установки
Теплотехника и тепловые установки Презентация по физике "Шаровая молния 10 класс" - скачать
Презентация по физике "Шаровая молния 10 класс" - скачать  Аттестационная работа. План-конспект урока с использованием элементов исследовательской деятельности. Испарение и конденсация
Аттестационная работа. План-конспект урока с использованием элементов исследовательской деятельности. Испарение и конденсация Квантовая статистика
Квантовая статистика Применение лазера в медицине
Применение лазера в медицине Полное отражение
Полное отражение Уравнение вращения твердого тела вокруг неподвижной оси. Момент инерции
Уравнение вращения твердого тела вокруг неподвижной оси. Момент инерции ИСТОРИЯ ОТКРЫТИЯ РАДИОАКТИВНОСТИ Н.М.Вострикова МОУ СОШ № 62, Центральный район, г. Воронеж
ИСТОРИЯ ОТКРЫТИЯ РАДИОАКТИВНОСТИ Н.М.Вострикова МОУ СОШ № 62, Центральный район, г. Воронеж Метод конечных элементов
Метод конечных элементов Опыты по рассеянию альфа-частиц. Резерфордовская модель атома. АФ1.9
Опыты по рассеянию альфа-частиц. Резерфордовская модель атома. АФ1.9 Аттестационная работа. Методическая разработка проекта по физике на тему «Сила трения и движение»
Аттестационная работа. Методическая разработка проекта по физике на тему «Сила трения и движение» Професія автомеханіка
Професія автомеханіка Виды наноструктур. Особенности наночастиц и наноструктурированных материалов
Виды наноструктур. Особенности наночастиц и наноструктурированных материалов Исследовательское задание: ВЛАЖНАЯ УБОРКА Выполнили: 8 класс: Калач Валерия, Пац Егор, Балейко Алексей, Жук Максим, Хмурчик Никит
Исследовательское задание: ВЛАЖНАЯ УБОРКА Выполнили: 8 класс: Калач Валерия, Пац Егор, Балейко Алексей, Жук Максим, Хмурчик Никит Гук заңы
Гук заңы Презентация по физике "Электромагнитные явления" - скачать бесплатно
Презентация по физике "Электромагнитные явления" - скачать бесплатно Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей. Проводники и диэлектрики
Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей. Проводники и диэлектрики Кинематика
Кинематика Презентация по физике "Физика как наука" - скачать _
Презентация по физике "Физика как наука" - скачать _ Фізичні терміни. Атом
Фізичні терміни. Атом Топливно-энергетические ресурсы
Топливно-энергетические ресурсы Нагрузки, действующие на элементы наземной космической инфраструктуры
Нагрузки, действующие на элементы наземной космической инфраструктуры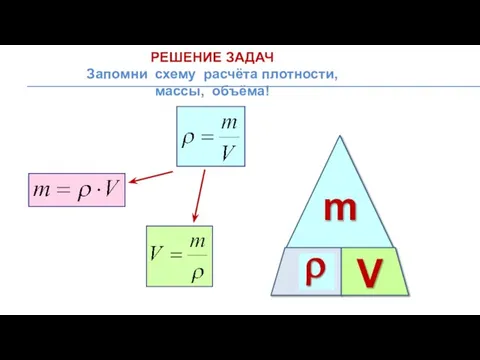 Решение задач на плотность
Решение задач на плотность Голографическая защита информации
Голографическая защита информации Решение задач. Силы тяжести, упругости
Решение задач. Силы тяжести, упругости