Содержание
- 2. Обычные растворы (NaCl, CaCl2, сахара) Прозрачны (пропускают свет) Высокое осмотическое давление и скорость диффузии Растворенное вещество
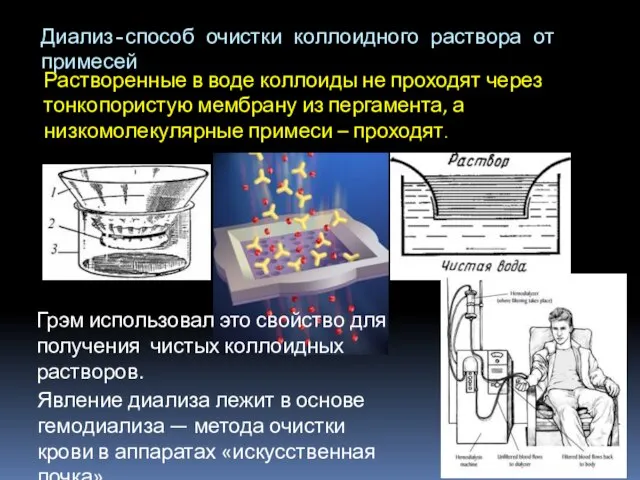
- 3. Диализ-способ очистки коллоидного раствора от примесей Растворенные в воде коллоиды не проходят через тонкопористую мембрану из
- 4. В коллоидных растворах вещество находится не в виде отдельных молекул, а в виде дисперсных частиц –
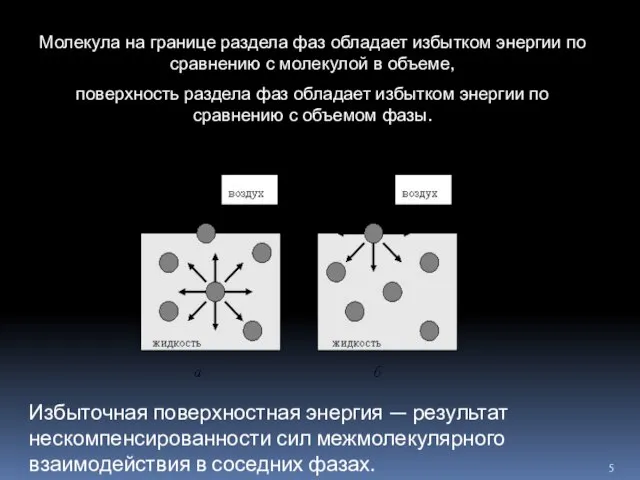
- 5. Молекула на границе раздела фаз обладает избытком энергии по сравнению с молекулой в объеме, поверхность раздела
- 6. Удельная поверхностная энергия Поверхностное натяжение при P и T = const избыточная поверхностная энергия Гиббса G
- 7. Вещества в поверхностных слоях обладают избытком энергии, доля вещества, принадлежащего поверхности, наиболее велика в дисперсных (коллоидных)
- 8. Граница раздела фаз (поверхность) Избыточная поверхностная энергия Термодинамическая неустойчивость Поверхностные явления
- 9. Основная т/д причина поверхностных явлений – стремление системы к снижению избыточной поверхностной энергии. G = σ
- 10. поверхностные явления как результат уменьшения S образование сферической поверхности частицы; образование идеально гладкой поверхности (на границе
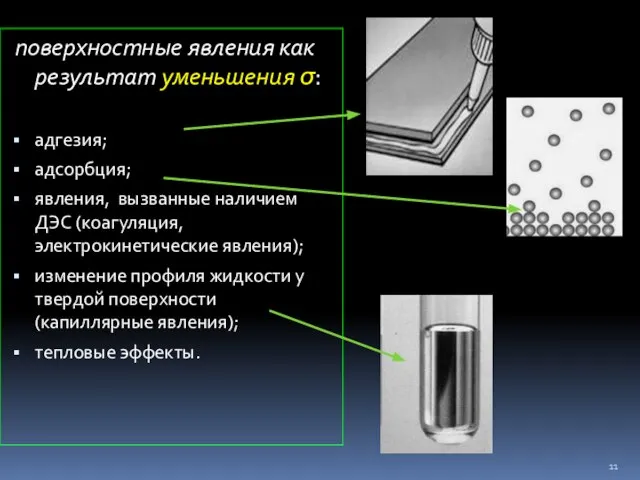
- 11. поверхностные явления как результат уменьшения σ: адгезия; адсорбция; явления, вызванные наличием ДЭС (коагуляция, электрокинетические явления); изменение
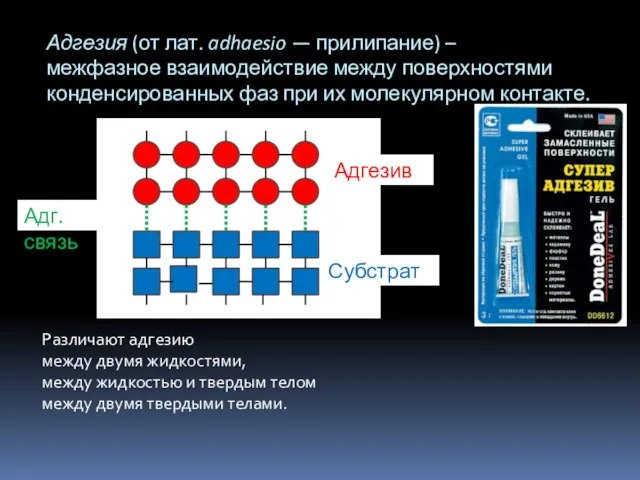
- 12. Различают адгезию между двумя жидкостями, между жидкостью и твердым телом между двумя твердыми телами. Адгезия (от
- 13. Работа адгезии Wa (Дж/м2) — работа обратимого разрыва адгезионной связи между двумя фазами, отнесенная к единице
- 14. ►► О когезии — в параграфе 6.1.3 Механизм процессов адгезии Силы различной природы: Химические – max
- 15. Когезия отражает связь внутри одной фазы, характеризуя ее прочность и способность противодействовать внешнему усилию. Адгезия характеризует
- 16. Работа когезии определяется затратой энергии на обратимый изотермический разрыв фазы, отнесенной к единице площади. Wк =
- 17. Жидкость на поверхности твердого тела. В зависимости от соотношения между силами адгезии между жидкостью и тв.
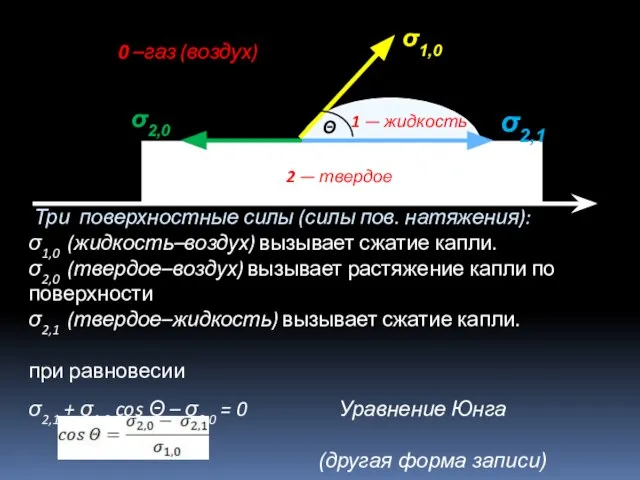
- 18. Три поверхностные силы (силы пов. натяжения): σ1,0 (жидкость–воздух) вызывает сжатие капли. σ2,0 (твердое–воздух) вызывает растяжение капли
- 19. Основные способы модификация поверхности твердой фазы (изменение σ2,0) Легче смачиваются тв. тела с большим значением σ2,0
- 20. σ2,1 + σ1,0 cosΘ – σ2,0 = 0 (ур. Юнга) σ1,0 cosΘ = σ2,0 –σ2,1 Условия
- 21. Поверхностная пленка – такой поверхностный слой, отдельные компоненты которого (или хотя бы один из них) отсутствуют
- 22. И. Ленгмюр поверхностное давление π (как σ) мономолекулярная пленка – «двумерный газ» «газовый закон» S –
- 24. Скачать презентацию
















 Презентация по физике "Прості механізми. Важіль.і" - скачать бесплатно
Презентация по физике "Прості механізми. Важіль.і" - скачать бесплатно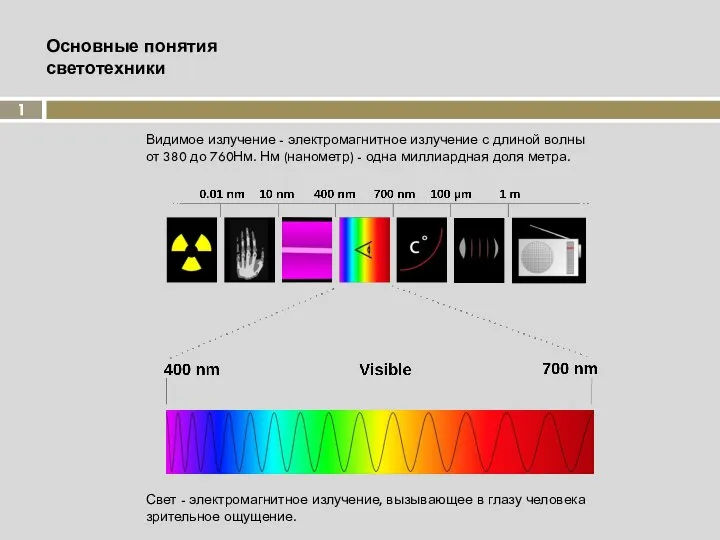 Основные понятия светотехники
Основные понятия светотехники Звездный час. Часть 2
Звездный час. Часть 2 Газотурбинные установки
Газотурбинные установки Лазер (англ. Laser, акроним от англ. Light amplification by stimulated emission of radiation)
Лазер (англ. Laser, акроним от англ. Light amplification by stimulated emission of radiation) Метод эквивалентного генератора
Метод эквивалентного генератора Город будущего
Город будущего Сверхпроводники. Сверхпроводимость
Сверхпроводники. Сверхпроводимость Своя игра Звук
Своя игра Звук Теорема об изменении кинетической энергии системы
Теорема об изменении кинетической энергии системы Методы расчета статически определимых систем на постоянную нагрузку (продолжение)
Методы расчета статически определимых систем на постоянную нагрузку (продолжение) Дифракция света.
Дифракция света.  Основы механики. Кинематика. Тема №1
Основы механики. Кинематика. Тема №1 Презентация Кпд теплого двигателя
Презентация Кпд теплого двигателя  Макет механизма раскрытия солнечного паруса
Макет механизма раскрытия солнечного паруса Биологическое действие радиации. Закон радиоактивного распада
Биологическое действие радиации. Закон радиоактивного распада Радио Попова
Радио Попова Mechacnics. Molecular physics and Thermodynamics. Electricity. Magnetism
Mechacnics. Molecular physics and Thermodynamics. Electricity. Magnetism Функции биологических мембран
Функции биологических мембран Электрический ток и его источники
Электрический ток и его источники Дисперсія та поляризація світла
Дисперсія та поляризація світла  Массообменные процессы. Общие сведения. (Лекция 1)
Массообменные процессы. Общие сведения. (Лекция 1) Выталкивающая сила. Закон Архимеда
Выталкивающая сила. Закон Архимеда 53 Дейдвудное устройство современных судов
53 Дейдвудное устройство современных судов Презентация по физике Механическая энергия Закон сохранения энергии
Презентация по физике Механическая энергия Закон сохранения энергии 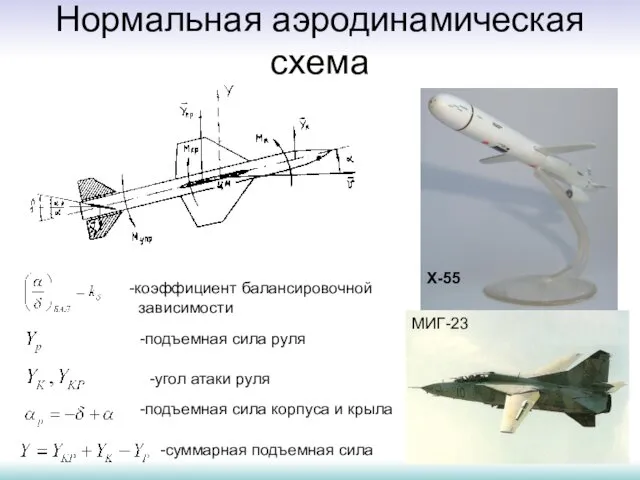 Нормальная аэродинамическая схема
Нормальная аэродинамическая схема Електричний струм види зарядів у газах
Електричний струм види зарядів у газах  Коллоквиум №2
Коллоквиум №2