Содержание
- 2. Работа идеального газа в изопроцессах Элементарная работа, совершаемая газом при перемещении поршня на dh где F
- 3. Работа, совершаемая газом при увеличении объема от V1 до V2: (12.2) Формула (12.2) справедлива для любых
- 4. Из (12.2) при Тогда работа идеального газа в изотермическом процессе (12.3)
- 5. Работа газа в изобарическом процессе при Из (12.2) (12.4) Работа газа в изохорическом процессе при Из
- 6. Теплоемкость идеального газа при изопроцессах. Теплоемкость идеального газа. Теплоемкость тела – количество теплоты, необходимое для нагрева
- 7. Удельная теплоемкость вещества – количество теплоты, необходимое для нагревания единицы массы данного вещества на один градус
- 8. где μ – молярная масса вещества, ν =m/μ – количество вещества в теле. Размерность в СИ
- 9. Из (10.1) для ν = 1, p = const тогда Теплоемкость 1 моля идеального газа при
- 10. Адиабатический процесс, уравнение Пуассона Адиабатический (адиабатный) процесс – процесс, который происходит без теплообмена с окружающей средой
- 11. Из ур-я состояния идеального газа при ν = 1 Учтем (12.7), (12.8). Обозначим
- 12. тогда где с – постоянная интегрирования. Откуда уравнение адиабаты в переменных p, V или уравнение Пуассона
- 13. Отметим, что адиабата идет круче изотермы (pV = const ), т.к. γ > 1. (12.12) С
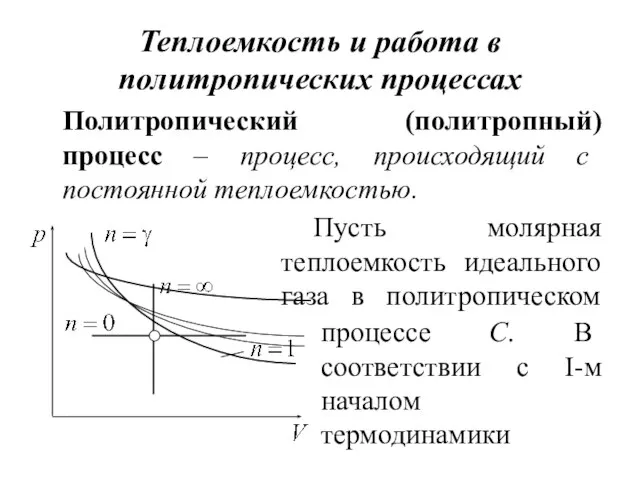
- 14. Теплоемкость и работа в политропических процессах Политропический (политропный) процесс – процесс, происходящий с постоянной теплоемкостью. Пусть
- 15. (12.13) Подставляя (12.13) в выражение для полного дифференциала от уравнения Клапейрона-Менделеева: ⇒
- 16. или с учетом уравнения Майера (12.9) (12.14) При C ≠ CV, на основании формул (12.13) и
- 17. Показатель политропы (12.16) → зависимость молярной теплоемкости C от показателя политропы n (12.17) Преобразовав (12.15) к
- 18. после интегрирования получим уравнение политропического процесса или политропы (12.18) Уравнение политропы можно записать в термодинамических координатах
- 19. Из (12.17) молярная теплоемкость изотермического процесса C →∞ (n = 1). Работу газа в политропическом процессе
- 20. где p1, V1 – начальные давление и объем газа; V2 – конечный объем газа. (12.21) Из
- 21. Формула (12.21) неприменима для описания изохорического (C ≠ CV) и изотермического (C→∞) процессов.
- 22. Газ Ван-дер-Ваальса И. Ван-дер-Ваальс предложил уравнение состояния реального газа, учитывающее конечность объема молекул и наличие межмолекулярных
- 23. Для одного моля газа член имеет размерность давления и учитывает притяжение молекул в результате межмолекулярного взаимодействия.
- 24. Силы притяжения внутри газа в среднем скомпенсированы для каждой отдельной молекулы. На расположенные в тонком слое
- 25. Толщина этих слоев определяется радиусом действия сил притяжения и имеет тот же порядок величины. При увеличении
- 26. Тогда суммарное давление внутри газа Здесь p – давление газа на стенку сосуда, a0 – постоянная,
- 27. Обозначим Тогда Поправка, связанная с действием сил отталкивания. Учитываем только парные взаимодействия между молекулами, поэтому эти
- 28. Зависимость сил отталкивания от расстояния между молекулами определяет эффективное сечение взаимодействия молекул, т.е. их размеры. Для
- 29. получим Здесь b0 – коэффициент, определяемый физико-химическими свойствами молекул газа. Обозначив (12.25) При больших V, а
- 30. Уравнение Ван-дер-Ваальса является приближенным и количественно определяет свойства реальных газов лишь в области высоких температур и
- 32. При T>Tкр вещество может находиться только в одном (газообразном) состоянии, а при T Точки прямой ac
- 33. Равновесию фаз при определенной температуре T соответствует давление насыщенного пара pнп и интервал объемов от Vж
- 34. переохлажденному пару (метастабильные состояния). Участок de физически неосуществим, так как здесь происходит увеличение объема V при
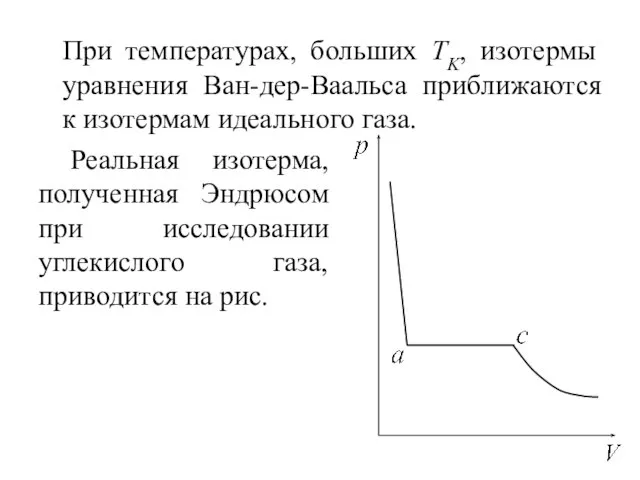
- 35. При температурах, больших TK, изотермы уравнения Ван-дер-Ваальса приближаются к изотермам идеального газа. Реальная изотерма, полученная Эндрюсом
- 36. Внутренняя энергия газа Ван-дер-Ваальса Пусть газ Ван-дер-Ваальса участвует в адиабатическом процессе. Тогда (12.26) При тех же
- 37. Подставим в эту формулу соотношения (12.23) и (12.25) (12.27) Первое слагаемое в правой части (12.27), согласно
- 38. После интегрирования С учетом Выражения для внутренней энергии газа Ван-дер-Ваальса
- 39. (12.28) Внутренняя энергия газа Ван-дер-Ваальса зависит не только от его температуры, как в случае с идеальным
- 41. Скачать презентацию




































 Изменение изотопного состава. Выгорание топлива
Изменение изотопного состава. Выгорание топлива Корпускулярно-волновой дуализм
Корпускулярно-волновой дуализм Принцип работы бесщеточного двигателя постоянного тока. Простейшие схемы двигателей. (Лекция 2)
Принцип работы бесщеточного двигателя постоянного тока. Простейшие схемы двигателей. (Лекция 2) Статус-отчет по дистанционному курсу по законам развития технических систем ТРИЗ. Шаблон
Статус-отчет по дистанционному курсу по законам развития технических систем ТРИЗ. Шаблон Движение по окружности
Движение по окружности Передачи винт-гайка
Передачи винт-гайка Электромагниты Применение электромагнитов МОУ «Ужурская школа 1 имени А. К. Харченко» Учитель физики Шалагина Елена Николаевна
Электромагниты Применение электромагнитов МОУ «Ужурская школа 1 имени А. К. Харченко» Учитель физики Шалагина Елена Николаевна Стартер, генератор, аккумуляторная батарея
Стартер, генератор, аккумуляторная батарея Презентация по физике "Введение в механику" - скачать
Презентация по физике "Введение в механику" - скачать  Температура. Шкала Реомюра
Температура. Шкала Реомюра Презентация по физике "Основы Вакуумной Техники 9 лекция" - скачать бесплатно
Презентация по физике "Основы Вакуумной Техники 9 лекция" - скачать бесплатно Саратовская область,Советский район, Муниципальное общеобразовательное учреждение-основная общеобразовательная школа с.Роз
Саратовская область,Советский район, Муниципальное общеобразовательное учреждение-основная общеобразовательная школа с.Роз Преобразователи постоянного напряжения
Преобразователи постоянного напряжения Измерительные трансформаторы. (Лекция 9)
Измерительные трансформаторы. (Лекция 9) Способы создания нанообъектов и наноматериалов
Способы создания нанообъектов и наноматериалов Уравнение на площадь сечения трубки реактора
Уравнение на площадь сечения трубки реактора Схема газохроматографического анализа
Схема газохроматографического анализа Открытие и исследование векторных бозонов в эксперименте ATLAS
Открытие и исследование векторных бозонов в эксперименте ATLAS Масс-спектрометры. АФ1.6
Масс-спектрометры. АФ1.6 Законы Ньютона. (Лекция 3)
Законы Ньютона. (Лекция 3) Діелектрики та провідники в електростатичному полі
Діелектрики та провідники в електростатичному полі Электротехника и электроника. Цепи с распределенными параметрами. (Лекция 15)
Электротехника и электроника. Цепи с распределенными параметрами. (Лекция 15) Хакас тiлiнiy сjстiг пайы
Хакас тiлiнiy сjстiг пайы Затухающие колебания
Затухающие колебания Презентация на тему: Ядерные реакции
Презентация на тему: Ядерные реакции Строение атома
Строение атома Последовательное соединение проводников
Последовательное соединение проводников Элементарные частицы
Элементарные частицы