Возникновение атомистической гипотезы строения вещества и ее экспериментальные доказательства. Идеальный газ
Содержание
- 2. Цель работы: сформировать представления о структуре и содержании новой физической теории, организовать усвоение основных положений МКТ
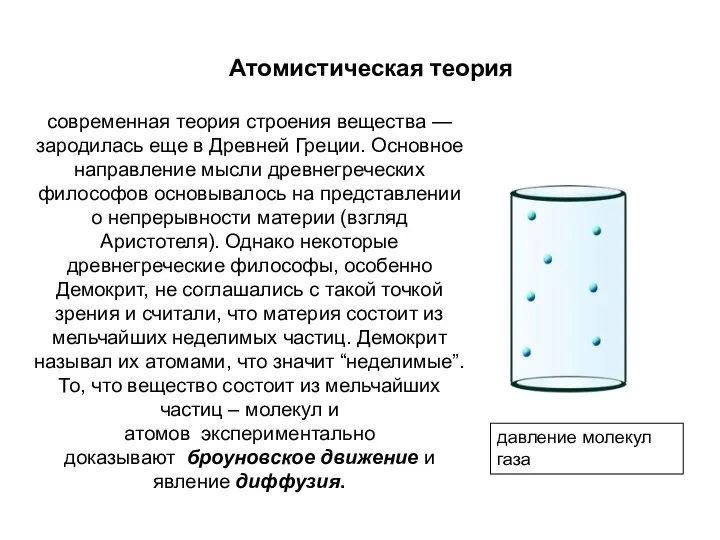
- 3. Атомистическая теория современная теория строения вещества — зародилась еще в Древней Греции. Основное направление мысли древнегреческих
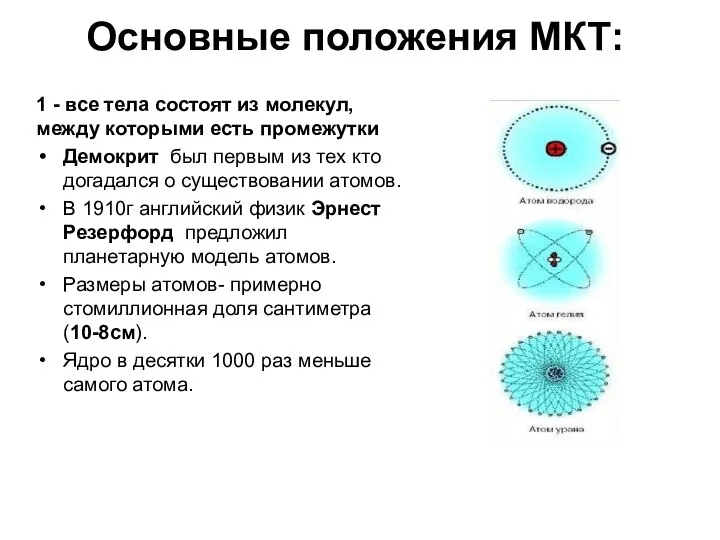
- 4. Основные положения МКТ: 1 - все тела состоят из молекул, между которыми есть промежутки Демокрит был
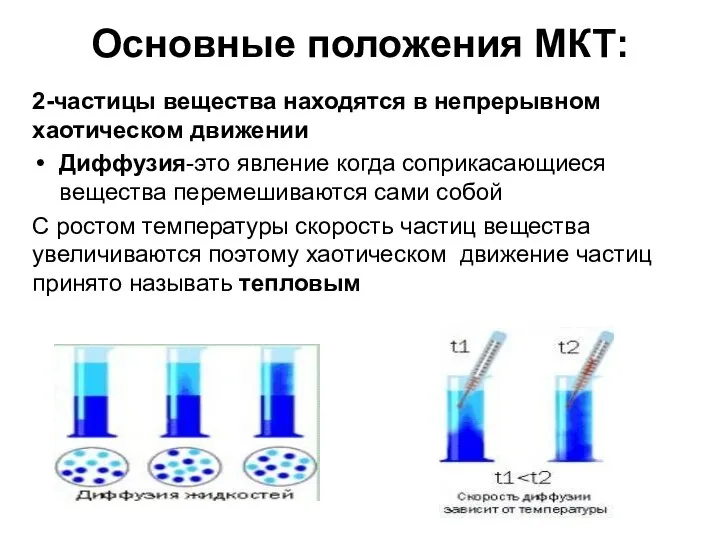
- 5. Основные положения МКТ: 2-частицы вещества находятся в непрерывном хаотическом движении Диффузия-это явление когда соприкасающиеся вещества перемешиваются
- 6. Основные положения МКТ: 3 - частицы вещества взаимодействуют друг с другом. Частицы вещества одновременно и притягиваются
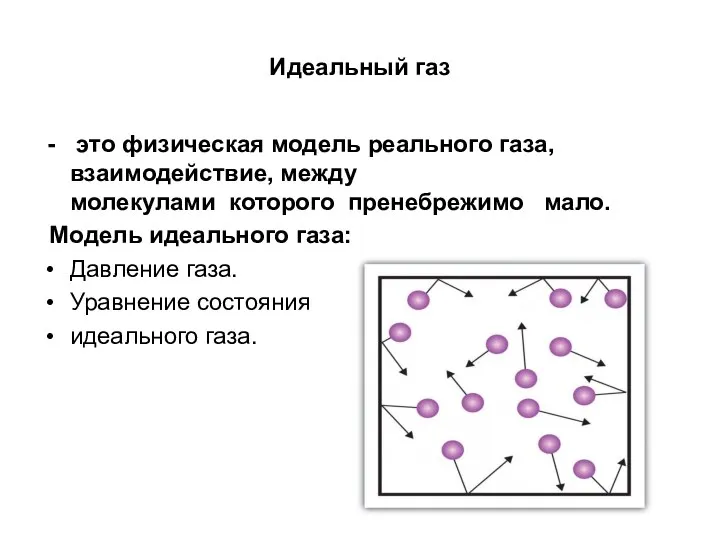
- 7. Идеальный газ это физическая модель реального газа, взаимодействие, между молекулами которого пренебрежимо мало. Модель идеального газа:
- 8. Свойства идеального газа молекулы — это упругие шары; расстояние между молекулами намного больше размеров молекул- диаметра
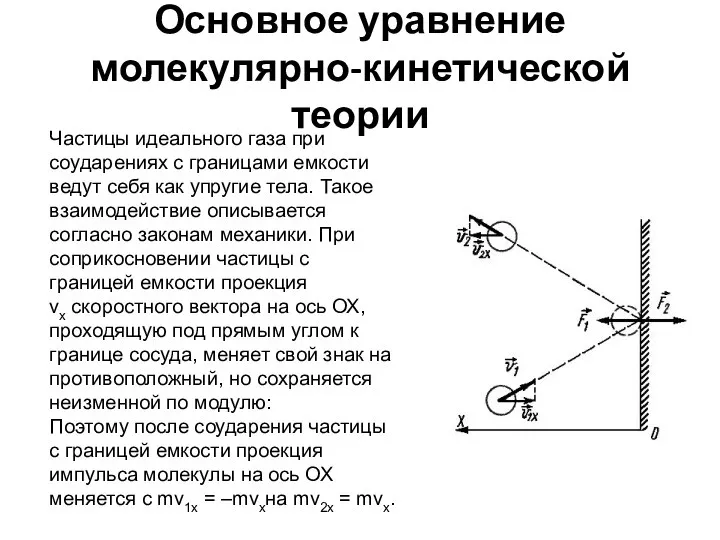
- 10. Основное уравнение молекулярно-кинетической теории Частицы идеального газа при соударениях с границами емкости ведут себя как упругие
- 11. Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость: Поскольку в каждом из
- 12. Основное уравнение МКТ идеального газа -связывает микропараметры частиц ( массу молекулы, средний квадрат скорости молекул) с
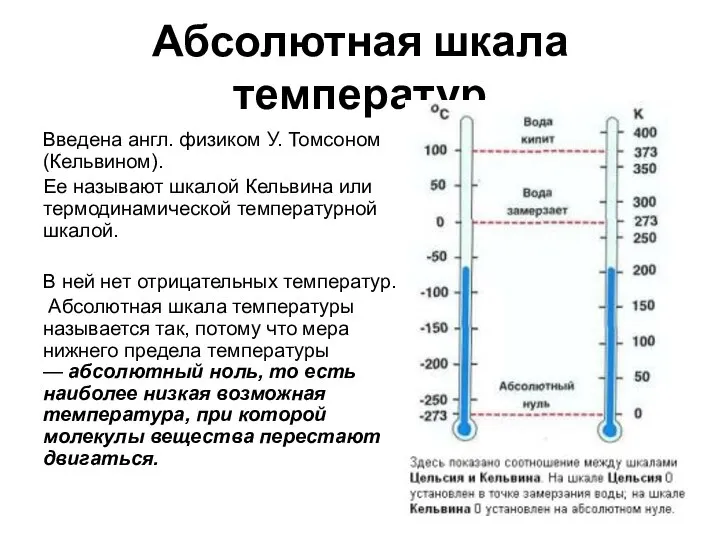
- 13. Абсолютная шкала температур Введена англ. физиком У. Томсоном(Кельвином). Ее называют шкалой Кельвина или термодинамической температурной шкалой.
- 14. Уи́льям То́мсон, барон Ке́львин (26 июня 1824 – 17 декабря 1907 гг.) британский физик и механик.
- 15. Единица абсолютной температуры в СИ: [T]=1K (Кельвин). Нулевая температура абсолютной шкалы – это абсолютный ноль 00К
- 17. Скачать презентацию







![Единица абсолютной температуры в СИ: [T]=1K (Кельвин). Нулевая температура абсолютной шкалы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1468760/slide-14.jpg)
 Радиационный контроль
Радиационный контроль Когерентность. Монохроматические волны
Когерентность. Монохроматические волны Микронометр
Микронометр Расчетное задание №2. Расчет масляного радиатора
Расчетное задание №2. Расчет масляного радиатора Электрический заряд. Закон Кулона
Электрический заряд. Закон Кулона Физика пласта. Подземная нефтегидродинамика
Физика пласта. Подземная нефтегидродинамика Електрика як галузь фізики
Електрика як галузь фізики Расход пара (газа) через суживающееся сопло
Расход пара (газа) через суживающееся сопло Сложный контур циркуляции
Сложный контур циркуляции Гидроэлектростанции России
Гидроэлектростанции России Анализ размеров блоков (кристаллитов) и величин микродеформаций по форме и ширине дифракционных линий
Анализ размеров блоков (кристаллитов) и величин микродеформаций по форме и ширине дифракционных линий Кольца Ньютона
Кольца Ньютона Динамический расчет ферм
Динамический расчет ферм Игра «Занимательная физика»
Игра «Занимательная физика» Счетчик Гейгера
Счетчик Гейгера Сборка изделий с подшипниками. Классы точности, поля допусков
Сборка изделий с подшипниками. Классы точности, поля допусков Как устроен автомобиль
Как устроен автомобиль Свободное падение тел. Равноускоренное движение
Свободное падение тел. Равноускоренное движение Четырехпроводная трехфазная система Звезда – Звезда
Четырехпроводная трехфазная система Звезда – Звезда Технология ремонта автомобиля
Технология ремонта автомобиля Галилео Галилей
Галилео Галилей  Транзисторы. Практическое применение транзисторов, диодов и конденсаторов. Лекция 6
Транзисторы. Практическое применение транзисторов, диодов и конденсаторов. Лекция 6 Простейшая задача квантовой механики: частица в потенциальной яме (ящике). Квантовые точки
Простейшая задача квантовой механики: частица в потенциальной яме (ящике). Квантовые точки Аттестационная работа. Практика проектно-исследовательской деятельности по физике и астрономии
Аттестационная работа. Практика проектно-исследовательской деятельности по физике и астрономии 1949 – 1989 - 1991
1949 – 1989 - 1991 Реактивное движение. Ракеты
Реактивное движение. Ракеты Экономия использования энергетических ресурсов на земле ЕЭС.
Экономия использования энергетических ресурсов на земле ЕЭС. Двигатель внутреннего сгорания
Двигатель внутреннего сгорания