Содержание
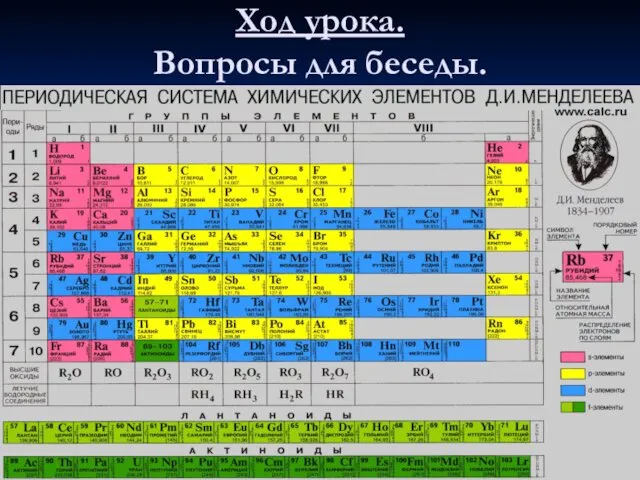
- 2. Ход урока. Вопросы для беседы.
- 3. Тестирование: Установите соответствие: Элемент группа К а) VI Мо б) III Al в) V Р г)
- 4. Ответы: 1. 1 – г 2. 1 – б 3. а, б 2 – а 2
- 5. Изучение нового материала I. История изучения сложного состава атома. а) Изучение явления радиоактивности. Минеральные удобрения
- 6. Серная кислота Поваренная соль
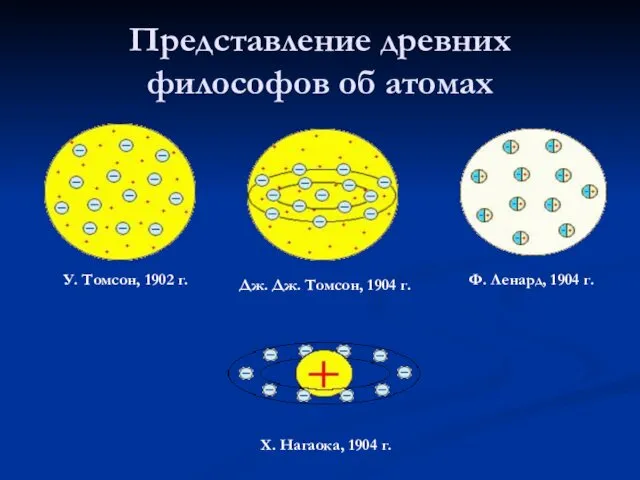
- 7. Представление древних философов об атомах У. Томсон, 1902 г. Дж. Дж. Томсон, 1904 г. Ф. Ленард,
- 8. Михаи́л Васи́льевич Ломоно́сов (8 ноября 1711 — 4 апреля 1765) Первый русский учёный-естествоиспытатель мирового значения, энциклопедист,
- 9. Мари́я Склодо́вская-Кюри́ (7 ноября 1867— 4 июля 1934) Известный физик и химик польского происхождения. Дважды лауреат
- 10. Пьер Кюри́ (1859—1906) Французский учёный-физик, один из первых исследователей радиоактивности, член Французской АН, лауреат Нобелевской премии
- 11. Счётчик Гейгера СИ-8Б (СССР) со слюдяным окошком для измерения мягкого бета-излучения. Окно прозрачно, под ним можно
- 12. Ядерная модель атома Э. Резерфорда Эрне́ст Ре́зерфорд (30 августа 1871— 19 октября 1937,) В центре атома
- 13. Работы Нильса Бора - датского физика (7 октября 1885 — 18 ноября 1962)
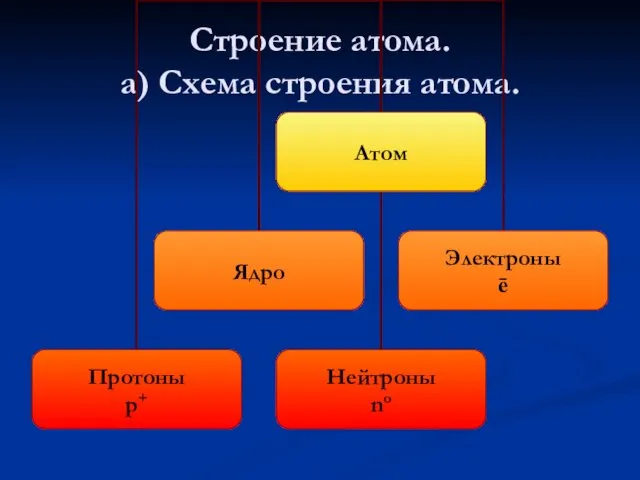
- 14. Строение атома. а) Схема строения атома.
- 15. б) Состав атома:
- 16. в) Протоны и нуклонные числа: Число протонов в атоме называют протонным числом. 4Ве Суммарное число протонов
- 17. III Закрепление материала. Заполните таблицу:
- 19. Скачать презентацию













 Нагревание проводников электрическим током. Закон Джоуля-Ленца
Нагревание проводников электрическим током. Закон Джоуля-Ленца The mechanics in biomechanics
The mechanics in biomechanics Общие свойства ионизирующих излучений ядерного взрыва
Общие свойства ионизирующих излучений ядерного взрыва Кулачковая опора для шагающего механизма П.Л. Чебышева
Кулачковая опора для шагающего механизма П.Л. Чебышева Построение и применение комплексов радиорелейной, тропосферной, спутниковой связи
Построение и применение комплексов радиорелейной, тропосферной, спутниковой связи Теория относительности. (Лекция 5)
Теория относительности. (Лекция 5) Закон Био-Савара-Лапласа и его применения
Закон Био-Савара-Лапласа и его применения Радиоактивтілік. Сәуле шығару. Элементар бөлшектерді тіркеу мен бақылау әдістері
Радиоактивтілік. Сәуле шығару. Элементар бөлшектерді тіркеу мен бақылау әдістері Аттестационная работа. Образовательная рабочая программа Подготовка к ОГЭ по физике. (10 класс)
Аттестационная работа. Образовательная рабочая программа Подготовка к ОГЭ по физике. (10 класс) Кристаллические и аморфные тела в современном мире Выполнила: Попова Людмила Леонасовна, учитель физики МБОУ «СОШ № 14» имени А.М.
Кристаллические и аморфные тела в современном мире Выполнила: Попова Людмила Леонасовна, учитель физики МБОУ «СОШ № 14» имени А.М. Технология компрессии изображений «Smart Compression of Images»
Технология компрессии изображений «Smart Compression of Images» Применение материалов в кабельных изделиях
Применение материалов в кабельных изделиях Відкриття електромагнітних хвиль Презентація 11-А класу швеця максима і пивоварчука вадима
Відкриття електромагнітних хвиль Презентація 11-А класу швеця максима і пивоварчука вадима  Плоское потенциальное движение. Использование вихревой теории в расчетах турбомашин
Плоское потенциальное движение. Использование вихревой теории в расчетах турбомашин Нахождение удельной теплоты льда в опытах по плавлению льда водой
Нахождение удельной теплоты льда в опытах по плавлению льда водой Сила трения. Виды трения. Способы изменения трения
Сила трения. Виды трения. Способы изменения трения Гидростатика. Гидростатическое давление и его свойства
Гидростатика. Гидростатическое давление и его свойства Влияние радиации на человека Презентация ученицы 11 класса «Б» ГОУ ЦО №548 «Царицыно» Корсаковой Маргариты
Влияние радиации на человека Презентация ученицы 11 класса «Б» ГОУ ЦО №548 «Царицыно» Корсаковой Маргариты  Постулаты общей теории относительности. (Часть 3)
Постулаты общей теории относительности. (Часть 3) Подсчет запасов и анализ неопределенности
Подсчет запасов и анализ неопределенности Космическая динамика. Законы Кеплера
Космическая динамика. Законы Кеплера Использование энергии Солнца на Земле Презентация Свиридова Тимофея 8-В класс
Использование энергии Солнца на Земле Презентация Свиридова Тимофея 8-В класс  Плавание тел
Плавание тел Тест по теме: линии магнитного полня, однородное, неоднородное поле, правило правой руки
Тест по теме: линии магнитного полня, однородное, неоднородное поле, правило правой руки Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов
Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов Специальная теория относительности. (Часть 2)
Специальная теория относительности. (Часть 2) Кулон заңы
Кулон заңы Электронная подсистема. Вырожденный электронный газ (лекция 16)
Электронная подсистема. Вырожденный электронный газ (лекция 16)