Содержание
- 2. Историческая справка Слово «галогены» (“halogen”) ввел шведский химик Й.Я.Берцелиус галогены (греч. hals – соль, gen –
- 3. Распространенность в природе галит NaCl сильвин KCl сильвинит KCl•NaCl флюорит CaF2
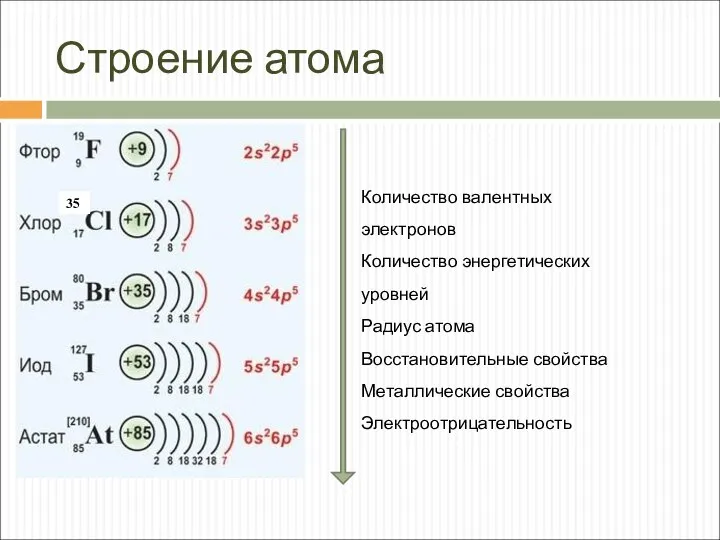
- 4. Строение атома 35 Количество валентных электронов Количество энергетических уровней Радиус атома Восстановительные свойства Металлические свойства Электроотрицательность
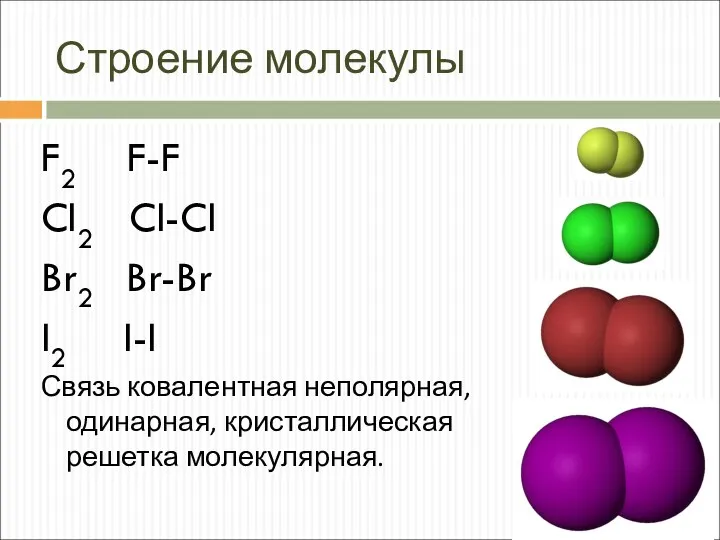
- 5. Строение молекулы F2 F-F Cl2 Cl-Cl Br2 Br-Br I2 I-I Связь ковалентная неполярная, одинарная, кристаллическая решетка
- 6. Физические свойства , способно к возгонке
- 7. Химические свойства 1) Взаимодействие с металлами: Cu + Cl2 = Fe + Cl2 = 2) Взаимодействие
- 8. Химические свойства 3) Взаимодействие с водой: 2F2 + 2H2O = 4HF + O2 H2O + Cl2
- 9. Химические свойства 5) Взаимодействие со щелочами на холоду: 2NaOH + Cl2 = NaCl + NaClO +
- 10. Получение F2 и Cl2 в промышленности получают электролизом расплавов или растворов их солей: 2NaCl 2Na +
- 11. В периодической системе галогены находятся в: А) главной подгруппе VIII группы; Б) побочной подгруппе VII группы;
- 12. Для галогенов характерна степень окисления: А) -2; Б) -1 и -2; В) -2 и -3; Г)
- 13. Галогены могут проявлять положительную степень окисления в соединениях с: А) водородом; Б) кислородом; В) с металлами;
- 14. Как меняется химическая активность галогенов в ряду: F, Cl, Br, I? А) увеличивается; Б) меняется беспорядочно;
- 15. При обычных условиях бром - это: А) газ; Б) жидкость; В) кристаллическое в-во; Г) жидкость или
- 16. Свободных орбиталей нет у: А) хлора; Б) брома; В) йода; Г) фтора.
- 17. Галогены в твердом состоянии имеют: А) атомную кристаллическую решетку; Б) молекулярную кристаллическую решетку; В) А и
- 19. Скачать презентацию














 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека «Азот»және «Фосфор»элементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар
«Азот»және «Фосфор»элементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар ЦІКАВІ ФАКТИ ПРО ЗОЛОТО
ЦІКАВІ ФАКТИ ПРО ЗОЛОТО  Химическая связь
Химическая связь Белки. Классификация белков. (Тема 2)
Белки. Классификация белков. (Тема 2) Извлечение как единство процессов десорбции, растворения и диффузии. Теоретические основы извлечения
Извлечение как единство процессов десорбции, растворения и диффузии. Теоретические основы извлечения Organic compounds: nomenclature
Organic compounds: nomenclature Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Процессы проявления и фиксирования
Процессы проявления и фиксирования Растворы электролитов
Растворы электролитов КВН В МИРЕ ВЕЩЕСТВ
КВН В МИРЕ ВЕЩЕСТВ Предмет и задачи биохимии. Ферменты. Регуляция активности ферментов. (Лекция 3)
Предмет и задачи биохимии. Ферменты. Регуляция активности ферментов. (Лекция 3) Жизненный Путь Дмитрия Ивановича Менделеева Выполнила ученица 10-А класса Рипка Елизавета
Жизненный Путь Дмитрия Ивановича Менделеева Выполнила ученица 10-А класса Рипка Елизавета  Вещества и явления в окружающем мире
Вещества и явления в окружающем мире Аттестационная работа. Проектная и исследовательская деятельность как способ формирования химических знаний и умений
Аттестационная работа. Проектная и исследовательская деятельность как способ формирования химических знаний и умений Химические реакции разложения и соединения
Химические реакции разложения и соединения Нефть как дисперсная система
Нефть как дисперсная система Органічні сполуки в живій природі
Органічні сполуки в живій природі  Основы кристаллографии
Основы кристаллографии Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.  ПРИРОДНЫЕ ЯДЫ
ПРИРОДНЫЕ ЯДЫ Химическая связь и ее типы
Химическая связь и ее типы Вода - Н2О
Вода - Н2О Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы
Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы Характеристики элемента по его положению в ПСХЭ Д.И.Менделеева
Характеристики элемента по его положению в ПСХЭ Д.И.Менделеева Яблоки и здоровье человека
Яблоки и здоровье человека Презентация по Химии "Предмет химии" - скачать смотреть
Презентация по Химии "Предмет химии" - скачать смотреть  Презентация по Химии "ХИМИЯ НА КУХНЕ" - скачать смотреть бесплатно
Презентация по Химии "ХИМИЯ НА КУХНЕ" - скачать смотреть бесплатно