Содержание
- 2. Строение атома фосфора
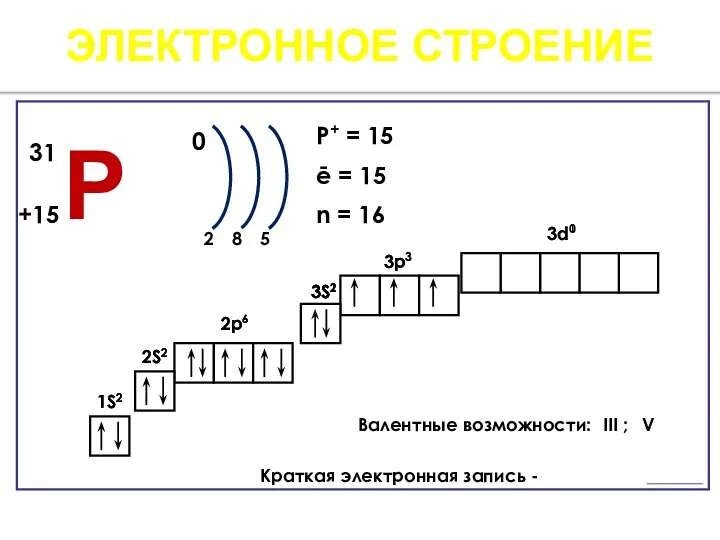
- 3. ЭЛЕКТРОННОЕ СТРОЕНИЕ 0 2 8 5 P+ = 15 ē = 15 n = 16 1S2
- 4. Общая характеристика. неметалл, Ar=31 V группа, главная подгруппа 3 период, 3 ряд степени окисления -3.0,+1,+3,+5. оксиды
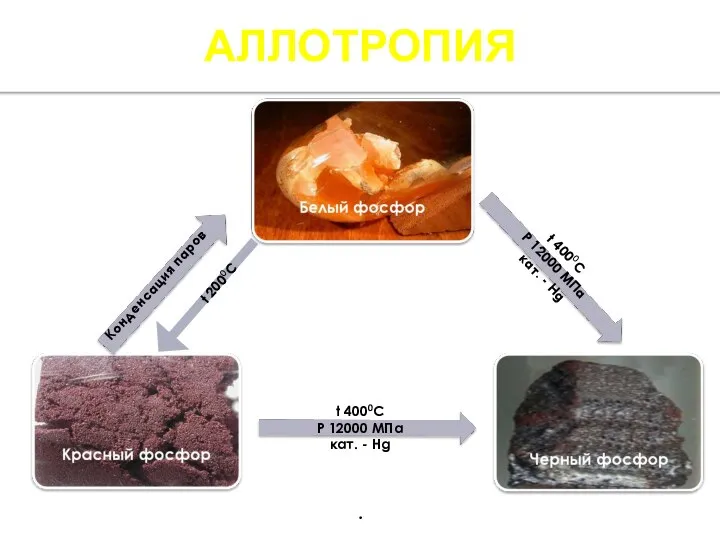
- 5. АЛЛОТРОПИЯ t 2000C Конденсация паров .
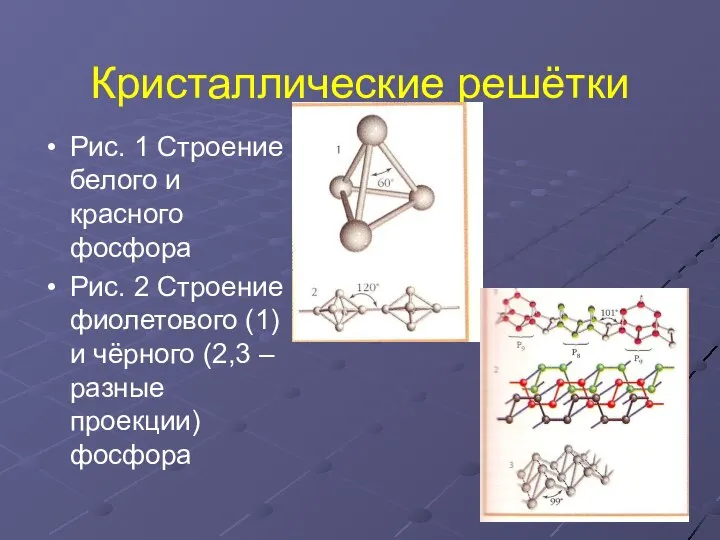
- 6. Кристаллические решётки Рис. 1 Строение белого и красного фосфора Рис. 2 Строение фиолетового (1) и чёрного
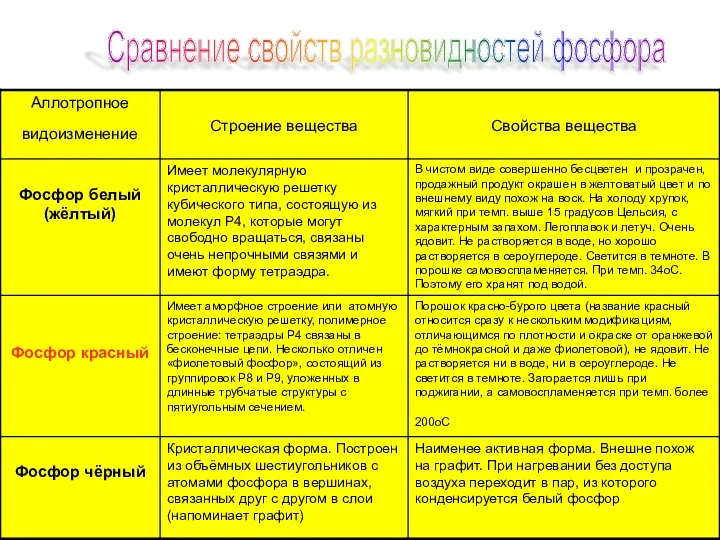
- 7. Воскообразное, прозрачное вещество с характерным запахом, в присутствии примесей - следов красного Фосфора, мышьяка, железа и
- 8. Темно-малиновый порошок. Нерастворим в воде и сероуглероде. Химическая активность значительно ниже, чем у белого. На воздухе
- 9. Чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит. Не растворим в
- 10. В одно колено сосуда Ландольта поместим немного красного фосфора. Закроем отверстие сосуда плотным комком ваты. Закрепим
- 11. Сравнение свойств разновидностей фосфора
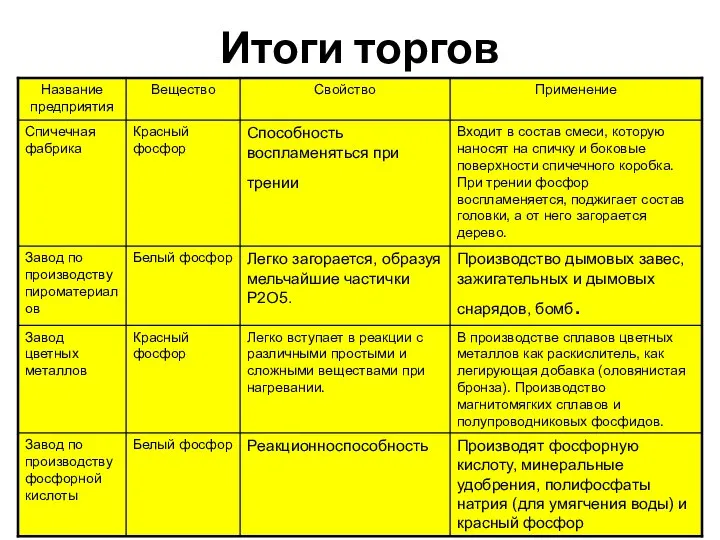
- 12. Итоги торгов
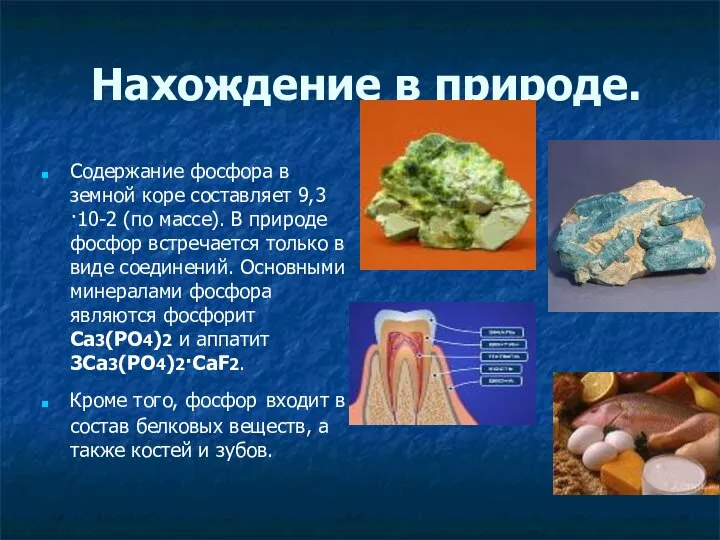
- 13. Нахождение в природе. Содержание фосфора в земной коре составляет 9,3·10-2 (по массе). В природе фосфор встречается
- 14. ПРИРОДНЫЕ СОЕДИНЕНИЯ Апатит Формула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине-зеленый, голубой, фиолетовый, редко красный Блеск Стеклянный до
- 15. ПРИРОДНЫЕ СОЕДИНЕНИЯ Формула (Са5(РО4)3Сl или Са5(РО4)3F Цвет беловатый, сероватый, желтоватый или бурый Прозрачность Непрозрачный, Плотность 5
- 16. Получение. Фосфор получают в электрических печах по реакции: Ca3(PO4)2 + 5C+ 3SiO2 = 2P+ 3CaSiO3 +
- 17. Черный фосфор получают из белого нагреванием при 200 °C и давлении 1,2·106 кПа или в присутствии
- 18. Физические свойства. Белый фосфор Он чрезвычайно ядовит ! Мягкое, бесцветное, воскообразное вещество. Он легкоплавок (температура плавления
- 19. Красный фосфор Не ядовит! в зависимости от способов получения обладает различными свойствами. Например, его плотность изменяется
- 20. Белый фосфор горит в кислороде. Удивительно, что это может происходить и под водой. Нагреем фосфор в
- 21. Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция
- 22. Красный фосфор при нагревании взаимодействует с активными металлами. Смешаем опилки кальция с порошком красного фосфора. Поместим
- 23. ОКСИДЫ ФОСФОРА P2O5 - оксид фосфора (V) (фосфорный ангидрид), в парообразном состоянии имеет состав P4O10. Он
- 24. P2O5+H2O = 2 HPO3 метафосфорная кислота P2O5+3H2O = 2H3PO4 ортофосфорная кислота
- 25. применение Применяют оксид фосфора (V) для осушки газов и жидкостей, не реагирующих с ним, для получения
- 26. P2O3 (P4O6) - оксид фосфора (III) (фосфористый ангидрид), температура плавления -23,9 °C, температура кипения- 175,4 °C,
- 27. ОРТОФОСФОРНАЯ КИСЛОТА H3РO4 - трехосновная минеральная кислота. 2.Физические свойства: Безводная ортофосфорная кислота - это бесцветное кристаллическое
- 28. Качественная реакция на 3- фосфат ион - PO4 H3PO4 + 3AgNO3 =>Ag3PO4 +3HNO3 жёлтый осадок 3-
- 29. 4.Применение. H3PO4 используют для получения фосфорных удобрений, для создания защитных покрытий на металлах, в фармацевтической промышленности,
- 31. Скачать презентацию






![ПРИРОДНЫЕ СОЕДИНЕНИЯ Апатит Формула Са5[PO4]3(F,Cl,ОН) Цвет белый, зеленый, сине-зеленый, голубой, фиолетовый,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1197183/slide-13.jpg)















 Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Каталіз: каталітичне гідрування
Каталіз: каталітичне гідрування Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Оксиген
Оксиген Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки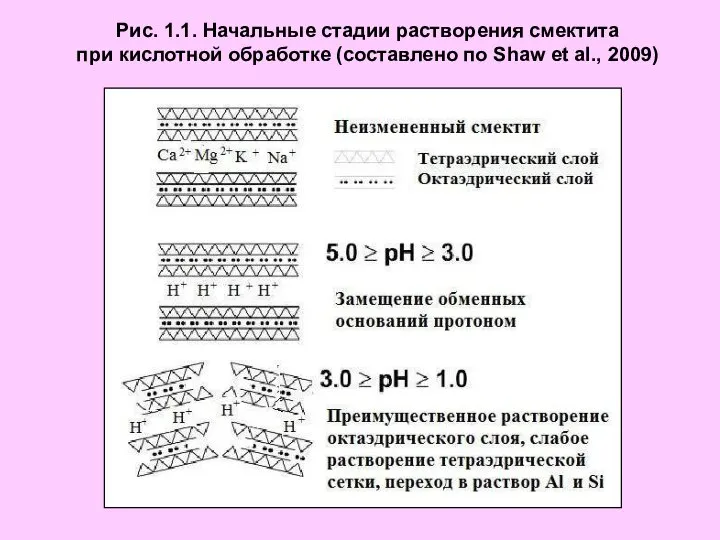 Начальные стадии растворения смектита при кислотной обработке
Начальные стадии растворения смектита при кислотной обработке Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Азот
Азот Поверхностно-активные вещества
Поверхностно-активные вещества Тест по неорганической химии
Тест по неорганической химии Химия ғажайыптар әлемі
Химия ғажайыптар әлемі Химические волокна
Химические волокна Испытания стабильности спреев
Испытания стабильности спреев Основания. Классификация оснований
Основания. Классификация оснований Минералы. Галенит
Минералы. Галенит Рефолдинг миниантител
Рефолдинг миниантител Технология оптического стекла
Технология оптического стекла Вуглеводи прості і складні
Вуглеводи прості і складні Рефрактометрия. Методика выполнения рефрактометрических определений
Рефрактометрия. Методика выполнения рефрактометрических определений Атомы и молекулы
Атомы и молекулы Особенности химии фтора
Особенности химии фтора Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Гемоглобин. Структура и свойства молекулы гемоглобина
Гемоглобин. Структура и свойства молекулы гемоглобина Презентация по Химии "ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ" - скачать смотреть бесплатно
Презентация по Химии "ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ" - скачать смотреть бесплатно Қабаттағы мұнай
Қабаттағы мұнай Сурьма, Sb
Сурьма, Sb