Содержание
- 2. Химический элемент 7 (17-й) группы, второго периода периодической системы с атомным номером 9. Самый химически активный
- 3. История открытия фтора. Первое соединение фтора - флюорит (плавиковый шпат) CaF2 - описано в конце XV
- 4. Фтор распространяется в природе довольно широко. Его содержание в земной коре 0,065% от общей массы ,
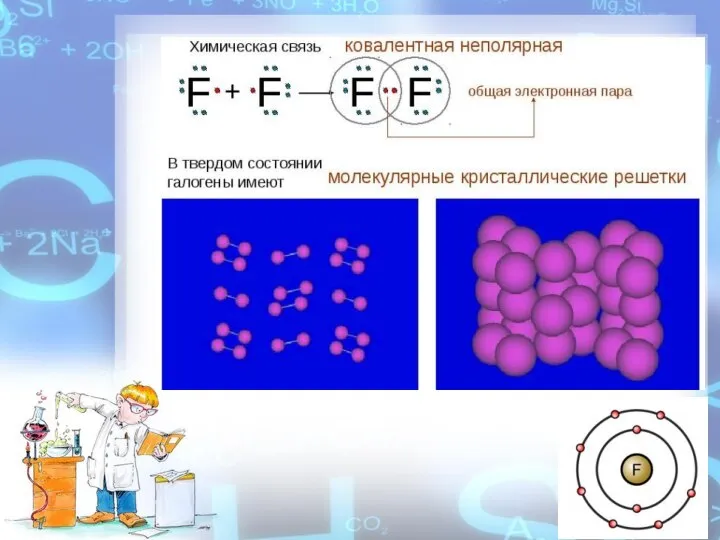
- 5. Фтор – ядовитый газ. В обычных условиях фтор – газ ярко-желтого цвета, с резким характерным запахом,
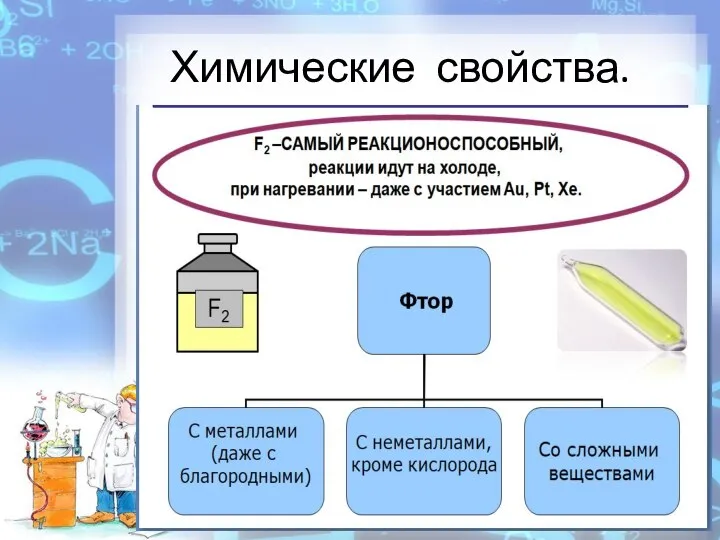
- 7. Химические свойства.
- 8. Химические свойства.
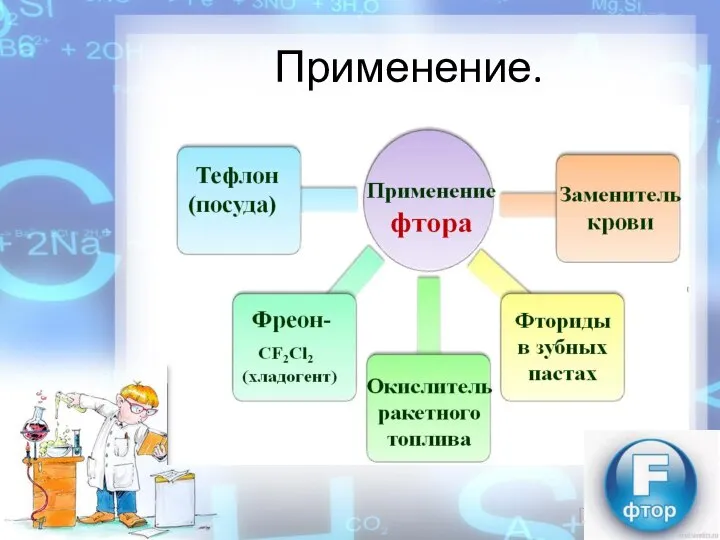
- 9. Применение.
- 10. Биологическая роль.
- 12. Скачать презентацию






 Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Атомдар мен молекулалар
Атомдар мен молекулалар Липиды
Липиды Нуклеопротеины
Нуклеопротеины Кислотно-основное титрование. Аналитическая химия
Кислотно-основное титрование. Аналитическая химия Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Метаморфогенные месторождения
Метаморфогенные месторождения Химия в медицине
Химия в медицине Увеличение эффективности печи установки АТ
Увеличение эффективности печи установки АТ Низкомолекулярные органические соединения витамины
Низкомолекулярные органические соединения витамины Амфотерні оксиди та гідроксиди
Амфотерні оксиди та гідроксиди Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Пентозофосфатный путь окисления глюкозы. Глюконеогенез. (Лекция 5)
Пентозофосфатный путь окисления глюкозы. Глюконеогенез. (Лекция 5) Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5)
Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5) Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Презентация Палладий
Презентация Палладий  Стеклопластики. Типы стеклопластиков и их классификация
Стеклопластики. Типы стеклопластиков и их классификация 热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации
Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации Влияние соли
Влияние соли Коррозия металлов
Коррозия металлов Мінерали та гірські породи
Мінерали та гірські породи Работу выполнила: Максименко Анна ученица 9 класса А ГОУ СОШ № 546 г. Москвы Руководитель: учитель химии Симонова Т.В.
Работу выполнила: Максименко Анна ученица 9 класса А ГОУ СОШ № 546 г. Москвы Руководитель: учитель химии Симонова Т.В. Презентация по химии МИНЕРАЛЬНЫЕ ВЕЩЕСТВА
Презентация по химии МИНЕРАЛЬНЫЕ ВЕЩЕСТВА  Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин)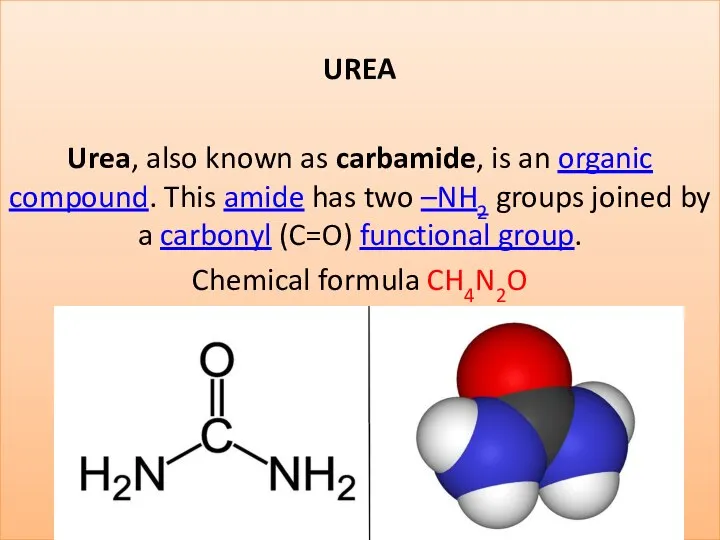 Urea (carbamide)
Urea (carbamide) Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии