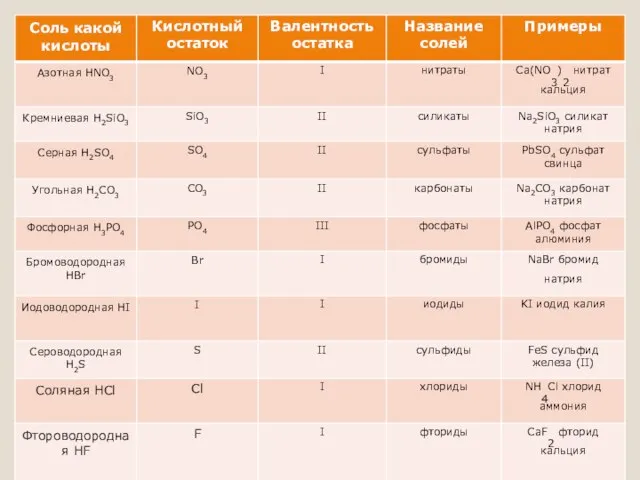
Химические свойства
Химические свойства определяются свойствами катионов и анионов, входящих в их
состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
Некоторые соли разлагаются при нагревании:











 Физические и химические явления
Физические и химические явления Партитуру химии надо не просто исполнить, ее надо сочинить! Жан-Мари Лен
Партитуру химии надо не просто исполнить, ее надо сочинить! Жан-Мари Лен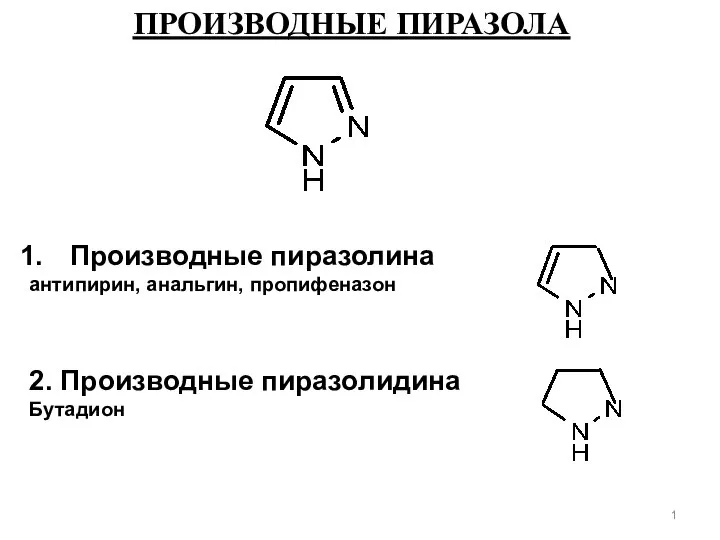 Производные пиразола
Производные пиразола Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05
Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05 Автометаморфизм
Автометаморфизм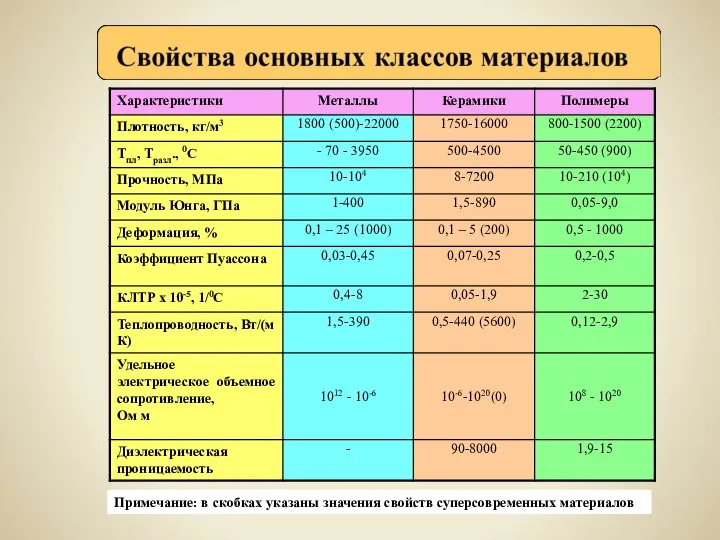 Свойства основных классов материалов
Свойства основных классов материалов Почему коньки скользят по льду
Почему коньки скользят по льду  Охрана окружающей среды от загрязнения сульфуро-содержащими соединениями
Охрана окружающей среды от загрязнения сульфуро-содержащими соединениями Кристаллы и их свойства. Понятие о симметрии кристаллов и элементах симметрии. Сингония
Кристаллы и их свойства. Понятие о симметрии кристаллов и элементах симметрии. Сингония Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии
Аттестационная работа. Проектно - исследовательская технология, как способ формирования УУД по химии Ферменты. Часть II
Ферменты. Часть II Презентация по Химии "Основные классы неорганических соединений Соли" - скачать смотреть
Презентация по Химии "Основные классы неорганических соединений Соли" - скачать смотреть  Кристаллизация металла шва
Кристаллизация металла шва Строение мицеллы лиофобного золя
Строение мицеллы лиофобного золя Химические свойства
Химические свойства Ионная связь
Ионная связь Фенолы. Классификация фенолов
Фенолы. Классификация фенолов АСПІРИН, ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. ЙОГО ПЛЮСИ ТА МІНУСИ Малькевич Анастасія Вікторівна 11-А
АСПІРИН, ЯК ХІМІЧНИЙ ЕЛЕМЕНТ. ЙОГО ПЛЮСИ ТА МІНУСИ Малькевич Анастасія Вікторівна 11-А  Нитрид бора
Нитрид бора Radiation-induced desorption of excited atoms from solid nitrogen
Radiation-induced desorption of excited atoms from solid nitrogen Общие сведения о парфюмерии и косметике
Общие сведения о парфюмерии и косметике Застосування нафти та нафтопродуктів Презентацію підготували учениці 11-В класу Кузнецовської гімназії Турик Даша та Коновал
Застосування нафти та нафтопродуктів Презентацію підготували учениці 11-В класу Кузнецовської гімназії Турик Даша та Коновал  Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа Человек и отходы «Человечество не погибнет в атомном кошмаре, оно захлебнется в собственных отходах» Нильс Бор. Автор: Георги
Человек и отходы «Человечество не погибнет в атомном кошмаре, оно захлебнется в собственных отходах» Нильс Бор. Автор: Георги Диеновые углеводороды (алкадиены)
Диеновые углеводороды (алкадиены) Defect in solid
Defect in solid Каменный уголь
Каменный уголь Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями