Содержание
- 2. Основания - это… Основания — (основные гидроксиды) — вещества, молекулы которых состоят из ионов металлов или
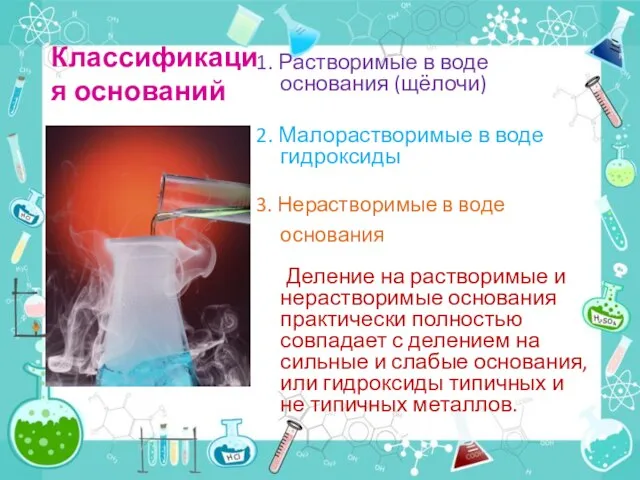
- 3. Классификация оснований 1. Растворимые в воде основания (щёлочи) 2. Малорастворимые в воде гидроксиды 3. Нерастворимые в
- 4. Классификация оснований В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
- 5. Способы получения оснований Получение щелочи при реакции сильноосновного оксида с водой Так как только сильноосновные оксиды
- 6. Способы получения оснований Косвенное получение основания (гидроксида) при реакции соли со щелочью Гидроксиды малоактивных металлов получают
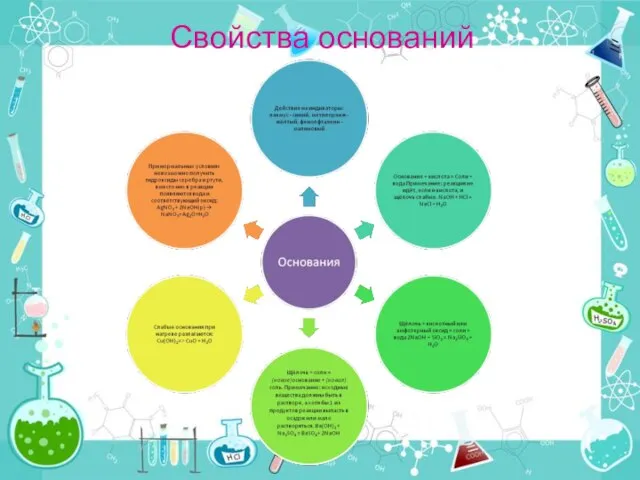
- 7. Свойства оснований
- 8. Щёлочи Щёлочи — гидроксиды щелочных и щелочноземельных металлов и аммония. К щелочам относят хорошо растворимые в
- 9. Физические свойства щелочей Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи
- 11. Скачать презентацию






 Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Характерные свойства простых веществ-неметаллов
Характерные свойства простых веществ-неметаллов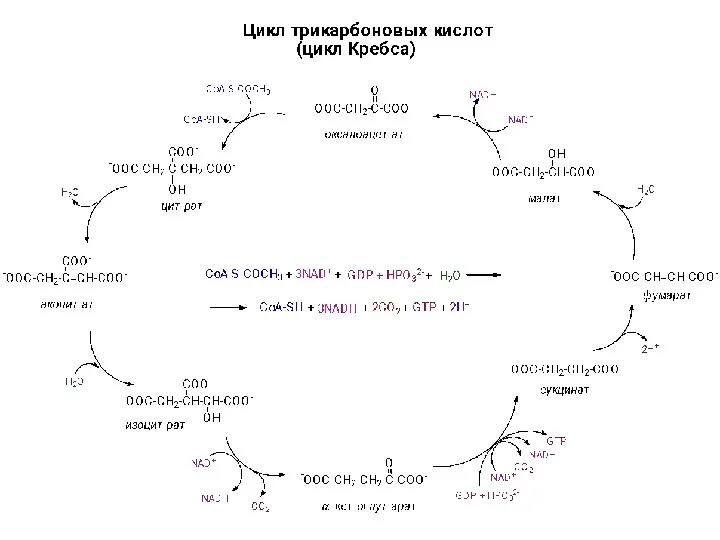 Цикл трикарбоновых кислот
Цикл трикарбоновых кислот Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот Химический элемент радон
Химический элемент радон Кристаллы. Виды
Кристаллы. Виды Классификация органических соединений
Классификация органических соединений Chemical physics. Atomic structure
Chemical physics. Atomic structure Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.
Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.  Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины
Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины Свойства простых веществ 8 класс
Свойства простых веществ 8 класс  Курсовая работа на тему: «Пьезокварцевое микровзвешивание солей в воде»
Курсовая работа на тему: «Пьезокварцевое микровзвешивание солей в воде» Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Депонирование и мобилизация жиров
Депонирование и мобилизация жиров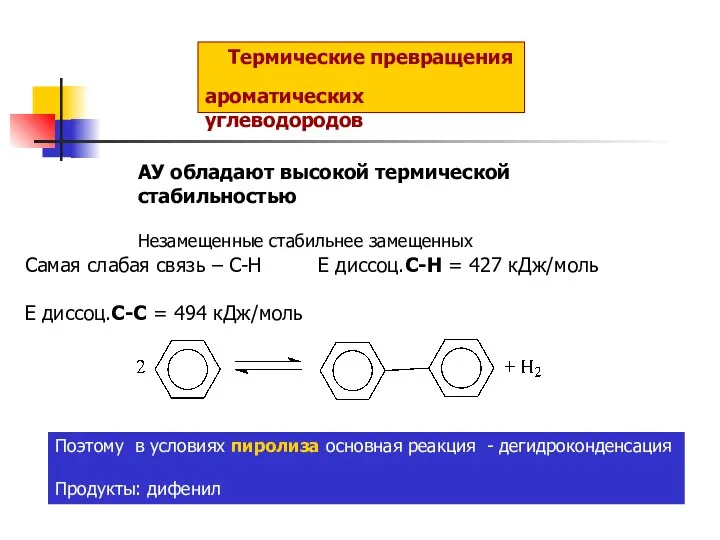 Термические превращения ароматических углеводородов
Термические превращения ароматических углеводородов Решение задачи №10. Гидроксид рубидия. Команда «Карбораны»
Решение задачи №10. Гидроксид рубидия. Команда «Карбораны» Органическая химия: «Жиры»
Органическая химия: «Жиры» Курс лекций по химии
Курс лекций по химии Кислоты, соли
Кислоты, соли Химия в косметике
Химия в косметике Каталитический риформинг
Каталитический риформинг Термохимия. Типы энтальпии
Термохимия. Типы энтальпии Химия S - элементов
Химия S - элементов Антибиотики как ЛС
Антибиотики как ЛС История появления новогодней открытки
История появления новогодней открытки  Соли азотной кислоты
Соли азотной кислоты Актиний
Актиний