Содержание
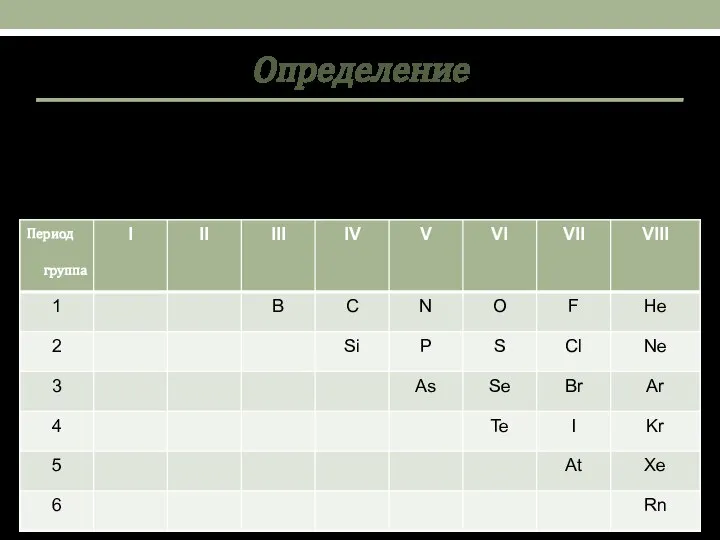
- 2. Определение Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
- 3. Химическая связь В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая
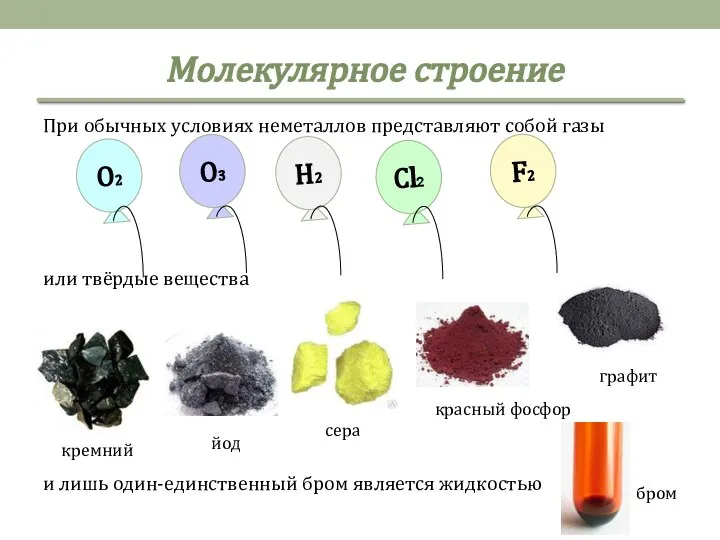
- 4. Молекулярное строение При обычных условиях неметаллов представляют собой газы или твёрдые вещества и лишь один-единственный бром
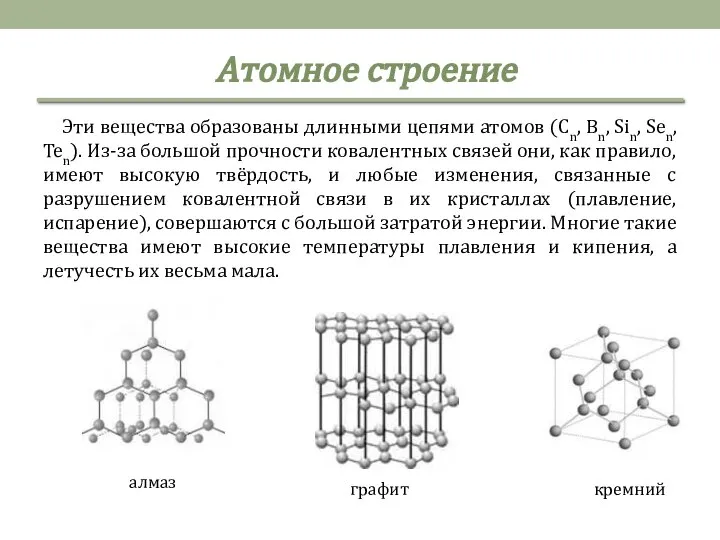
- 5. Эти вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten). Из-за большой прочности ковалентных связей
- 6. Химические свойства Для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные,
- 7. Окислительные свойства сульфид натрия хлорид железа(III) нитрид магния
- 8. Окислительные свойства сероводород хлороводород аммиак t◦ свет p,t◦, катал.
- 9. Окислительные свойства H, Si, As, P, Se, C, S, I, Br, Cl, N, O, F Усиление
- 10. Окислительные свойства
- 11. Окислительные свойства
- 12. Окислительные свойства свет
- 13. Восстановительные свойства t◦ t◦ несолеобразующий оксид солеобразующий кислотный оксид
- 14. Восстановительные свойства t◦ t◦
- 15. Восстановительные свойства
- 17. Скачать презентацию











 Металлы и сплавы
Металлы и сплавы ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии
ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen Алкины. 10 класс
Алкины. 10 класс Физические свойства элементов
Физические свойства элементов Гидролиз. Методы его получения и применения
Гидролиз. Методы его получения и применения Ученые химики. Выполнила ученица 10 кл. Трофимова Настя
Ученые химики. Выполнила ученица 10 кл. Трофимова Настя Жидкостно-сцинтилляционная спектроскопия
Жидкостно-сцинтилляционная спектроскопия Многоатомные спирты
Многоатомные спирты Алканы. Гомологи, изомеры, номенклатура.
Алканы. Гомологи, изомеры, номенклатура.  Валидация титриметрических методик анализа
Валидация титриметрических методик анализа Электролитическая диссоциация
Электролитическая диссоциация Кислородосодержащие органические соединения (2 часть)
Кислородосодержащие органические соединения (2 часть) Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Синергизм и синергические системы
Синергизм и синергические системы Химические реакции. Типы химических реакций
Химические реакции. Типы химических реакций Требование к оформлению отчета лабораторной работы
Требование к оформлению отчета лабораторной работы ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ПОДГРУППЫ КИСЛОРОДА
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ПОДГРУППЫ КИСЛОРОДА  Моделирование химических процессов
Моделирование химических процессов Поверхностное упрочнение деталей. (Лекция 11)
Поверхностное упрочнение деталей. (Лекция 11) Окисно-відновні процеси
Окисно-відновні процеси Кислород, его общая характеристика, нахождение в природе и получение (8 класс)
Кислород, его общая характеристика, нахождение в природе и получение (8 класс) «Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к
«Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к Штучні і синтетичні волокна
Штучні і синтетичні волокна  Современные и новейшие материалы
Современные и новейшие материалы Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ольга Викторовна
Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ольга Викторовна