Содержание
- 2. СПИРТЫ И ФЕНОЛЫ Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным
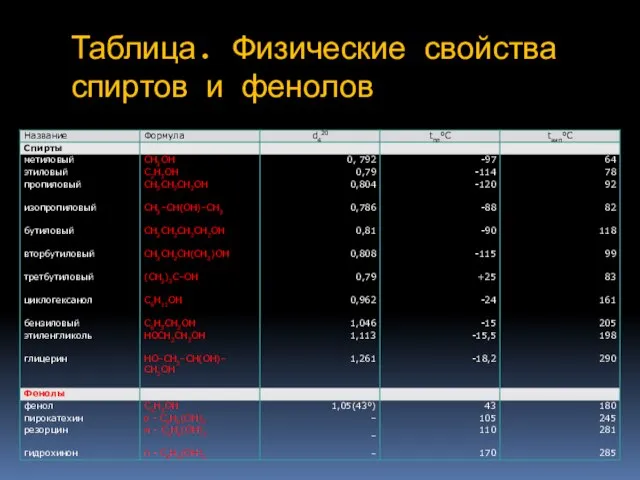
- 3. Физические свойства Низшие спирты (до С12) – жидкости, температуры кипения которых значительно выше, чем у соответствующих
- 4. Таблица. Физические свойства спиртов и фенолов
- 5. Одноатомные спирты Изомерия Изомерия углеродного радикала (начиная с C4H9OH). Изомерия положения гидроксильной группы, (начиная с С3Н7ОН).
- 6. Получение В промышленности. Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250C и давлении 5-10
- 7. В лаборатории. Гидратация алкенов (согласно правилу В.В. Марковникова): СH3–СH=CH2 + H2O ––H+ СH3–CH– СH3 I OH
- 8. Восстановление карбонильных соединений: Альдегиды образуют первичные спирты, а кетоны – вторичные. O II СH3–СH2 – C
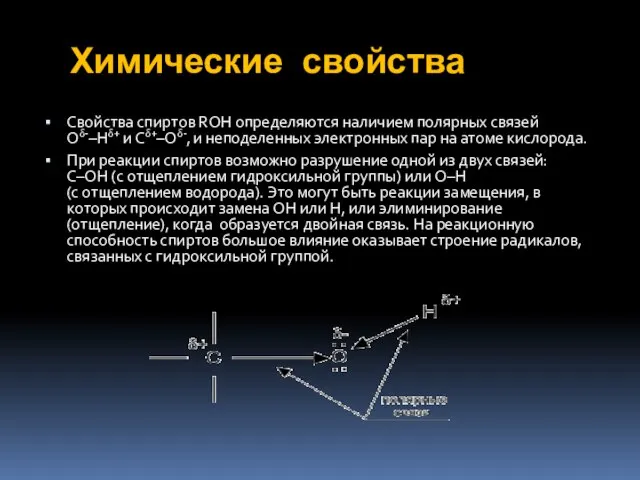
- 9. Химические свойства Свойства спиртов ROH определяются наличием полярных связей O-–H+ и C+–O-, и неподеленных электронных пар
- 10. Реакции с разрывом связи RO–H Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения –
- 11. Реакция этерификации Взаимодействие с органическими кислотами приводит к образованию сложных эфиров. O O II II CH3–C--OH
- 12. Реакции с разрывом связи R–OH. С галогеноводородами: R–OH + HBr R–Br + H2O С концентрированной
- 13. Реакции окисления Спирты горят: 2С3H7ОH + 9O2 6СO2 + 8H2O При действии окислителей: первичные спирты
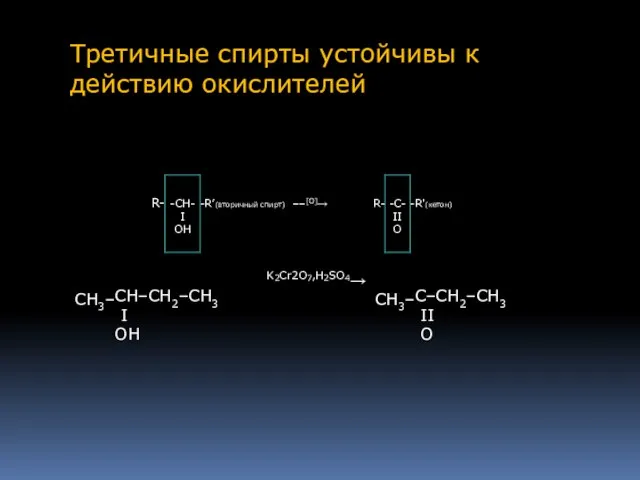
- 14. Третичные спирты устойчивы к действию окислителей.
- 15. Дегидратация Внутримолекулярная дегидратация приводит к образованию алкенов CH3–CH2–OH ––t>140C,H2SO4 CH2=CH2 + H2O При отщеплении воды от
- 17. Скачать презентацию











 Окислительно-восстановитительные реакции Выполнили ученики 9 А класса МОУ-СОШ №4 Никитин Андрей Афонин Николай
Окислительно-восстановитительные реакции Выполнили ученики 9 А класса МОУ-СОШ №4 Никитин Андрей Афонин Николай Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда Полиэтилен высокого давления
Полиэтилен высокого давления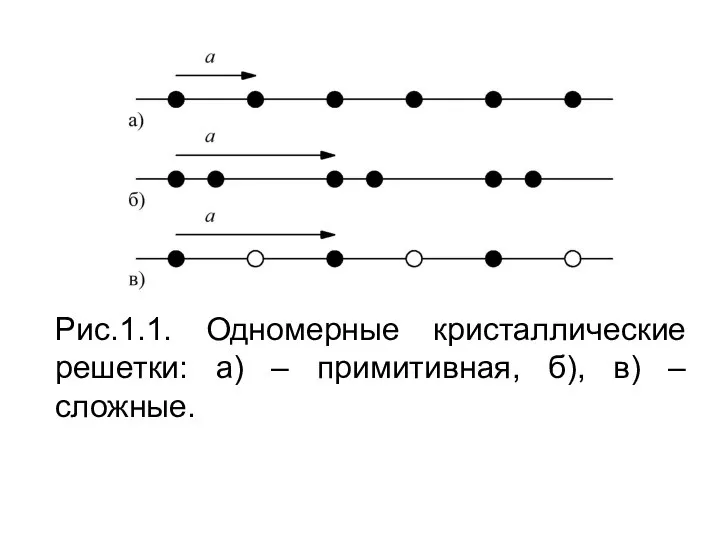 Кристаллические решётки
Кристаллические решётки Химические свойства кислот
Химические свойства кислот Щелочно-земельные металлы
Щелочно-земельные металлы Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Липиды. Классификация
Липиды. Классификация Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Строение и функция белков
Строение и функция белков Соединения галогенов.
Соединения галогенов. Химические знаки и химические формулы Задачи урока: Познакомиться с химическими знаками химических элементов. Рассмотреть стру
Химические знаки и химические формулы Задачи урока: Познакомиться с химическими знаками химических элементов. Рассмотреть стру Теоретические аспекты
Теоретические аспекты Окислительные методы получения органических соединений
Окислительные методы получения органических соединений Классификация и краткие характеристики основных групп токсикантов
Классификация и краткие характеристики основных групп токсикантов Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды»
Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды» Углеродистые конструкционные стали
Углеродистые конструкционные стали Презентация Белки
Презентация Белки Липиды. Классификация, строение, свойства, биологическая роль
Липиды. Классификация, строение, свойства, биологическая роль Пластмасса
Пластмасса Водородная и донорно-акцепторная связи. (Лекция 15)
Водородная и донорно-акцепторная связи. (Лекция 15) Вода в природе. Свойства воды.
Вода в природе. Свойства воды. Классификация и номенклатура неор.соединений
Классификация и номенклатура неор.соединений Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Презентация по Химии "Стекло. Производство стекла" - скачать смотреть
Презентация по Химии "Стекло. Производство стекла" - скачать смотреть