Содержание
- 2. ОПРЕДЕЛЕНИЕ АЛЬДЕГИДЫ СnH2n+1OН или СnH2nO это органические соединения, молекулы которых содержат карбонильную группу, связанную с атомом
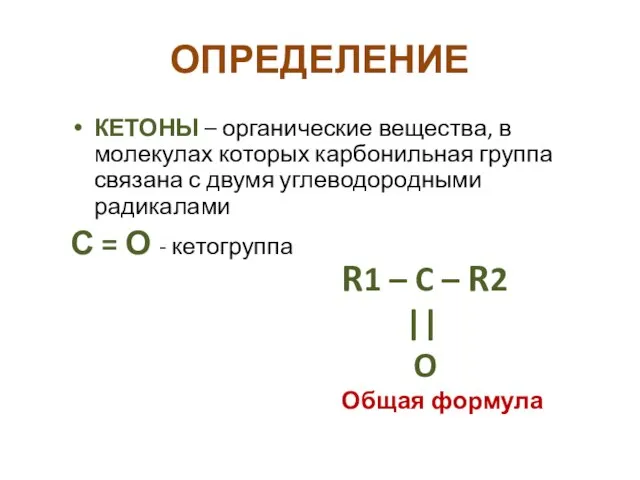
- 3. ОПРЕДЕЛЕНИЕ КЕТОНЫ – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами С
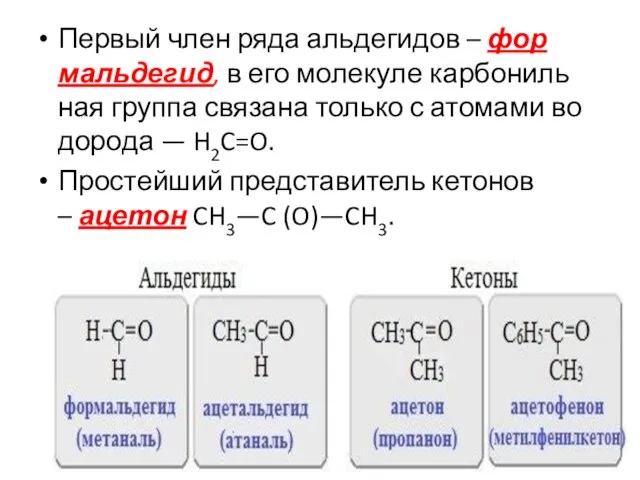
- 5. Первый член ряда альдегидов – формальдегид, в его молекуле карбонильная группа связана только с атомами водорода
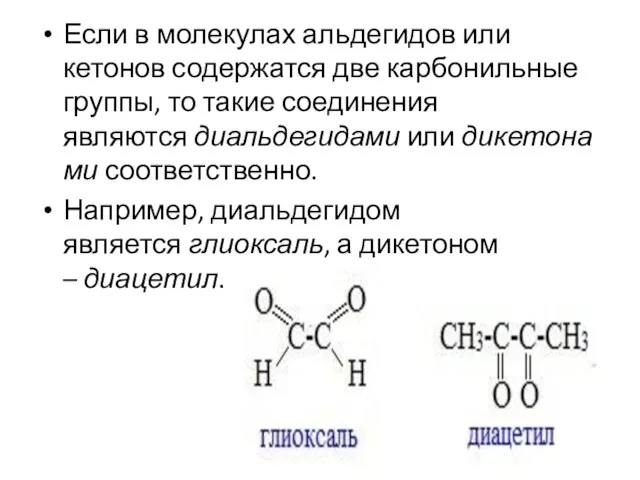
- 6. Если в молекулах альдегидов или кетонов содержатся две карбонильные группы, то такие соединения являются диальдегидами или
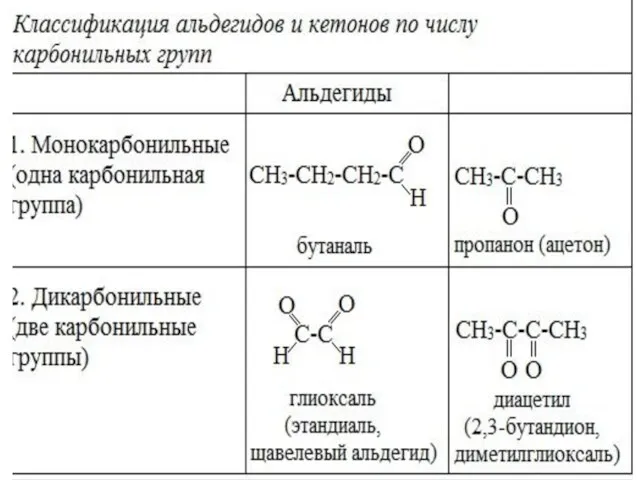
- 7. Классификация альдегидов и кетонов Альдегиды и кетоны классифицируют по строению углеводородного радикала и по числу карбонильных
- 11. Номенклатура альдегидов Название альдегида по международной номенклатуре (систематической) образуется от названия соответствующего алкана с таким же
- 13. Наличие кратных связей или боковых цепей в молекуле альдегида обозначается аналогично алканам. Нередко в названиях альдегидов
- 15. Для альдегидов широко применяются тривиальные названия. Они образуются из соответствующих тривиальных названий карбоновых кислот, в которые
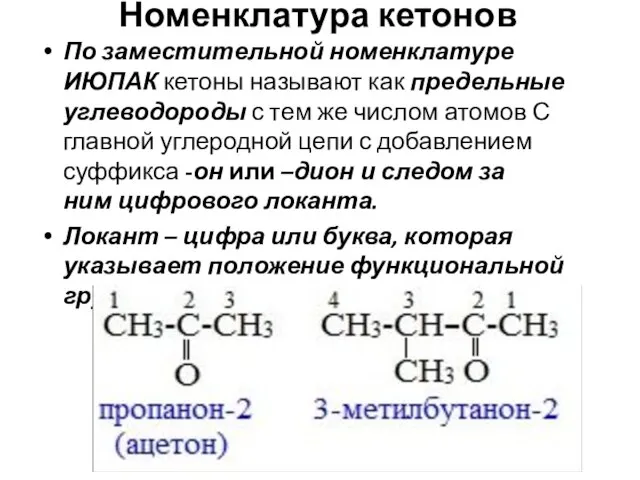
- 17. Номенклатура кетонов По заместительной номенклатуре ИЮПАК кетоны называют как предельные углеводороды с тем же числом атомов
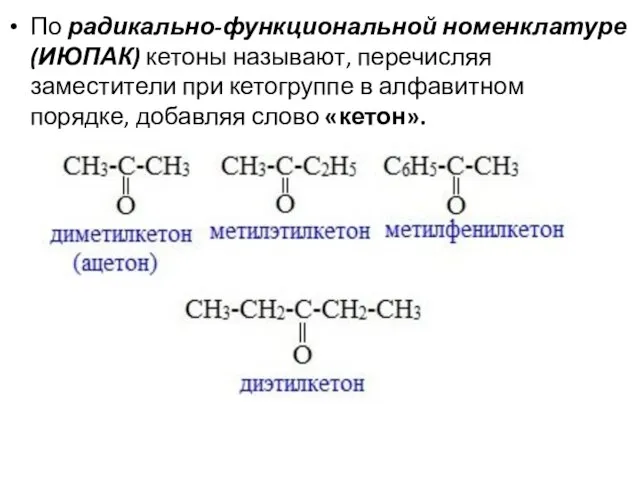
- 20. По радикально-функциональной номенклатуре (ИЮПАК) кетоны называют, перечисляя заместители при кетогруппе в алфавитном порядке, добавляя слово «кетон».
- 21. При наличии двух одинаковых или разных радикалов указывают, симметрично (симм-) или несимметрично (несимм— ) они расположены
- 22. Алициклические кетоны называют только по номенклатуре ИЮПАК. Нумерацию цикла начинают с карбонильной группы, при этом, в
- 23. Непредельные кетоны Кетоны этого ряда называют как по радикало-функциональной номенклатуре (для кетонов простого строения), так и
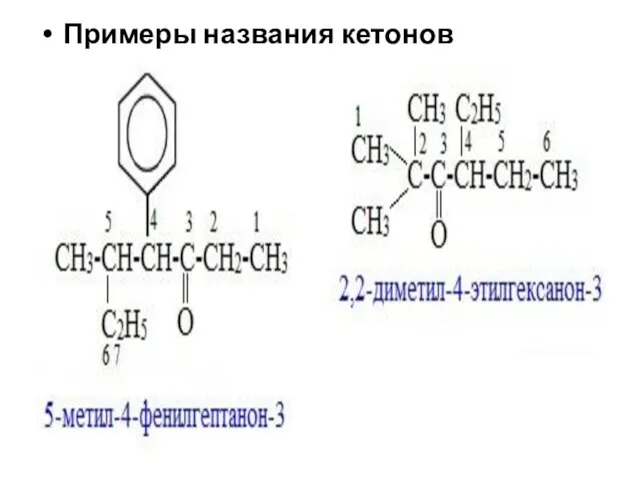
- 25. Примеры названия кетонов
- 26. Изомерия альдегидов и кетонов Для альдегидов и кетонов характерна структурная изомерия Для карбонильных соединений возможна пространственная
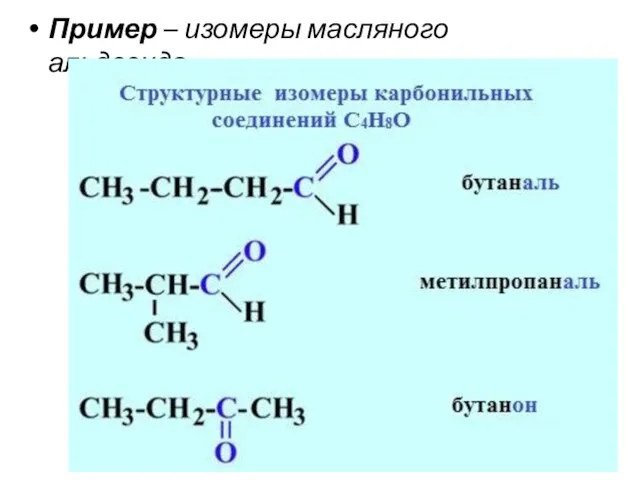
- 27. Изомерия альдегидов 1. Изомерия углеродного скелета, начиная с С4 2. Межклассовая изомерия с кетонами, начиная с
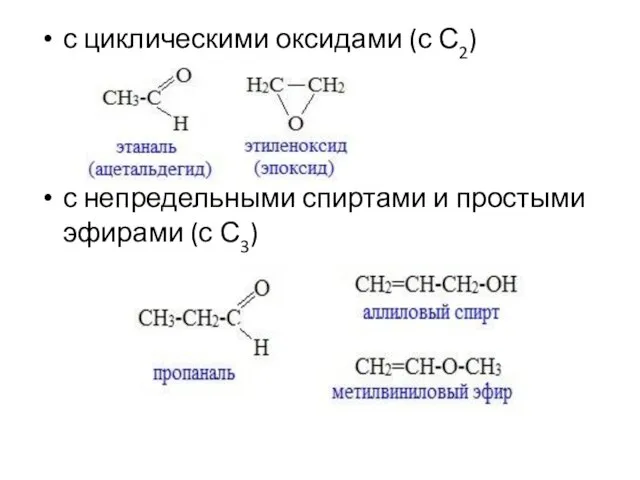
- 28. с циклическими оксидами (с С2) с непредельными спиртами и простыми эфирами (с С3)
- 29. Изомерия кетонов 1. Изомерия углеродного скелета (c C5) 2. Изомерия положения карбонильной группы (c C5) 3.
- 30. Пример – изомеры масляного альдегида
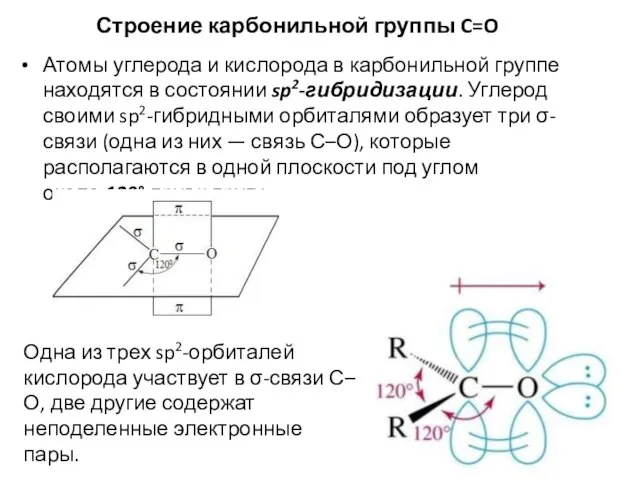
- 32. Строение карбонильной группы C=O Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод
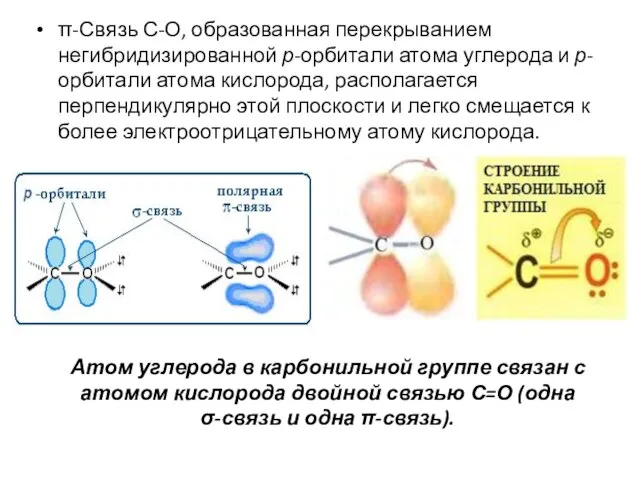
- 33. π-Связь С-О, образованная перекрыванием негибридизированной р-орбитали атома углерода и р-орбитали атома кислорода, располагается перпендикулярно этой плоскости
- 34. Связь С=О сильно поляризована. Электроны кратной связи С=О, особенно более подвижные π-электроны, смещены к более электроотрицательному
- 35. С1 – газ с резким запахом С2 – С3 – жидкости с резким запахом С4 –
- 36. Физические свойства кетонов Кетоны — летучие жидкости. Кетоны обладают приятным запахом. Высшие кетоны – твердые вещества,
- 37. Отличительной чертой многих альдегидов является их запах. Высшие альдегиды, особенно непредельные и ароматические, входят в состав
- 38. В плодах ванили содержится ароматический альдегид, который придает им характерный запах. Ванилин применяется в парфюмерии, кондитерской
- 39. Запах цитрусовых обусловлен данным диеновым альдегидом. Его применяют в качестве отдушки средств бытовой химии, косметических и
- 40. Коричный альдегид Коричный альдегид содержится в масле корицы, его получают перегонкой коры дерева корицы . Применяется
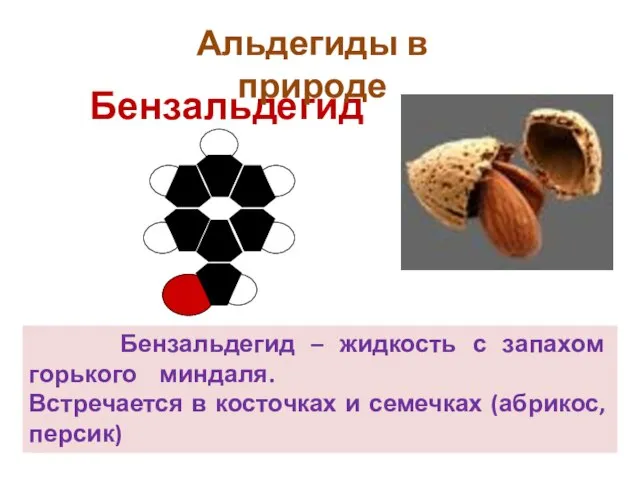
- 41. Бензальдегид Бензальдегид – жидкость с запахом горького миндаля. Встречается в косточках и семечках (абрикос, персик) Альдегиды
- 42. Фенилэтаналь Фенилэтаналь по сравнению с бензальдегидом лучше соответствует рецептору цветочного запаха. Фенилэтаналь пахнет гиацинтом. Альдегиды в
- 43. n-Гидроксифенилбутанон-2 Этот кетон обуславливает в основном запах спелых ягод малины. Его включают в состав синтетических душистых
- 44. Химические свойства
- 45. Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с
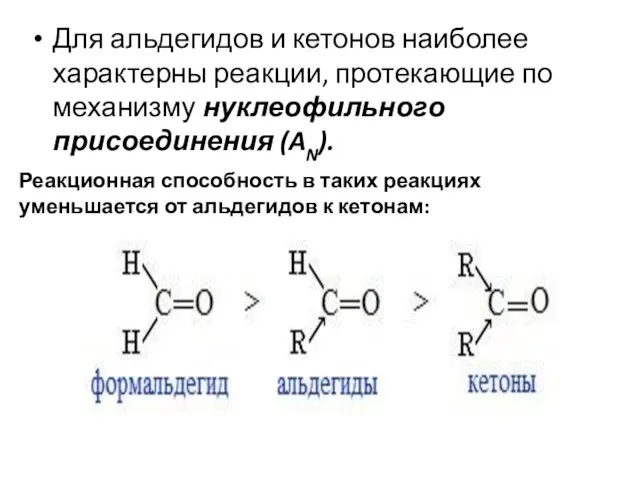
- 46. Для альдегидов и кетонов наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения (AN). Реакционная способность в
- 47. При сравнении реакционной способности альдегидов и кетонов необходимо учесть 2 фактора: электронный и пространственный Альдегиды более
- 48. В молекулах кетонов на карбонильный атом углерода действуют индуктивные эффекты двух углеводородных радикалов R и R',
- 49. Пространственный фактор связан с доступностью реакционного центра (Cδ+) для нуклеофильной атаки, а это зависит от размеров
- 50. Реакционная способность карбонильных соединений определяется величиной частичного положительного заряда δ+ на атоме углерода в карбонильной группе.
- 51. Для карбонильных соединений характерны реакции: присоединение по карбонильной группе; реакции замещения у α-углеродного атома; полимеризация; поликонденсация;
- 52. Реакции присоединения Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного
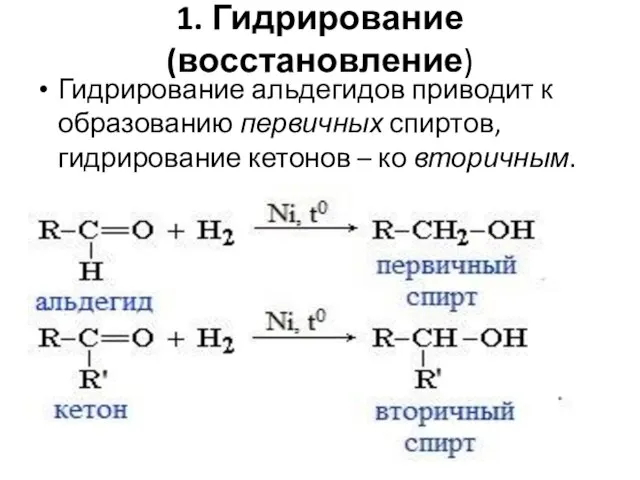
- 53. 1. Гидрирование (восстановление) Гидрирование альдегидов приводит к образованию первичных спиртов, гидрирование кетонов – ко вторичным.
- 55. В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития (тетрагидроалюминат лития) LiAlH4:
- 56. 2. Присоединение циановодородной (синильной) кислоты НСN Альдегиды и кетоны, взаимодействуя с синильной кислотой, образуют циангидрины –
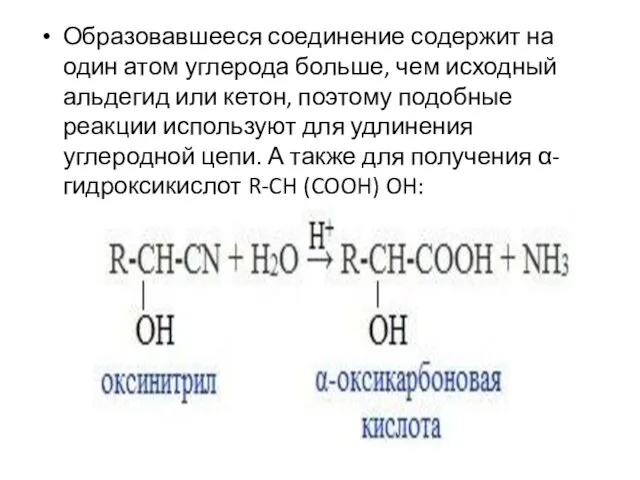
- 57. Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции
- 58. 3. Взаимодействие со спиртами (в присутствии кислоты или основания как катализатора) Альдегиды могут взаимодействовать с одной
- 60. Гидроксильная группа полуацеталей (полуацетальный гидроксил) очень реакционноспособна. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии
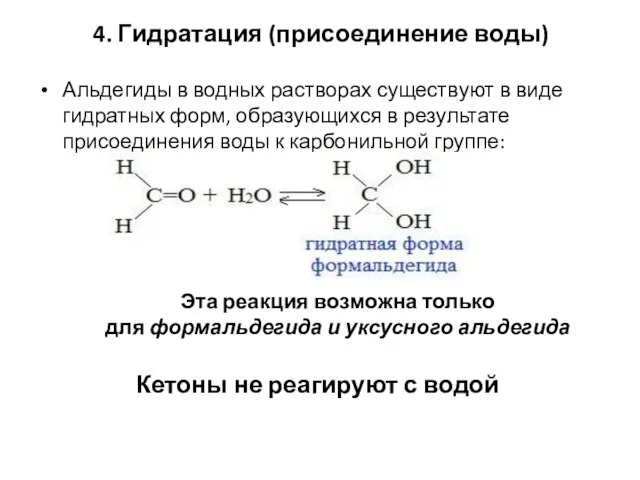
- 61. 4. Гидратация (присоединение воды) Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате
- 62. 5. Присоединение реактива Гриньяра — образование спиртов При добавлении раствора галогеналкана в диэтиловом эфире к магниевой
- 63. а) Взаимодействием реактива Гриньяра с формальдегидом можно получить первичный спирт (кроме метанола). Для этого продукт присоединения
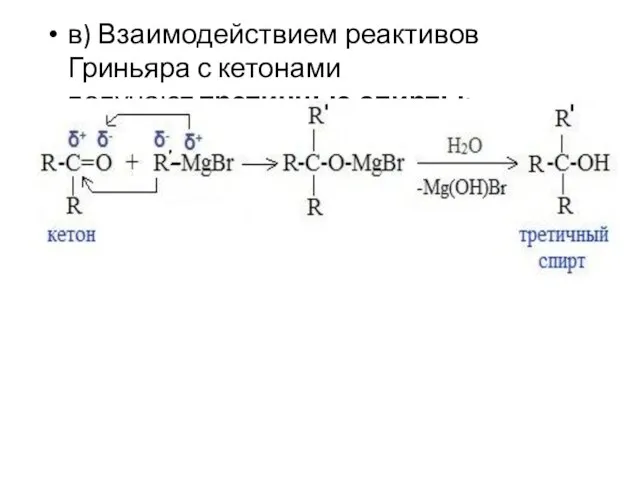
- 64. в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
- 65. 6. Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов Качественная реакция на альдегидную группу! Альдегиды
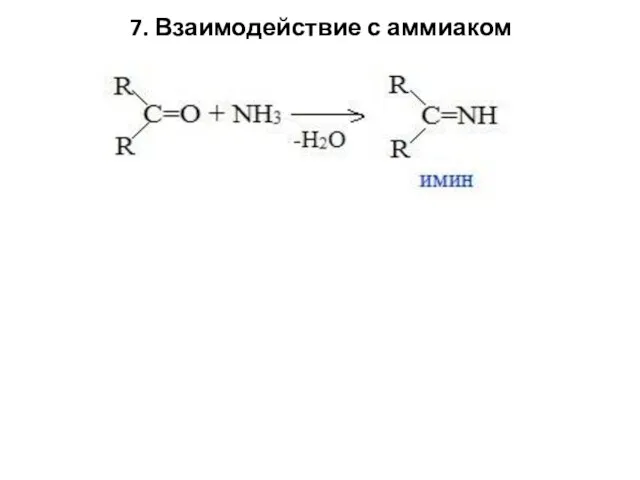
- 66. 7. Взаимодействие с аммиаком
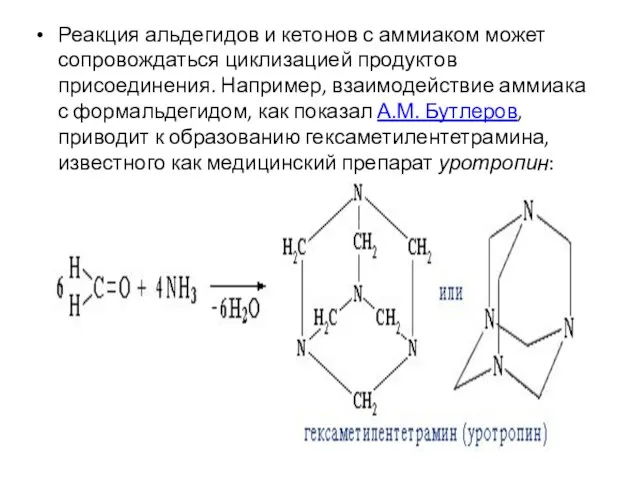
- 67. Реакция альдегидов и кетонов с аммиаком может сопровождаться циклизацией продуктов присоединения. Например, взаимодействие аммиака с формальдегидом,
- 68. Нитрование гексаметилентетрамина приводит к образованию сильного взрывчатого вещества "гексоген":
- 69. II. Реакции окисления: по связи С-Н [О] - KMnO4, K2Cr2O7, Cu(OH)2, оксиды и гидроксиды меди и
- 70. 1. Реакция «серебряного зеркала» - окисление аммиачным раствором оксида серебра (реактив Толленса) Качественная реакция на альдегидную
- 71. Упрощенно
- 72. 2. Окисление гидроксидом меди (II) Качественная реакция на альдегидную группу! Для реакции используют свежеприготовленный Cu (ОН)2,
- 73. 3. Реакция на альдегиды с фуксиносернистой кислотой (реактив Шиффа) Качественная реакция на альдегидную группу! Кетоны не
- 75. 4. Окисление перманганатом калия Альдегиды можно окислить подкисленным раствором перманганат калия КMnO4 при нагревании
- 76. 5. Горение (полное окисление)
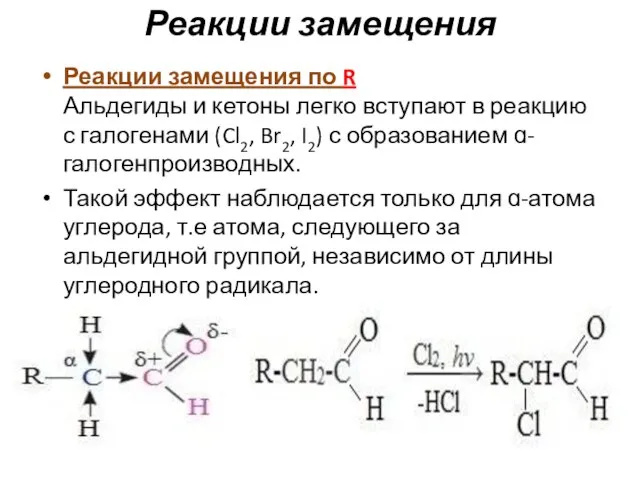
- 77. Реакции замещения Реакции замещения по R Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2,
- 78. Галогенопроизводные альдегидов и кетонов проявляют слезоточивое действие и называются лакриматорами. При избытке галогена замещению подвергаются все
- 79. 2. Галоформная реакция (иодоформная реакция, или проба Люголя) Качественная реакция на метилкетоны и ацетальдегид! Иодоформная реакция
- 80. Реакции полимеризации Полимеризация — частный случай реакций присоединения — характерна в основном для альдегидов. 1. Линейная
- 81. 2. Циклическая полимеризация (тримеризация, тетрамеризация) При взаимодействии молекул альдегидов возможно также образование циклических соединений. а) Тример
- 82. б) Полимеризация ацетальдегида в присутствии следов серной кислоты приводит к образованию в зависимости от условий двух
- 83. Реакции поликонденсации Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углеродной связи, причем
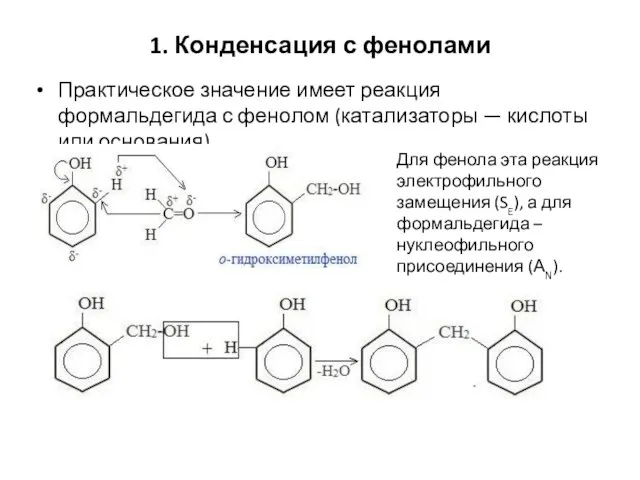
- 84. 1. Конденсация с фенолами Практическое значение имеет реакция формальдегида с фенолом (катализаторы — кислоты или основания).
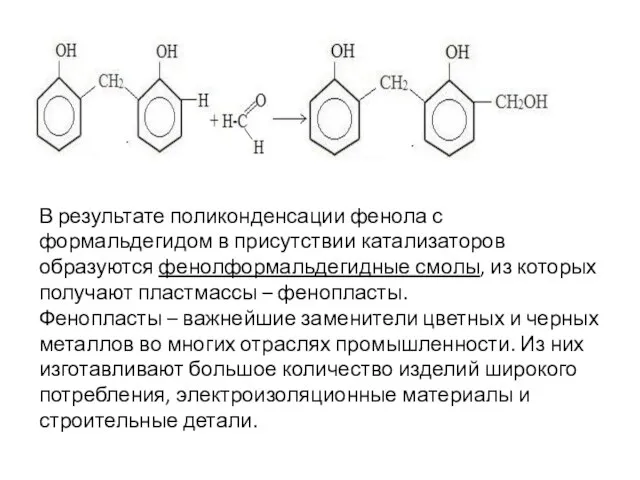
- 85. В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы
- 86. 2. Конденсация альдегидов с карбамидом (мочевиной) (NH2)2C=O - получение карбамидных (мочевино-формальдегидных) смол
- 87. 4. Альдольно-кротоновая конденсация При альдольной конденсации происходит присоединение одной молекулы карбонильного соединения к другой молекуле, образуется
- 88. При кротоновой конденсации образуется молекула непредельного альдегида или кетона. Химическая реакция сопровождается выделением молекулы воды. Реакция
- 89. Реакции диспропорционирования Реакция Канниццаро Альдегиды, не содержащие атом водорода у α-углеродного атома, в щелочной среде способны
- 90. Реакции замещения по связи С=О 1). С РСl5 кислород замещается на 2 атома хлора R R
- 91. Получение альдегидов и кетонов 1. Окисление спиртов В лаборатории карбонильные соединения получают окислением спиртов в жестких
- 92. Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот: При окислении вторичных
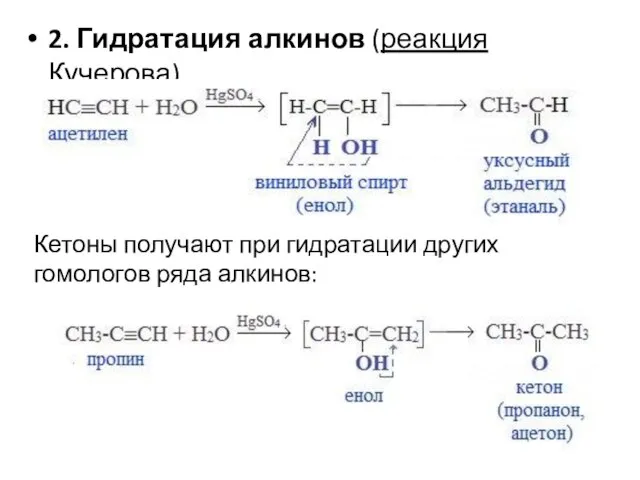
- 93. 2. Гидратация алкинов (реакция Кучерова) Кетоны получают при гидратации других гомологов ряда алкинов:
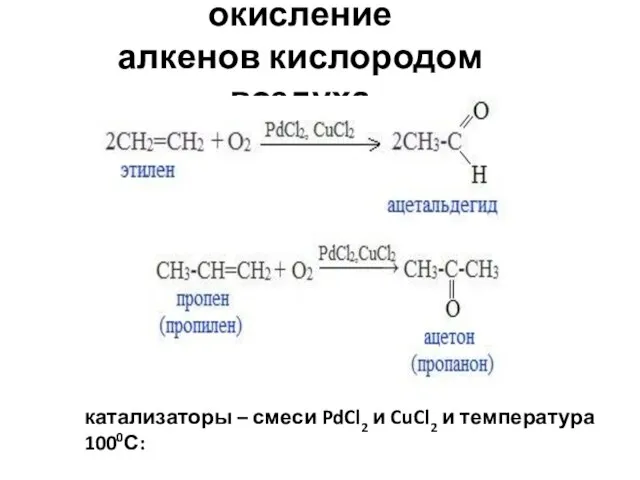
- 94. 3. Каталитическое окисление алкенов кислородом воздуха катализаторы – смеси PdCl2 и CuCl2 и температура 1000С:
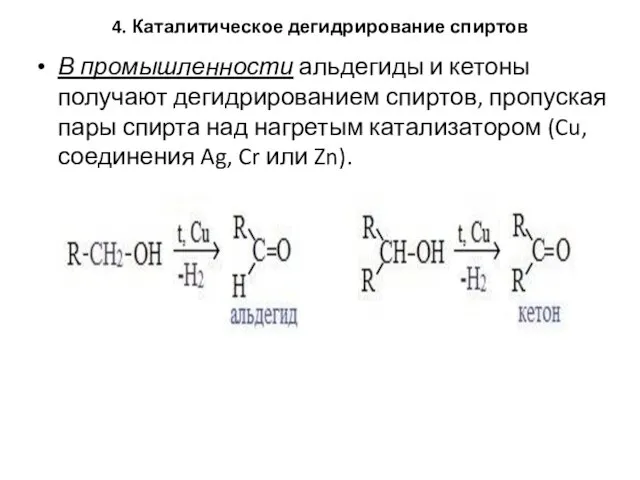
- 95. 4. Каталитическое дегидрирование спиртов В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над
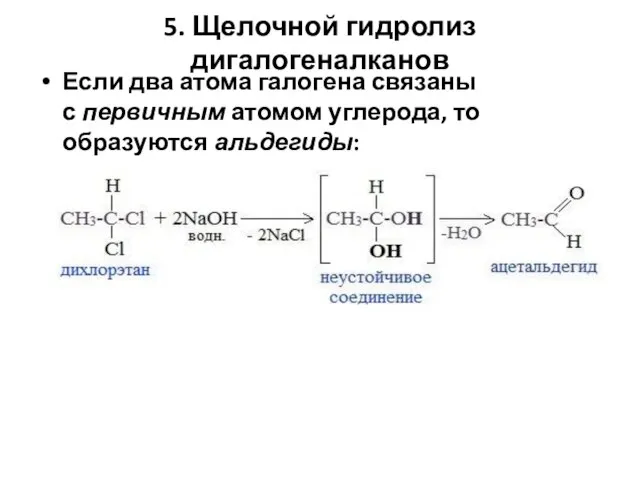
- 96. 5. Щелочной гидролиз дигалогеналканов Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
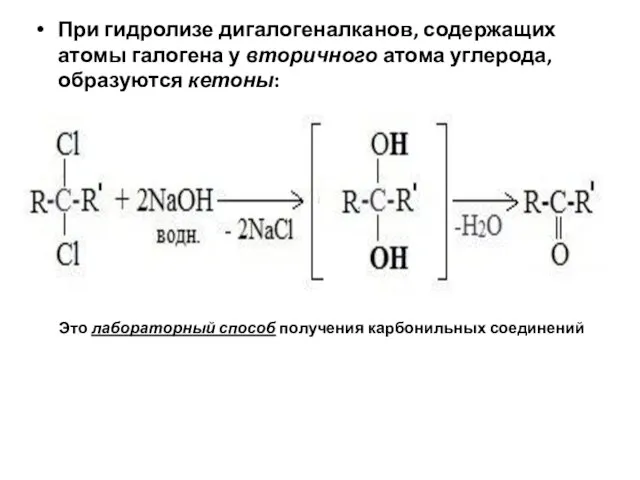
- 97. При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны: Это лабораторный способ получения
- 98. ГИДРОЛИЗ ДИГАЛОГЕНАЛКАНОВ O СН3 - СН - Сl + 2НOH → СН3 - С + H2O
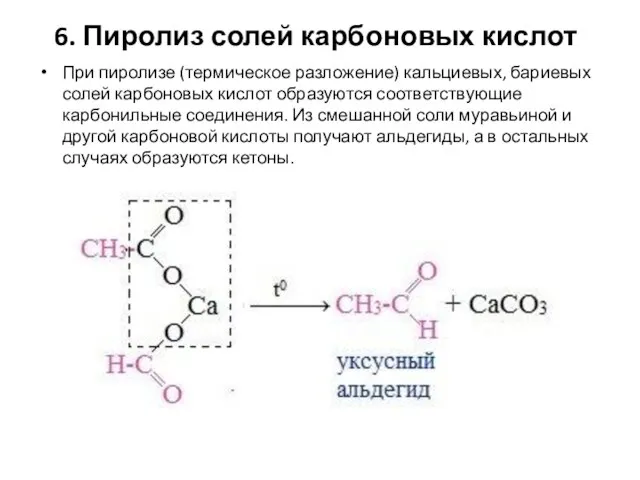
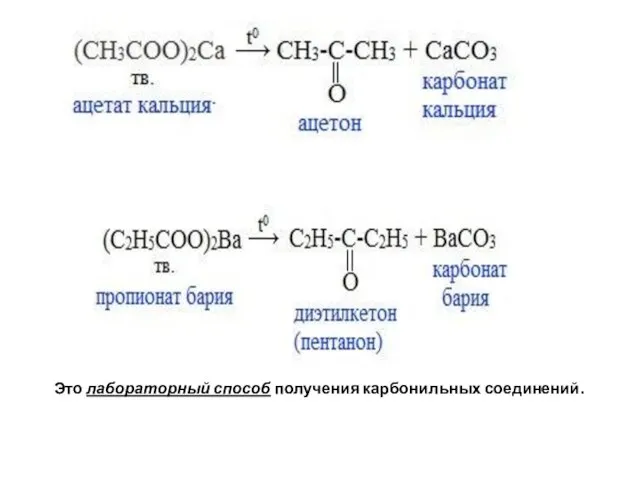
- 99. 6. Пиролиз солей карбоновых кислот При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие
- 100. Это лабораторный способ получения карбонильных соединений.
- 101. 7. Кумольный способ получения ацетона (наряду с фенолом) Это промышленный способ получения ацетона
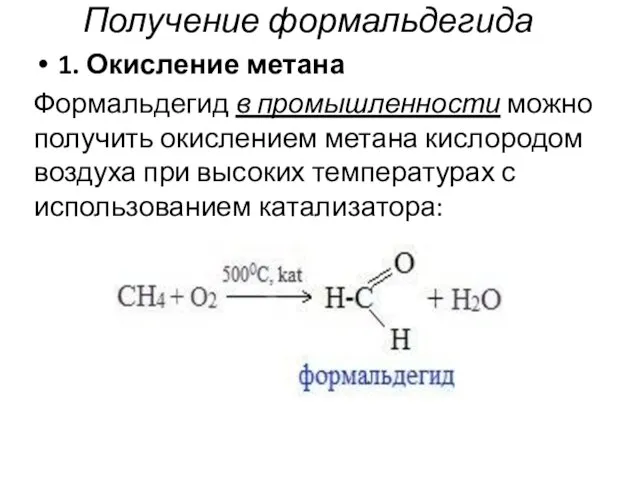
- 102. Получение формальдегида 1. Окисление метана Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких
- 104. Скачать презентацию
















































![II. Реакции окисления: по связи С-Н [О] - KMnO4, K2Cr2O7, Cu(OH)2,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/615207/slide-68.jpg)






















 Тема: Химическая связь и ее типы Урок химии в 11 классе
Тема: Химическая связь и ее типы Урок химии в 11 классе Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений
Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть
Презентация по Химии "Глюкоза. Строение. Физические и химические свойства" - скачать смотреть  Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Alkanes. A “family” of hydrocarbons
Alkanes. A “family” of hydrocarbons Фенол Подготовил Ежов Сергей
Фенол Подготовил Ежов Сергей Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Продолжение лекции «Химическая связь»
Продолжение лекции «Химическая связь» Свойства основных классов материалов
Свойства основных классов материалов Алканы и алкены
Алканы и алкены Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Логическая структура модуля по дисциплине Аналитическая химия
Логическая структура модуля по дисциплине Аналитическая химия Аммофос өндірісі. Алыну әдісі
Аммофос өндірісі. Алыну әдісі Лабораторные занятия по теме: Методы защиты электрооборудования от коррозии
Лабораторные занятия по теме: Методы защиты электрооборудования от коррозии Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Гидролиз солей. Составила: Рудчинкова Л.Ю., учитель химии и биологии МОУ «СОШ им. М.М. Рудченко с. Перелюб Перелюбского района Сарато
Гидролиз солей. Составила: Рудчинкова Л.Ю., учитель химии и биологии МОУ «СОШ им. М.М. Рудченко с. Перелюб Перелюбского района Сарато Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Межкристаллитная коррозия МКК
Межкристаллитная коррозия МКК Механизмы двухсубстатных реакций
Механизмы двухсубстатных реакций Начала физической химии
Начала физической химии Альдегиды и кетоны: свойства, получение, применение
Альдегиды и кетоны: свойства, получение, применение Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом
Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом Липиды. Классификация липидов
Липиды. Классификация липидов Орбитали и связи
Орбитали и связи Общая и медицинская химия
Общая и медицинская химия Циклоалканы. Строение, изомерия, получение и свойства
Циклоалканы. Строение, изомерия, получение и свойства Белки. Структуры белков
Белки. Структуры белков