Содержание
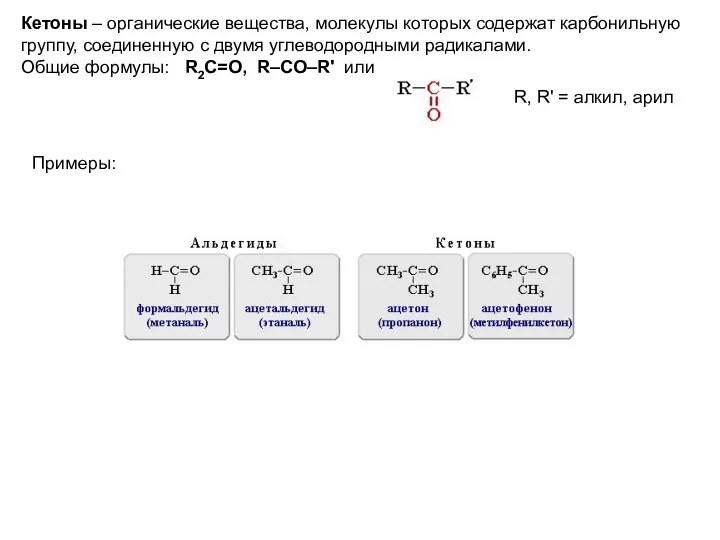
- 2. Кетоны – органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами. Общие формулы:
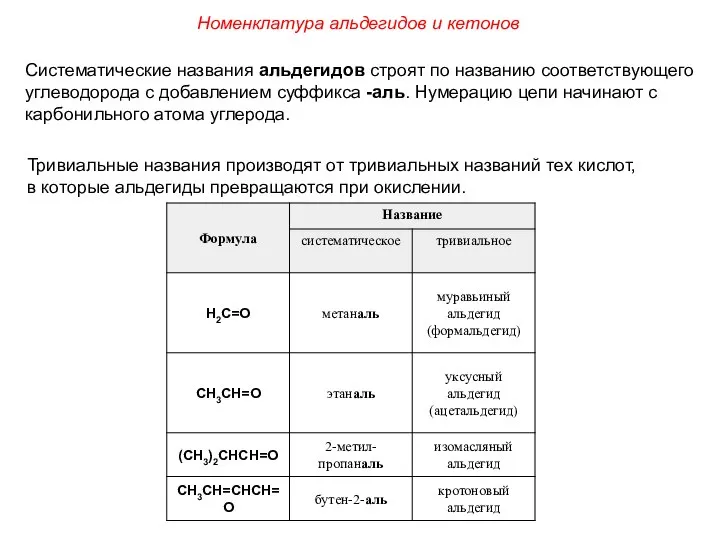
- 3. Номенклатура альдегидов и кетонов Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса -аль.
- 4. Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон
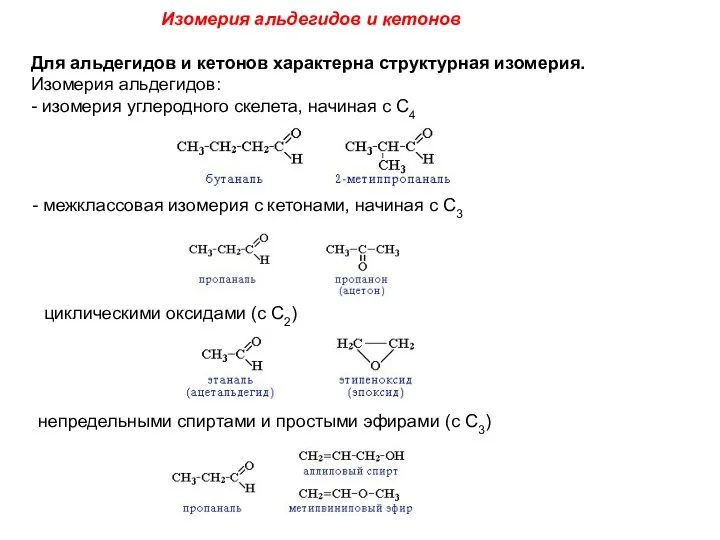
- 5. Изомерия альдегидов и кетонов Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: - изомерия углеродного
- 6. Изомерия кетонов: - углеродного скелета (c C5) - положения карбонильной группы (c C5) - межклассовая изомерия
- 7. Реакции альдегидов и кетонов Для карбонильных соединений характерны реакции различных типов: - присоединение по карбонильной группе;
- 8. Реакции присоединения по карбонильной группе Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция
- 9. Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами. Реакции полимеризации карбонильных
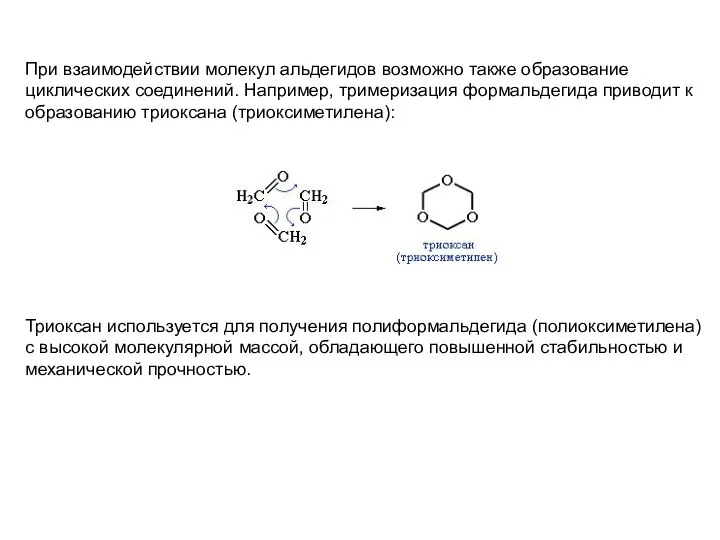
- 10. При взаимодействии молекул альдегидов возможно также образование циклических соединений. Например, тримеризация формальдегида приводит к образованию триоксана
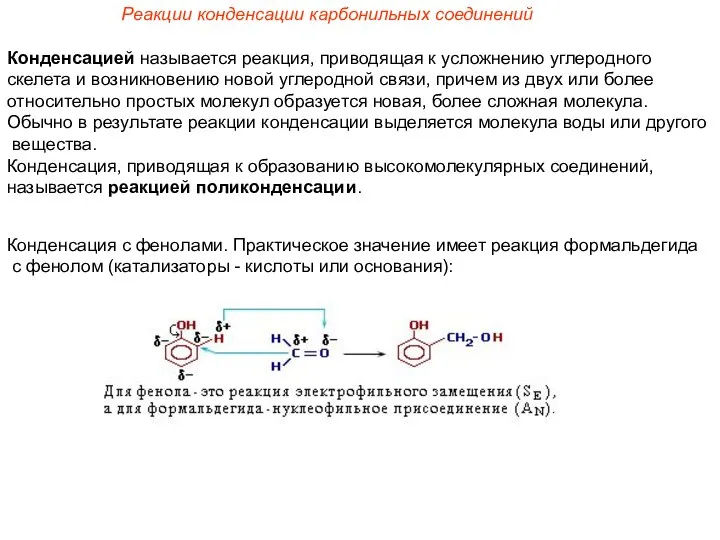
- 11. Реакции конденсации карбонильных соединений Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углеродной
- 12. Реакции восстановления альдегидов и кетонов Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора образуют первичные спирты,
- 13. Окисление гидроксидом меди (II): а) в виде свежеприготовленного осадка Cu(OH)2 при нагревании, б) в форме комплекса
- 14. Получение альдегидов и кетонов Окисление спиртов Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются
- 15. 3. Гидратация алкинов (реакция Кучерова) Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к
- 16. Применение альдегидов и кетонов Метаналь (муравьиный альдегид) CH2=O -получение фенолформальдегидных смол; -получение мочевино-формальдегидных (карбамидных) смол; -полиоксиметиленовые
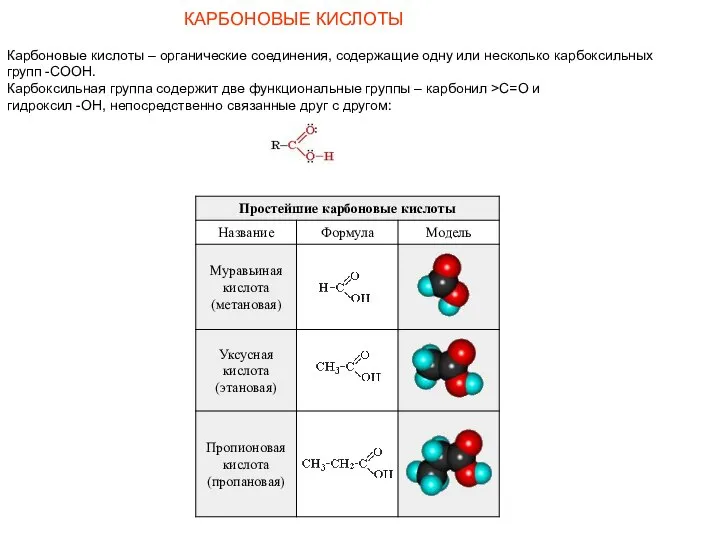
- 17. КАРБОНОВЫЕ КИСЛОТЫ Карбоновые кислоты – органические соединения, содержащие одну или несколько карбоксильных групп -СООН. Карбоксильная группа
- 18. Классификация карбоновых кислот Карбоновые кислоты классифицируют по двум структурным признакам. 1. По числу карбоксильных групп кислоты
- 19. Номенклатура карбоновых кислот Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и
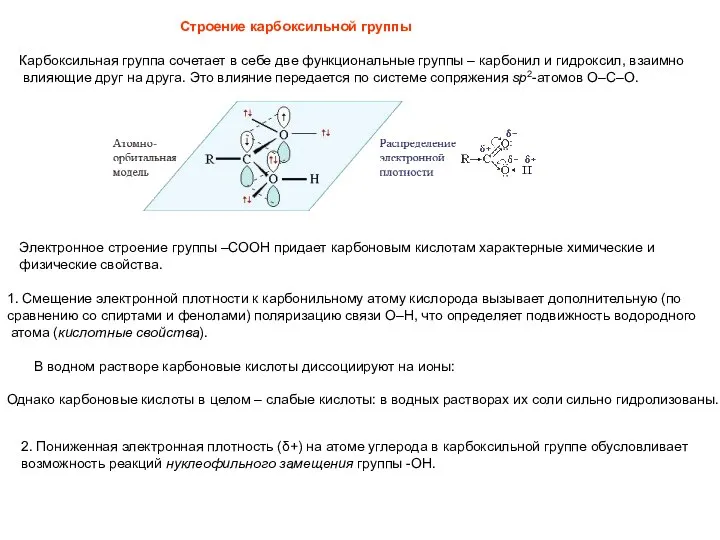
- 20. Строение карбоксильной группы Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно
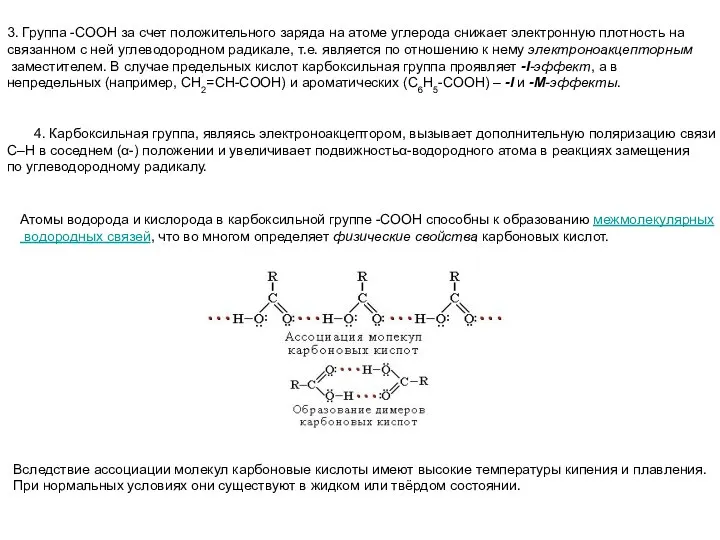
- 21. 3. Группа -СООН за счет положительного заряда на атоме углерода снижает электронную плотность на связанном с
- 22. Растворимость карбоновых кислот в воде обусловлена образованием межмолекулярных водородных связей с растворителем: Низшие гомологи С1-С3 смешиваются
- 23. 1. Образование солей происходит при действии на карбоновые кислоты: а) активных металлов 2RCOOH + Mg →(RCOO)2Mg
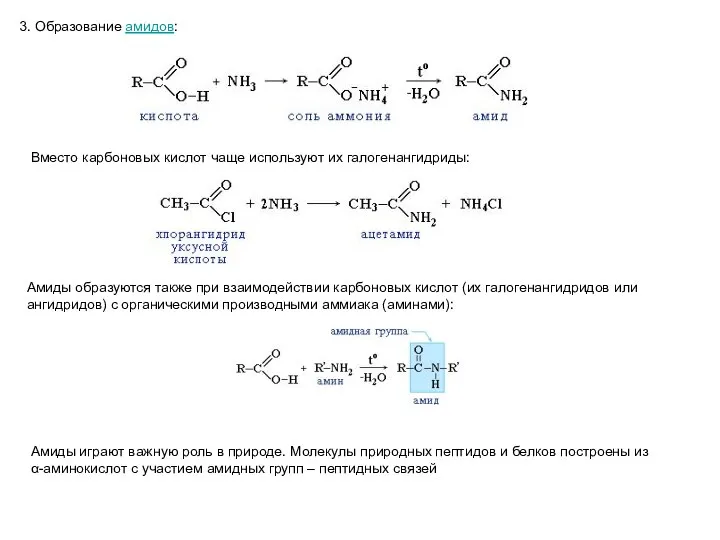
- 24. 3. Образование амидов: Вместо карбоновых кислот чаще используют их галогенангидриды: Амиды образуются также при взаимодействии карбоновых
- 25. Сложные эфиры Сложные эфиры карбоновых кислот – соединения с общей формулой R–COOR', Где R и R'
- 26. Жиры Жиры – сложные эфиры глицерина и высших одноосновных карбоновых кислот. Общее название таких соединений –
- 27. Жидкие жиры превращают в твердые путем реакции гидрогенизации (каталитического гидрирования). При этом водород присоединяется по двойной
- 29. Скачать презентацию

















 Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу
Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу Этановая кислота Бутановая кислота
Этановая кислота Бутановая кислота Полезные свойства камней
Полезные свойства камней Презентация по Химии "Основы" - скачать смотреть бесплатно
Презентация по Химии "Основы" - скачать смотреть бесплатно Разбор заданий #ОВРновый, #реакционно и #соточка
Разбор заданий #ОВРновый, #реакционно и #соточка Нефть и способы её переработки
Нефть и способы её переработки Ферум. Залізо ПІДГОТУВАВ УЧЕНЬ 8-Б КЛАСУ
Ферум. Залізо ПІДГОТУВАВ УЧЕНЬ 8-Б КЛАСУ  Обсидиан
Обсидиан Презентация Промышленные способы получения металлов
Презентация Промышленные способы получения металлов  Силикаты AI
Силикаты AI Alkaline earth metals
Alkaline earth metals Химические средства защиты растений
Химические средства защиты растений Основные законы в химии
Основные законы в химии Экологическая эффективность-зеленые решения
Экологическая эффективность-зеленые решения Теоретические основы качественного анализа
Теоретические основы качественного анализа Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Палива Підготувала Учениця 7(11) – А класу Одеського НВК№13
Палива Підготувала Учениця 7(11) – А класу Одеського НВК№13  Антибиотики. Действие антибиотиков
Антибиотики. Действие антибиотиков Оксиды. Распределите вещества (тест)
Оксиды. Распределите вещества (тест) Каучуки. Гума
Каучуки. Гума Классификация электрохимических методов анализа
Классификация электрохимических методов анализа Технология поликристаллического кремния. Его применение
Технология поликристаллического кремния. Его применение Методы исследования химического состава нефти и продуктов ее переработки
Методы исследования химического состава нефти и продуктов ее переработки Сравнение и выбор типа реактора
Сравнение и выбор типа реактора Природные источники и переработка углеводородов
Природные источники и переработка углеводородов Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия
Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия Гомеопатические лекарственные средства минерального происхождения. Часть І (группа щелочных и щелочно-земельных металлов)
Гомеопатические лекарственные средства минерального происхождения. Часть І (группа щелочных и щелочно-земельных металлов)