Содержание
- 2. Составьте уравнения указанных реакций, укажите условия их протекания, назовите полученные вещества I и III варианты: этен
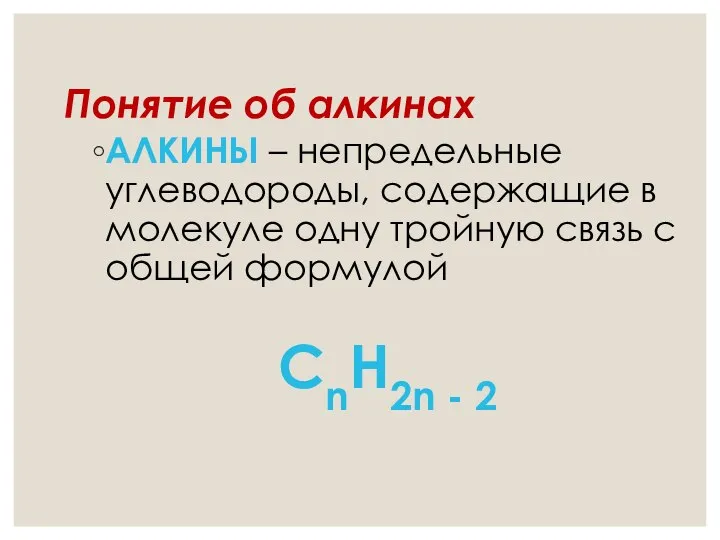
- 3. Понятие об алкинах АЛКИНЫ – непредельные углеводороды, содержащие в молекуле одну тройную связь с общей формулой
- 4. алкин НС СН Н3С С СН
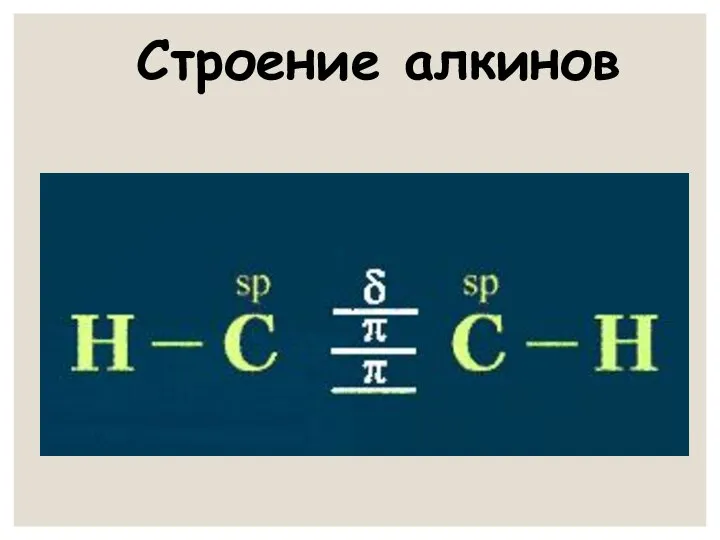
- 5. Характеристика тройной связи Вид гибридизации – sp Вид связи – ковалентная полярная По типу перекрывания –
- 6. Строение алкинов
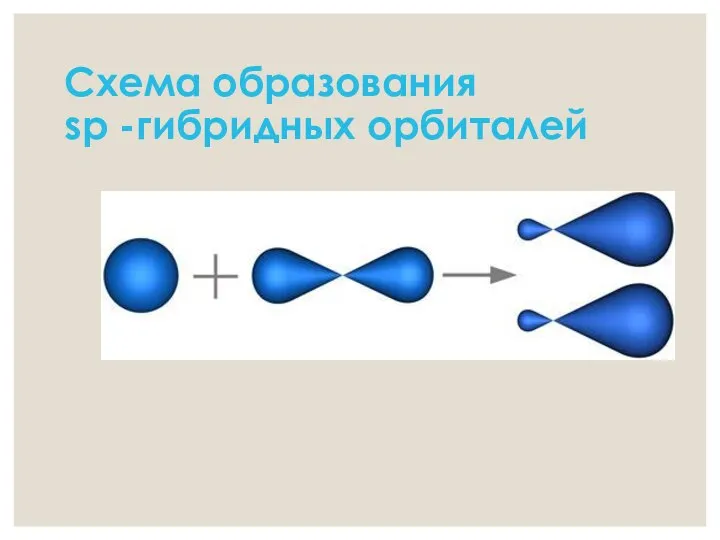
- 7. Схема образования sp -гибридных орбиталей
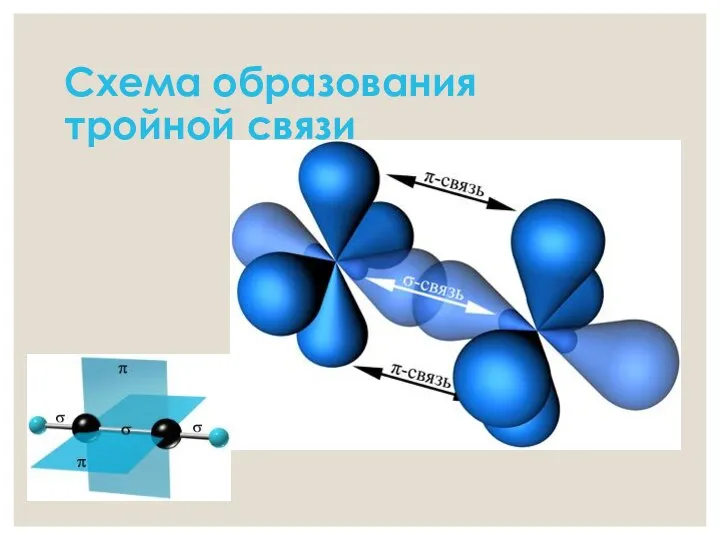
- 8. Схема образования тройной связи
- 9. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин (ацетилен) Пропин Бутин Пентин Гексин Гептин
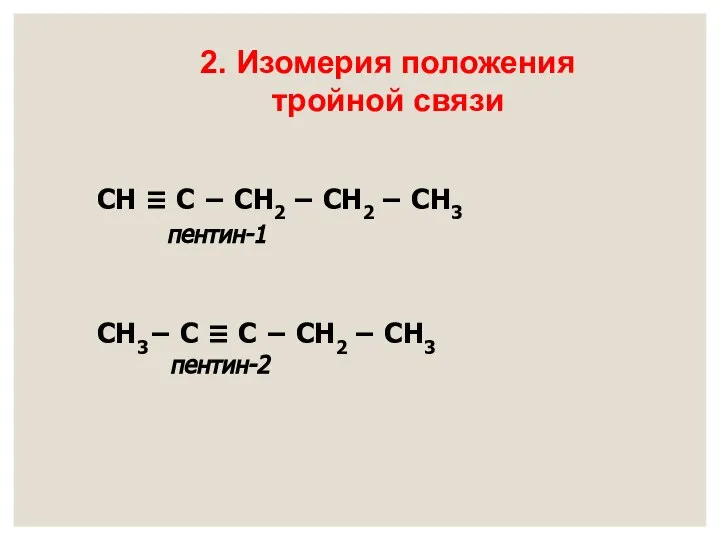
- 10. ВИДЫ ИЗОМЕРИИ СН ≡ С − СН2 − СН2 − СН3 пентин-1 СН ≡ С −
- 11. СН ≡ С − СН2 − СН2 − СН3 пентин-1 СН3− С ≡ С − СН2
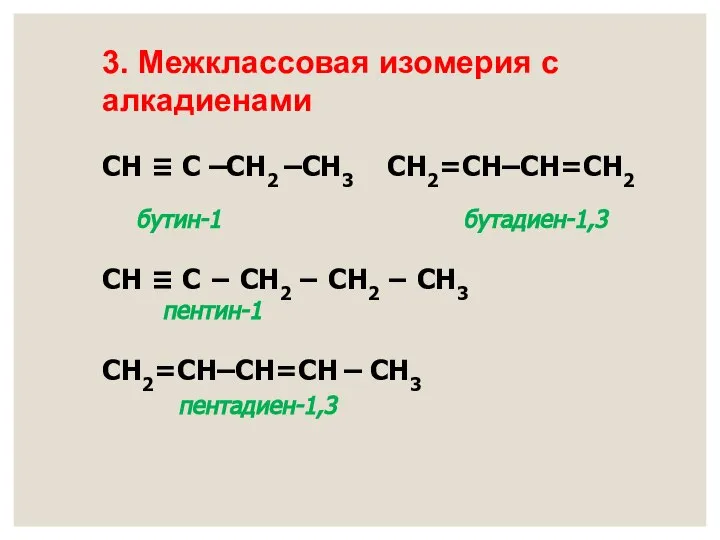
- 12. СН ≡ С –СН2 –СН3 СН2=СН–СН=СН2 бутин-1 бутадиен-1,3 СН ≡ С − СН2 − СН2 −
- 13. Номенклатура алкинов
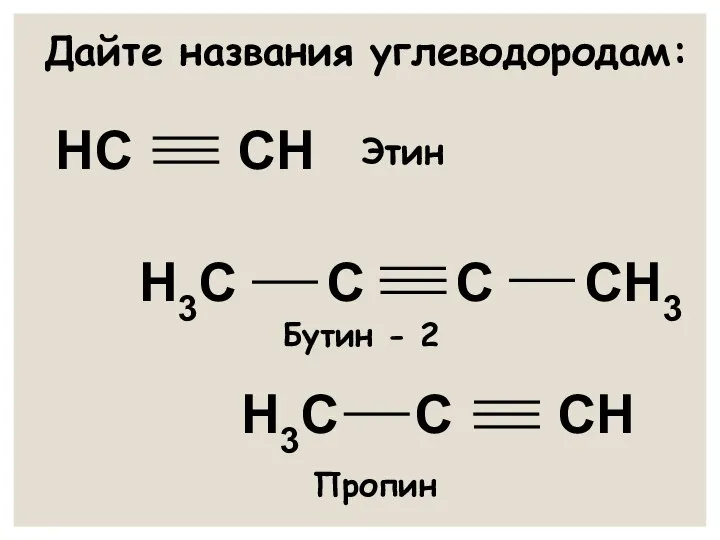
- 14. Дайте названия углеводородам: НС СН Н3С С СН Н3С С С СН3 Этин Бутин - 2
- 15. Получение алкинов 1. Карбидный способ (гидролиз карбида кальция): Основной недостаток – большие затраты электроэнергии на производство
- 16. 2. Термический крекинг метана.
- 17. 3. Дегидрогалогенирование спиртовым раствором щёлочи:
- 18. Физические свойства алкинов
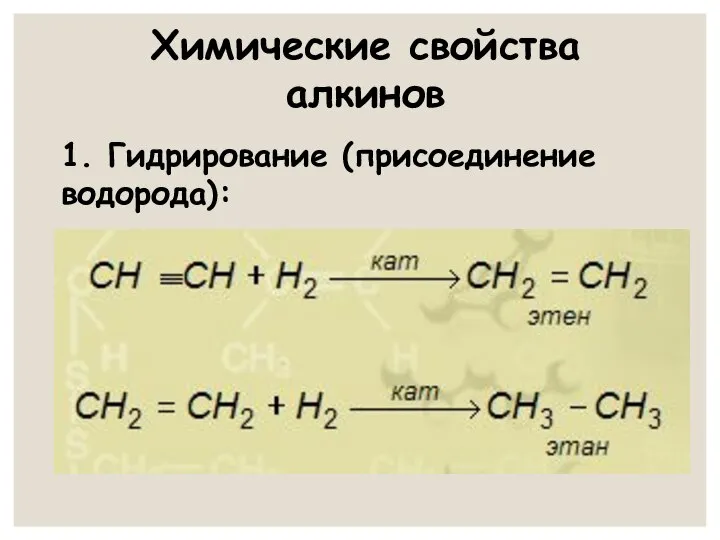
- 19. Химические свойства алкинов 1. Гидрирование (присоединение водорода):
- 20. 2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее,
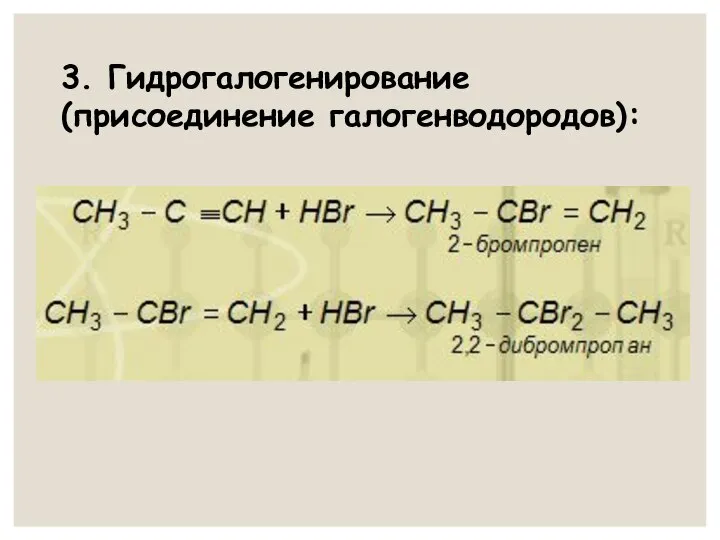
- 21. 3. Гидрогалогенирование (присоединение галогенводородов):
- 22. Правило В. В. Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то есть
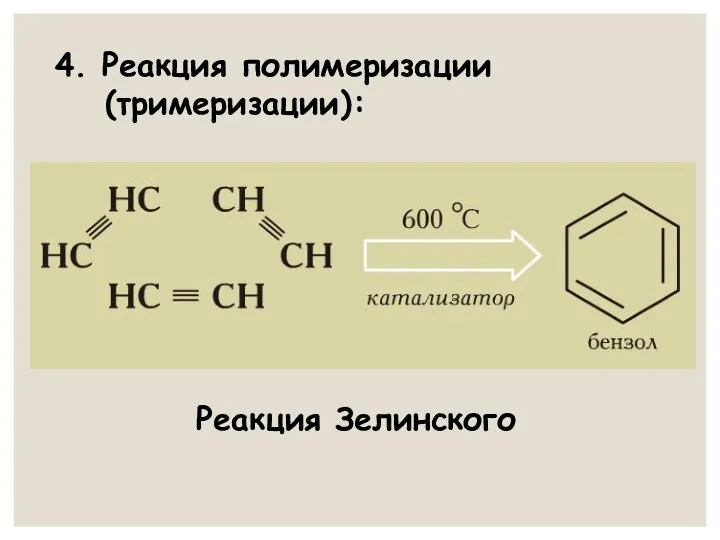
- 23. 4. Реакция полимеризации (тримеризации): Реакция Зелинского
- 24. 5. Реакция Кучерова (присоединение воды к ацетилену в присутствии солей ртути с образованием альдегида): этин уксусный
- 25. Горение (горят светящимся и коптящим пламенем с выделением большого количества тепла) C2H2 + 2О2 → 2СО2
- 26. Кислотные свойства. 7) Водородные атомы ацетилена способны замещаться металлами с образованием ацетиленидов. Так, при действии на
- 27. Применение алкинов
- 32. Выводы: Углеводороды с общей формулой СnH2n-2, в молекулах которых имеется одна тройная связь, называются алкинами. Наиболее
- 33. Источники информации 1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. Учебник для вузов./ Под ред.
- 35. Скачать презентацию






















 Информационные технологии на уроках химии
Информационные технологии на уроках химии Способы переработки нефти
Способы переработки нефти Пластические массы
Пластические массы Правила безпечного використання засобів побутової хімії
Правила безпечного використання засобів побутової хімії  Теория электролитической диссоциации
Теория электролитической диссоциации Тема: «Самородные металлы».
Тема: «Самородные металлы». Энергетика химических процессов
Энергетика химических процессов Вплив фосфатної побутової хімії на організм людини.
Вплив фосфатної побутової хімії на організм людини.  Решение задач по теме «Растворы»
Решение задач по теме «Растворы» Химическая термодинамика и кинетика
Химическая термодинамика и кинетика соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю.
соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю. Основные свойства кристаллов
Основные свойства кристаллов Презентация по Химии "Етери та естери" - скачать смотреть бесплатно
Презентация по Химии "Етери та естери" - скачать смотреть бесплатно Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Гипер-гипофосфатемия
Гипер-гипофосфатемия Ультразвук к в химической технологии. Лекция 5
Ультразвук к в химической технологии. Лекция 5 Класифікація пластмас
Класифікація пластмас  Дисциплина: Химия. Лекция 1. Растворы
Дисциплина: Химия. Лекция 1. Растворы Подготовка к ГИА. Тренажер по химии
Подготовка к ГИА. Тренажер по химии Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Важнейшие кислоты и кислотные остатки. (Леция 1)
Важнейшие кислоты и кислотные остатки. (Леция 1) Углеводы. Строение углеводов
Углеводы. Строение углеводов Презентация по Химии "Горение кислорода" - скачать смотреть
Презентация по Химии "Горение кислорода" - скачать смотреть  Застосування нових сучасних матеріалів з оригінльними властивостями
Застосування нових сучасних матеріалів з оригінльними властивостями  Непредельные углероды. Алкены
Непредельные углероды. Алкены Синтетические моющие средства
Синтетические моющие средства Конденсация. Капельная и пленочная конденсация
Конденсация. Капельная и пленочная конденсация Імунопатологія. Імунопрофілактика і імунотерапія інфекційних захворювань. Засоби імунокорекції
Імунопатологія. Імунопрофілактика і імунотерапія інфекційних захворювань. Засоби імунокорекції