Содержание
- 2. Алкины – это непредельные углеводороды, молекулы которых содержат, помимо одинарных связей, одну тройную углерод-углеродную связь и
- 3. Характеристика алкинов Особенности строения: присутствие тройной и одинарных углерод-углеродных связей.
- 4. Характеристика алкинов 2. Общая формула: CnH2n-2
- 5. Характеристика алкинов 3. Номенклатура: алкин- n, где n – номер атома С, после которого идёт тройная
- 6. Характеристика алкинов 4. Физические свойства: углеводороды от C2H2 до С4Н6 представляют собой при обычных условиях газы,
- 7. Получение 1. В промышленности: Пиролиз – (от греч. пир-огонь, лизис-разложение) - разложение веществ при высоких температурах
- 8. Гомологический ряд ацетилена
- 9. Изомерия алкинов изомерия углеродного скелета, изомерия положения кратных связей, межклассовая изомерия
- 10. Химические свойства и применение ацетилена Горение 2С2Н2+5О2 t=32000C 4СО2+2Н2О+Q Ацетилен на воздухе горит коптящим пламенем из-за
- 11. Присоединение: а)хлороводорода (гидрохлорирование) АlСl3 СН ≡ СН + HCI→ CH2 = СН (хлорэтен или винилхлорид) Cl
- 12. в)галогенов (галогенирование) Качественная реакция на кратную связь 1-ая стадия: CH ≡ CH+Br2 CH = CH Br
- 13. Окисление перманганатом калия: качественная реакция на ацетилен и непредельные органические соединения 3С2Н2+8KMnO4 3KOOC-COOK+8MnO2↓+2KOH+2H2O Визуальный эффект: обесцвечивание
- 14. Полимеризация винилхлорида n CH2 = CH -CH2 - CH - Cl Cl n поливинилхлорид винилхлорид
- 15. Применение ацетилена
- 17. Скачать презентацию














 Установка гидрокрекинга в составе завода глубокой переработки нефти ООО «Кинеф»
Установка гидрокрекинга в составе завода глубокой переработки нефти ООО «Кинеф» Презентация по Химии "Полімери" - скачать смотреть бесплатно
Презентация по Химии "Полімери" - скачать смотреть бесплатно Мильні “бомбочки” Підготувала Учениця 11А Коваленко Альона
Мильні “бомбочки” Підготувала Учениця 11А Коваленко Альона  Кислоты (часть 2). 8 класс
Кислоты (часть 2). 8 класс ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н
ИЗОМЕРИЯ И СТРОЕНИЕ КС. СПОСОБНОСТЬ АТОМОВ РАЗЛИЧНЫХ ЭЛЕМЕНТОВ К КОМПЛЕКСООБРАЗОВАНИЮ. УСТОЙЧИВОСТЬ КС Лектор: канд. хим. н Практическое занятие № 1. Техника безопасности при работе в химической лаборатории. Описание веществ
Практическое занятие № 1. Техника безопасности при работе в химической лаборатории. Описание веществ Современная нефтехимия
Современная нефтехимия Презентация по Химии "Спирты и фенолы" - скачать смотреть
Презентация по Химии "Спирты и фенолы" - скачать смотреть  Жидкие системы
Жидкие системы Презентація по темі «Білки та Амінокислоти»
Презентація по темі «Білки та Амінокислоти»  Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Электрохимия. Понятие электрохимии. Электроды. Гальванические цепи. Окислительно-восстановительные электроды. (Лекция 6.1)
Электрохимия. Понятие электрохимии. Электроды. Гальванические цепи. Окислительно-восстановительные электроды. (Лекция 6.1) Презентация Жидкие кристаллы
Презентация Жидкие кристаллы  Альдегидтер
Альдегидтер Химическая коррозия
Химическая коррозия Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Применение обратимых и необратимых реакций в быту
Применение обратимых и необратимых реакций в быту Классификация химических реакций
Классификация химических реакций Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Структурная механика композитов. Слоистый композит
Структурная механика композитов. Слоистый композит Основы химической термодинамики
Основы химической термодинамики Растворы. Теория электролитической диссоциации
Растворы. Теория электролитической диссоциации Натуральный каучук
Натуральный каучук Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Томский
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Томский Тверді речовини Підготували: В.Алєксєєнко, К.Барабаш, І.Кулеша, О.Матвєєв, О.Суярко…
Тверді речовини Підготували: В.Алєксєєнко, К.Барабаш, І.Кулеша, О.Матвєєв, О.Суярко…  Реологические свойства полимерных материалов
Реологические свойства полимерных материалов Подготовка нефти и газового конденсата к переработке. Атмосферная и вакуумная перегонка
Подготовка нефти и газового конденсата к переработке. Атмосферная и вакуумная перегонка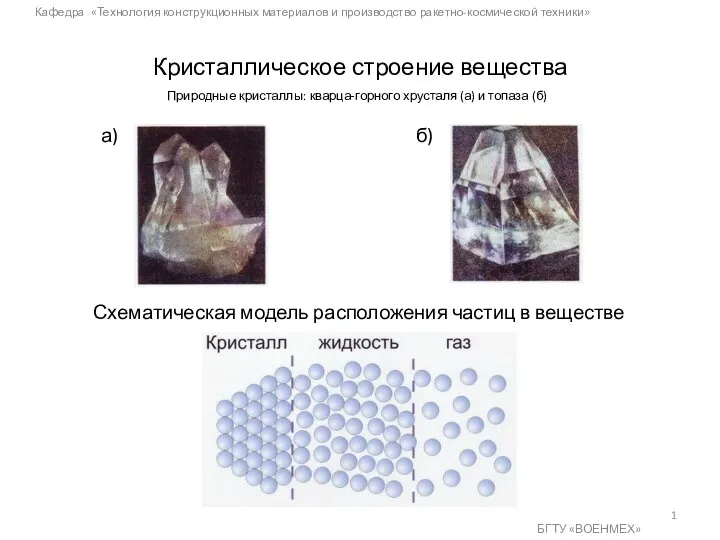 Кристаллическое строение вещества
Кристаллическое строение вещества