Содержание
- 2. Растворы (дисперсные системы) Раствор – это однофазная система переменного, или гетерогенного, состава, состоящая из двух или
- 3. Растворение Растворение — переход молекул вещества из одной фазы в другую. Происходит в результате взаимодействия атомов
- 4. Растворение При растворении межфазная граница исчезает, при этом меняются физические свойства раствора (например, плотность, вязкость, иногда
- 5. Дисперсная система, фаза, среда Дисперсная система - гетерогенные системы, в которых одна из фаз находится в
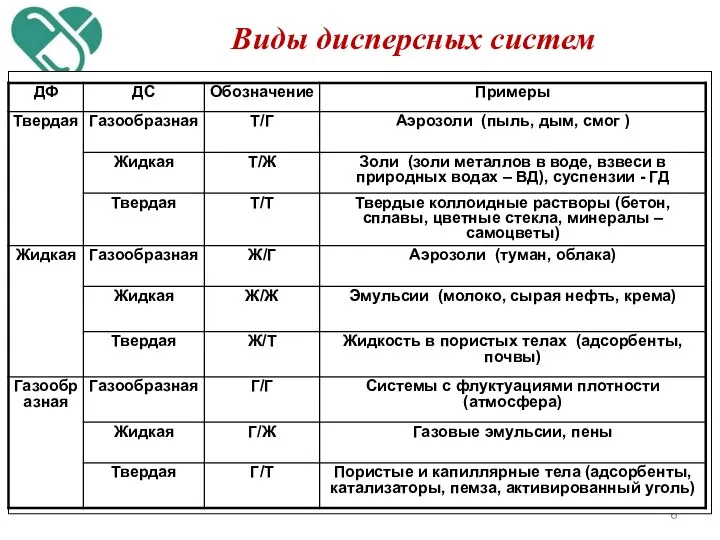
- 6. Виды дисперсных систем
- 7. По величине частиц дисперсной фазы растворы разделяют на: Грубодисперсные системы(взвеси) – это гетерогенные системы (неоднородные). Размеры
- 8. По величине частиц дисперсной фазы растворы разделяют на: Коллоидные растворы (тонкодисперсные системы или золи) – это
- 9. По величине частиц дисперсной фазы растворы разделяют на: Истинные растворы. Размеры частиц составляют 10ˉ8 см (менее
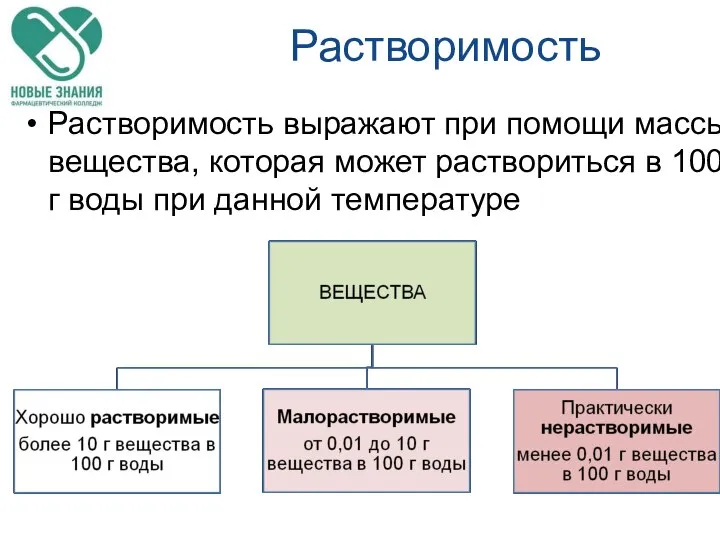
- 10. Растворимость Растворимость выражают при помощи массы вещества, которая может раствориться в 100 г воды при данной
- 11. Растворимость Если молекулы растворителя неполярны или малополярны, то этот растворитель будет хорошо растворять вещества с неполярными
- 12. Растворители К полярным растворителям относят воду и глицерин. К малополярным спирт и ацетон. К неполярным хлороформ,
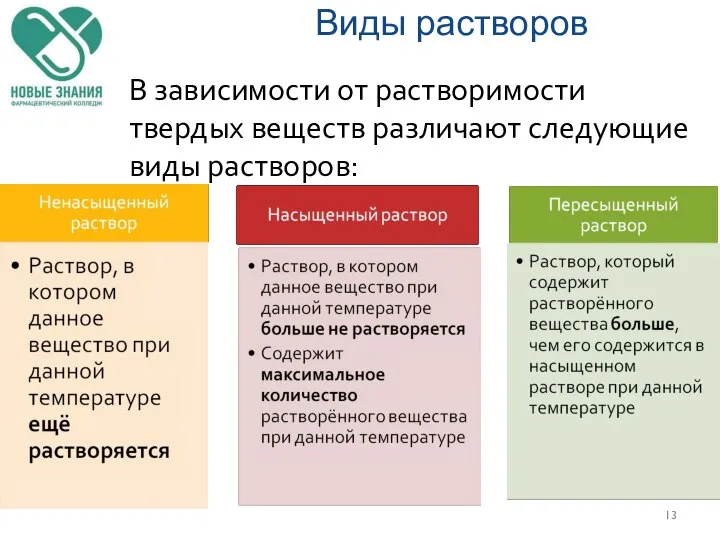
- 13. Виды растворов В зависимости от растворимости твердых веществ различают следующие виды растворов:
- 14. Способы выражения состава раствора
- 15. Д а н о: m(р-ра) = 100 г; m(ВаСl2) = 20 г. Найти: w%(ВаСl2) Решение: w(BaCl2)=m(ВаСl2)/m(р-ра)=20г/100г=0,2
- 16. Д а н о: m(H2O) = 20 г; m(сахара) = 5 г. Найти: w%(сахара) Решение: 1.
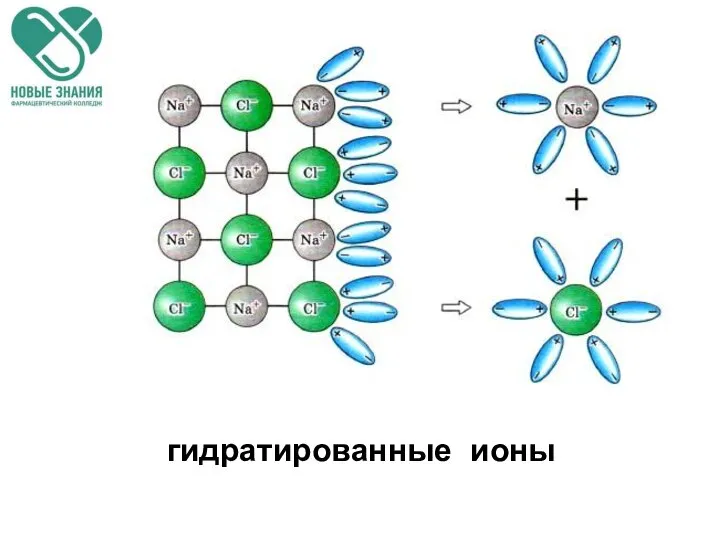
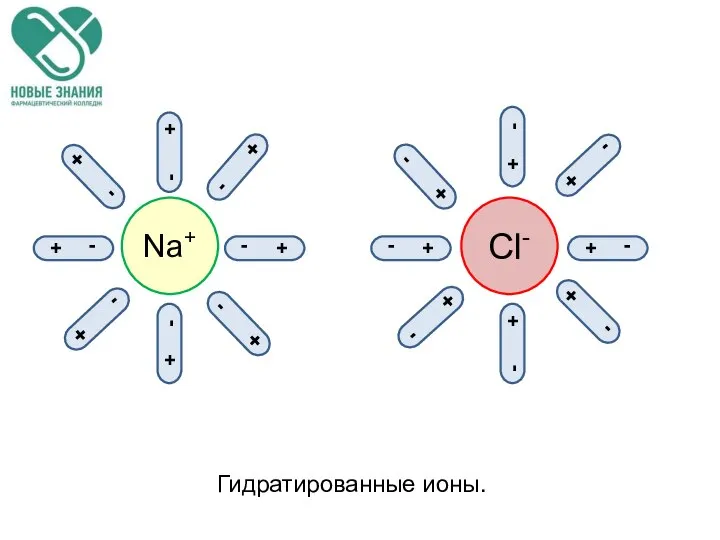
- 17. Гидратная теория Менделеева Сольватация – процесс взаимодействия молекул растворителя и растворяемого вещества. Сольватация в водных растворах
- 18. гидратированные ионы
- 19. Кристаллогидраты Молекулы воды из гидратной оболочки иногда могут вступать в химическую реакцию с растворенным веществом, образуя
- 20. – твердые соли, в состав ионных кристаллов которых входят молекулы воды Кристалл CuSO4•5H2O Глауберова соль Na2SO4•10H2O
- 21. Кристаллогидраты FeSO4 FeSO4 • 7H2O
- 22. Электролиты. Неэлектролиты По способности проводить электрический ток в водном растворе или в расплаве все вещества можно
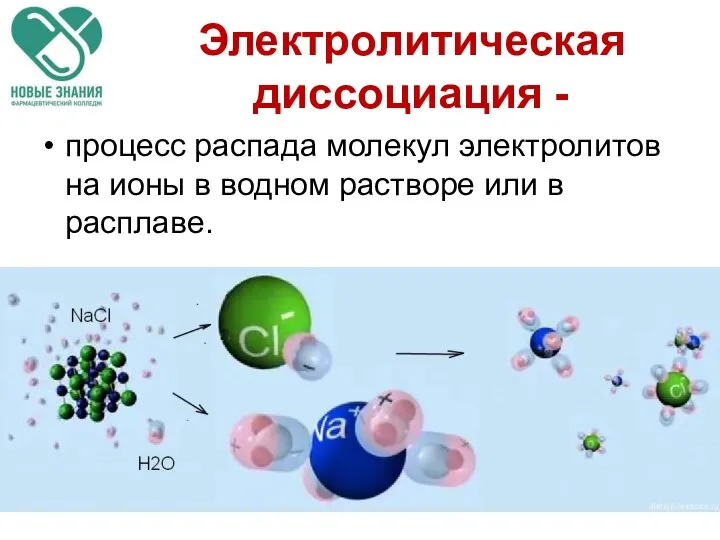
- 24. Электролитическая диссоциация - процесс распада молекул электролитов на ионы в водном растворе или в расплаве.
- 25. Основные положения ТЭД 1. Молекулы электролитов диссоциируют на положительно заряженные ионы (катионы) и отрицательно заряженные ионы
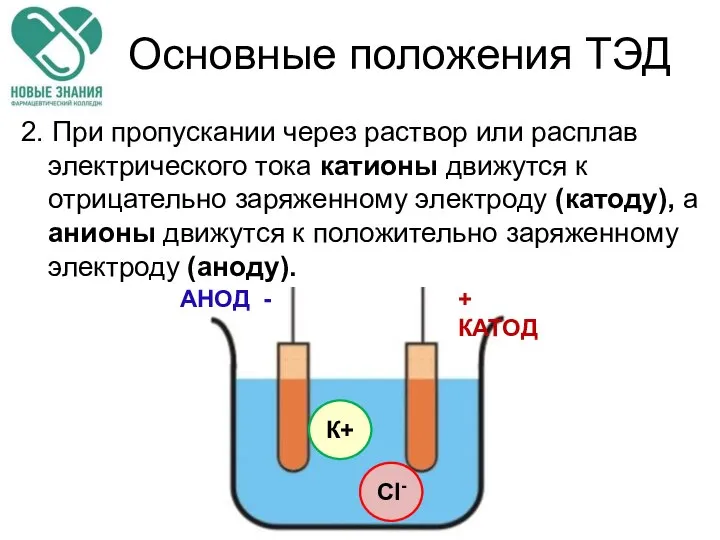
- 26. Основные положения ТЭД 2. При пропускании через раствор или расплав электрического тока катионы движутся к отрицательно
- 27. Основные положения ТЭД Диссоциация многих электролитов —процесс обратимый. Это значит, что одновременно идут два противоположных процесса:
- 28. Уравнение диссоциации Диссоциацию молекул электролитов выражают уравнениями, в которых ставят знак обратимости ( ). Пример, уравнение
- 29. Уравнение диссоциации Общая сумма зарядов катионов равна общей сумме зарядов анионов, так как растворы и расплавы
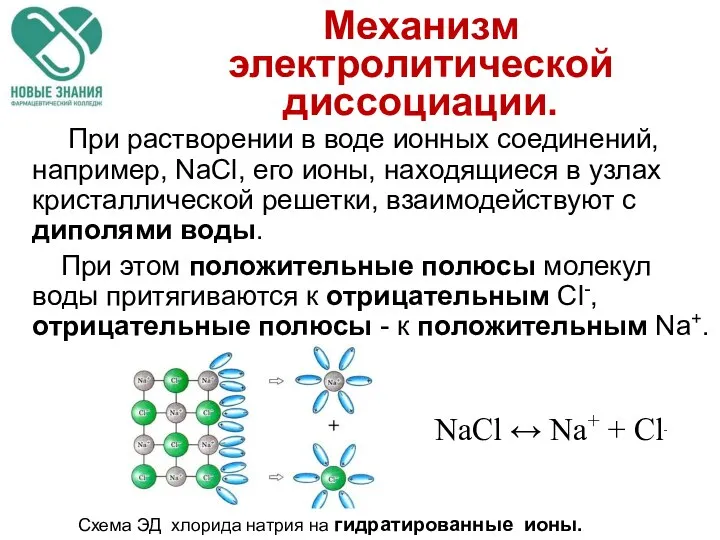
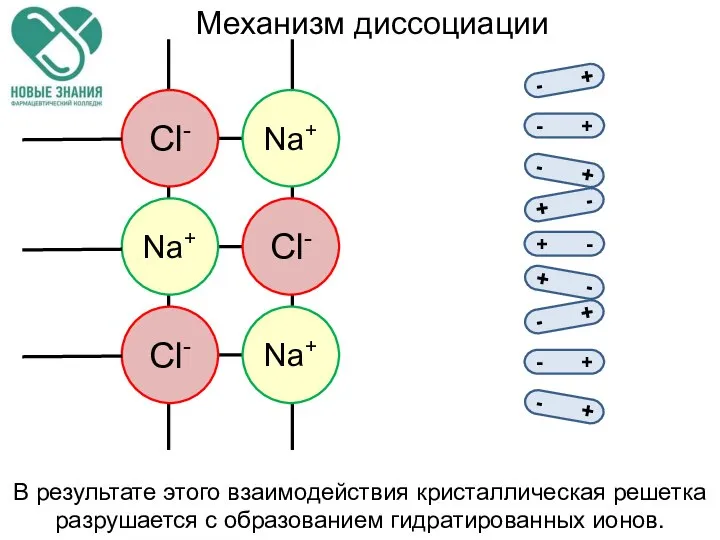
- 30. Механизм электролитической диссоциации. При растворении в воде ионных соединений, например, NaCl, его ионы, находящиеся в узлах
- 31. - + - + - + + - + - + - - + - +
- 32. Na+ Cl- - + - + + - + - + - + - - +
- 33. Степень диссоциации (ионизации) В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на
- 34. Степень диссоциации (ионизации) Степень электролитической диссоциации равна отношению числа молекул, которые распались на ионы, к общему
- 35. Степень диссоциации (ионизации) Степень диссоциации зависит от природы растворителя природы растворенного вещества. Например, молекулы серной кислоты
- 36. Сильные электролиты — это такие электролиты, для которых степень диссоциации в водных растворах равна α =1
- 37. Слабые электролиты — это такие электролиты, для которых степень диссоциации в водных растворах меньше К слабым
- 38. Диссоциация электролитов Диссоциация сильных электролитов – необратимый процесс Диссоциация слабых электролитов -обратимый процесс LiOH = Li+
- 39. Диссоциация оснований Применимo только к водным растворам!!! Основание - электролит, который диссоциирует в водном растворе с
- 40. Диссоциация кислот Применимo только к водным растворам!!! Кислота – электролит, который диссоциирует в водном растворе с
- 41. Диссоциация солей Соли - это электролиты, диссоциирующие в водном растворе на катион металла и анион кислотного
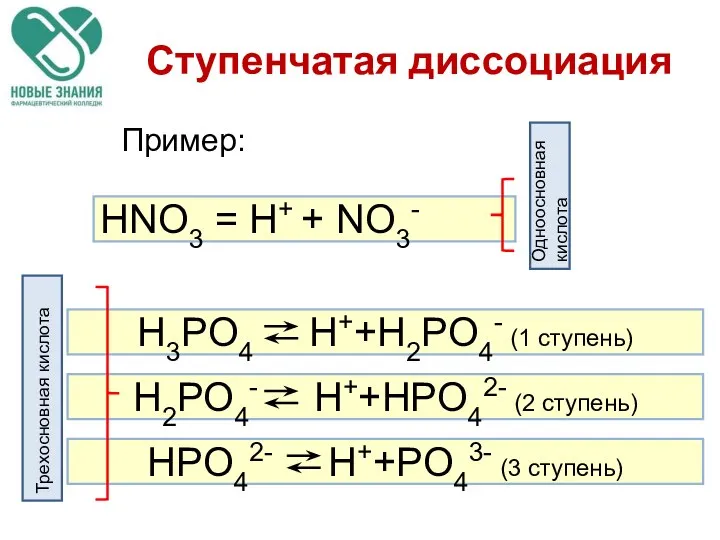
- 42. HNO3 = H+ + NO3- Ступенчатая диссоциация Пример: Одноосновная кислота Трехосновная кислота
- 43. Реакции ионного обмена - Реакции, протекающие в растворах электролитов и не сопровождающиеся изменением степеней окисления элементов.
- 44. Если образуется осадок Если выделяется газ Если образуется вода ***В остальных случаях реакции обмена являются обратимыми
- 45. Если образуется осадок: CuSO4 + 2NaOH Na2SO4 + Cu(OH)2 2AgNO3 + CaCl2 Ca(NO3)2 + 2AgCl Na2CO3
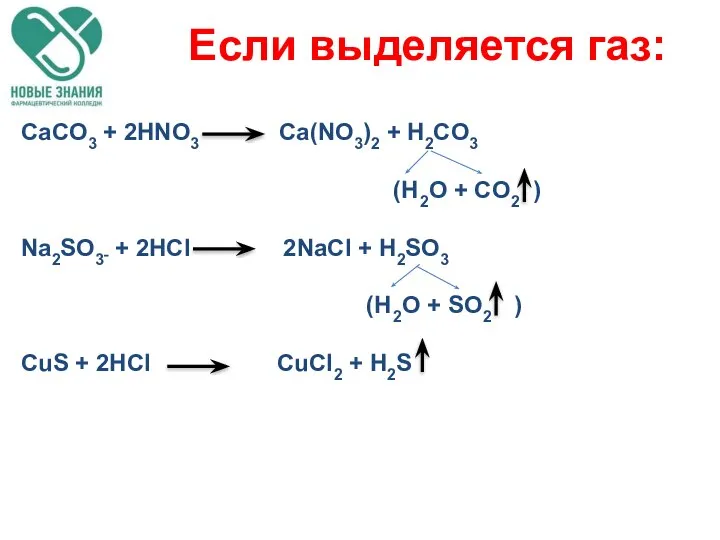
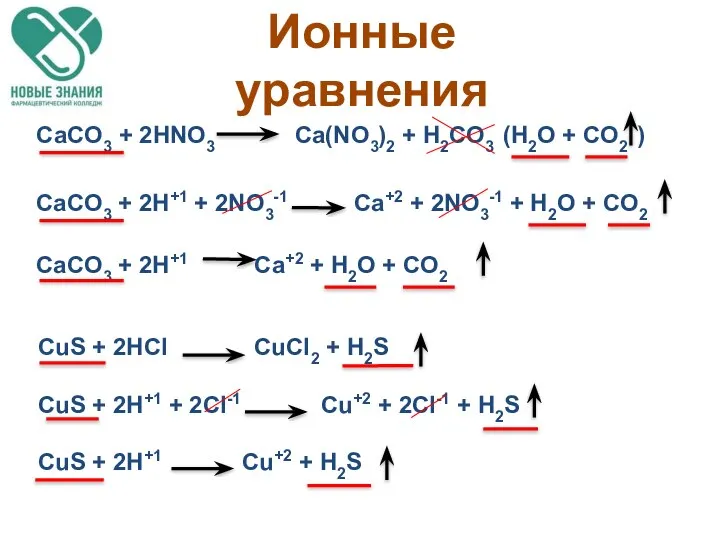
- 46. Если выделяется газ: CaCO3 + 2HNO3 Ca(NO3)2 + H2CO3 (H2O + CO2 ) Na2SO3 + 2HCl
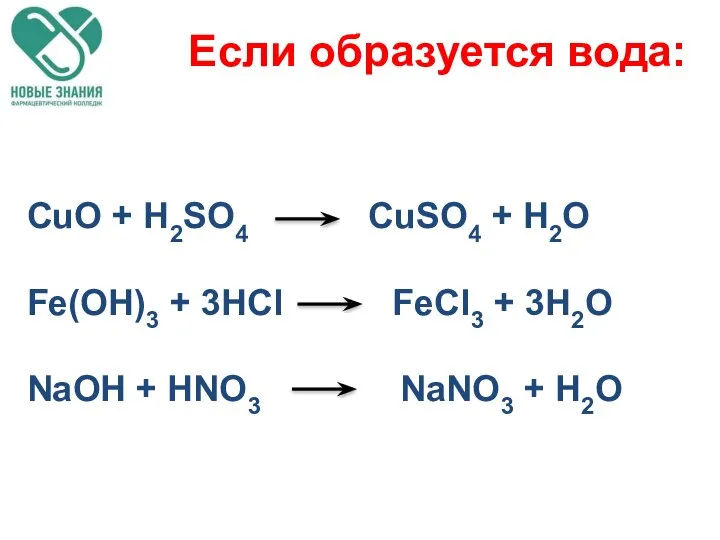
- 47. Если образуется вода: CuO + H2SO4 CuSO4 + H2O Fe(OH)3 + 3HCl FeCl3 + 3H2O NaOH
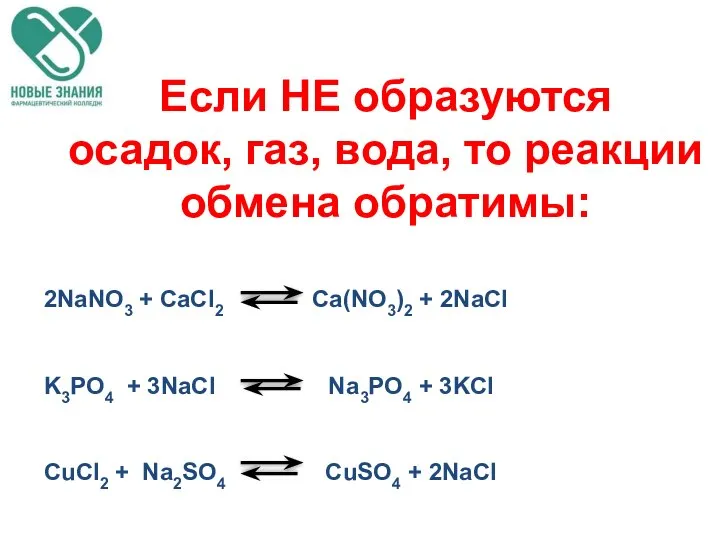
- 48. Если НЕ образуются осадок, газ, вода, то реакции обмена обратимы: 2NaNO3 + CaCl2 Ca(NO3)2 + 2NaCl
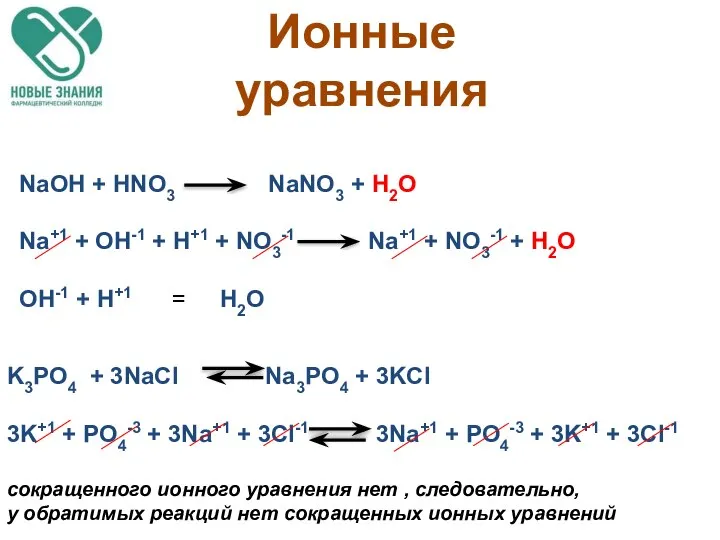
- 49. Ионные уравнения Для реакций ионного обмена составляют полные и сокращенные ионные уравнения. При этом на ионы
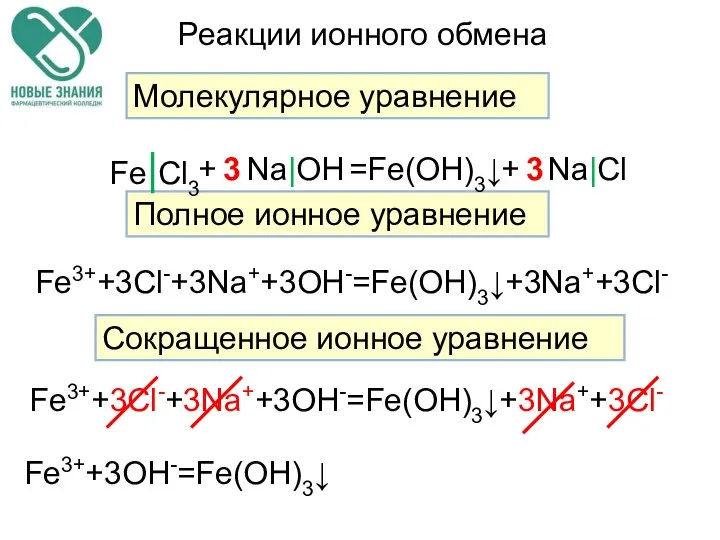
- 50. Реакции ионного обмена Молекулярное уравнение FeCl3 NaOH Fe(OH)3↓ NaCl + + = 3 3
- 51. Реакции ионного обмена Молекулярное уравнение Fe|Cl3 Na|OH Fe(OH)3↓ Na|Cl + + = 3 3
- 52. Реакции ионного обмена Молекулярное уравнение Полное ионное уравнение Сокращенное ионное уравнение Fe|Cl3 Na|OH Fe(OH)3↓ Na|Cl +
- 53. СПАСИБО ЗА ВНИМАНИЕ!
- 55. 1) Запишем молекулярное уравнение и уравняем его: CuSO4 + 2NaOH Na2SO4 + Cu(OH)2 ↓ 2) Разложим
- 56. Ионные уравнения CaCO3 + 2HNO3 Ca(NO3)2 + H2CO3 (H2O + CO2 ) CaCO3 + 2H+1 +
- 57. Ионные уравнения NaOH + HNO3 NaNO3 + H2O Na+1 + OH-1 + H+1 + NO3-1 Na+1
- 59. Примеры
- 60. Гидролиз солей При растворении солей в воде происходит не только диссоциация на ионы и гидратация этих
- 61. Гидролиз солей Гидролиз солей – это взаимодействие солей с водой В результате гидролиза соли в растворе
- 62. Гидролизу подвергаются: Катион слабого основания Al3+; Fe3+; Bi3+ и др. Анион слабой кислоты CO32-; SO32–; NO2–;
- 63. Гидролизу НЕ подвергаются: Катион сильного основания Na+; Ca2+; K+ и др. Анион сильной кислоты Cl–; SO42–;
- 64. Закономерности гидролиза разбавленных растворов солей: Протекает: Гидролиз соли слабого основания и сильной кислоты Гидролиз соли слабой
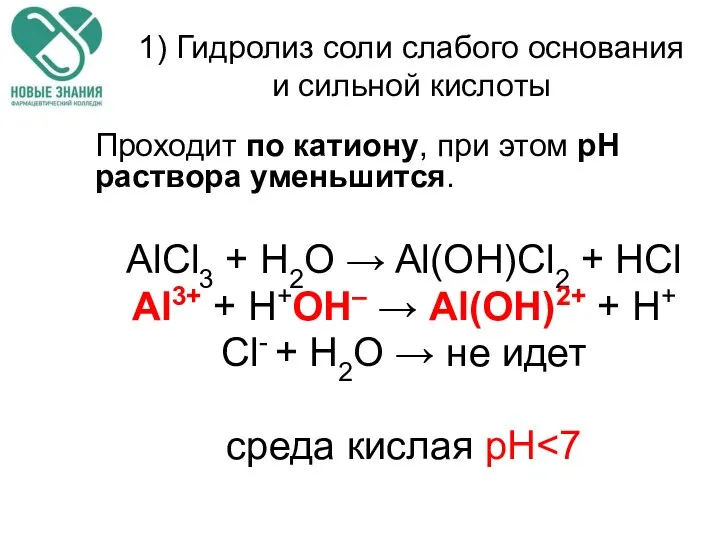
- 65. 1) Гидролиз соли слабого основания и сильной кислоты Проходит по катиону, при этом рН раствора уменьшится.
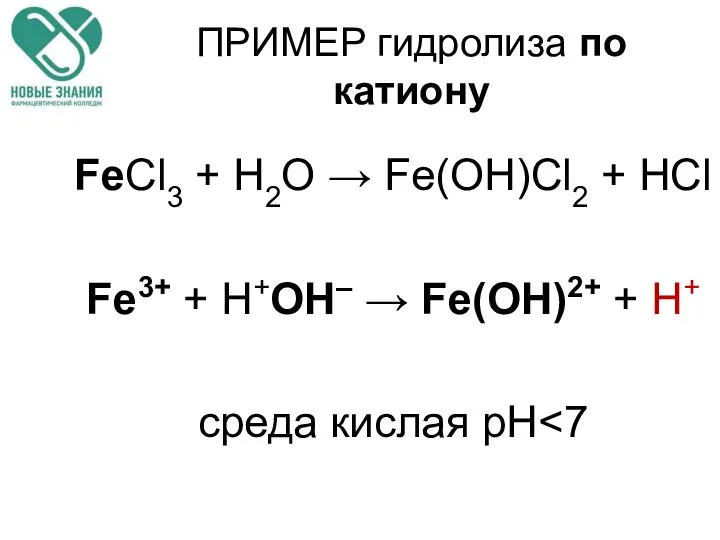
- 66. ПРИМЕР гидролиза по катиону FeCl3 + H2O → Fe(OH)Cl2 + HCl Fe3+ + Н+ОН– → Fe(OH)2+
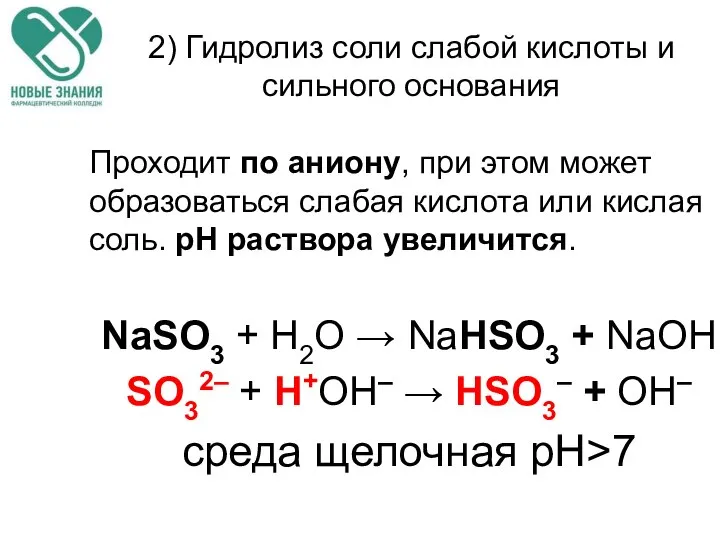
- 67. 2) Гидролиз соли слабой кислоты и сильного основания Проходит по аниону, при этом может образоваться слабая
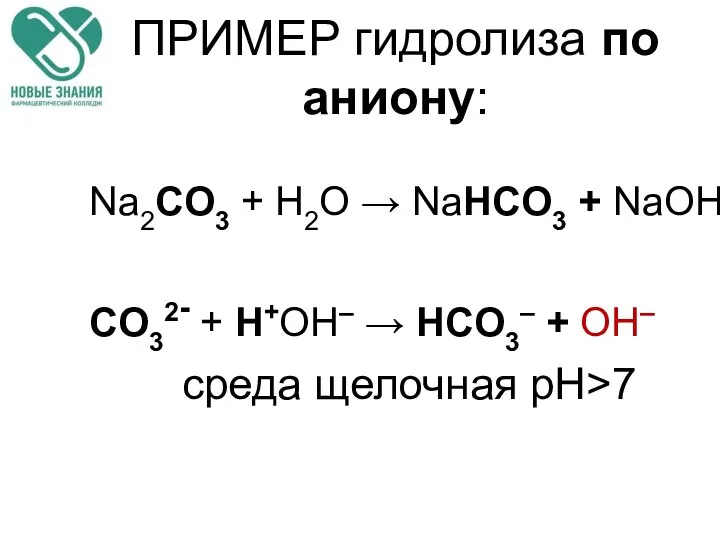
- 68. ПРИМЕР гидролиза по аниону: Na2CO3 + H2O → NaHCO3 + NaОН CO32- + Н+ОН– → HCO3–
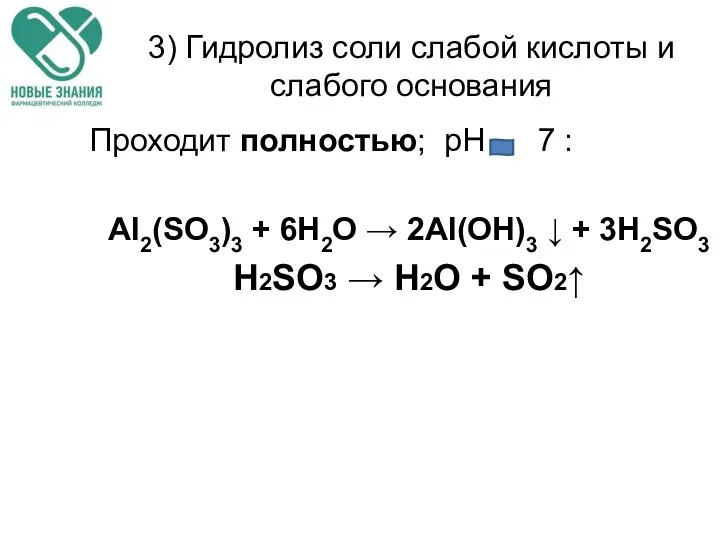
- 69. 3) Гидролиз соли слабой кислоты и слабого основания Проходит полностью; рН 7 : Al2(SO3)3 + 6H2O
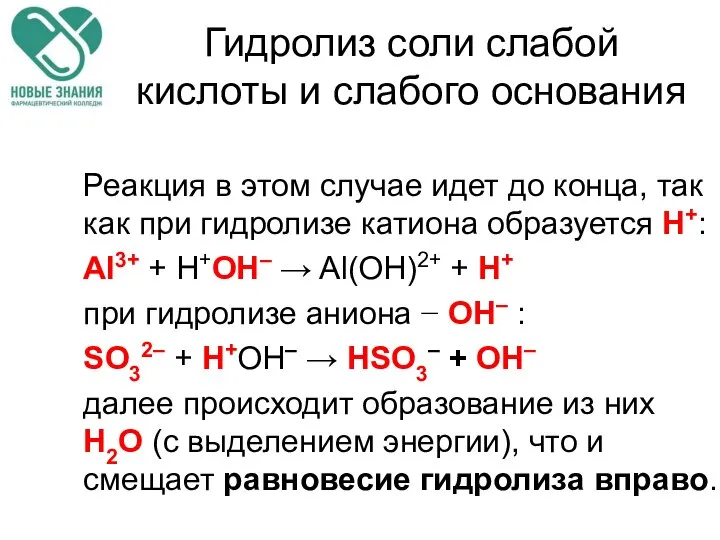
- 70. Гидролиз соли слабой кислоты и слабого основания Реакция в этом случае идет до конца, так как
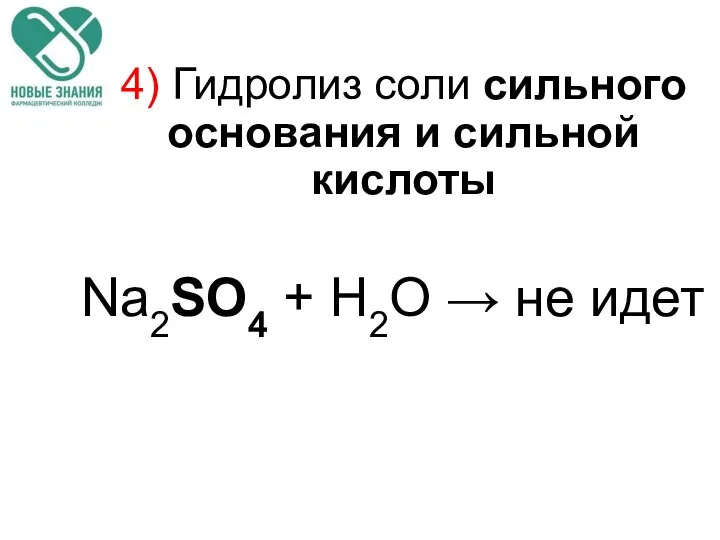
- 71. 4) Гидролиз соли сильного основания и сильной кислоты Na2SO4 + H2O → не идет
- 72. Количественные характеристики гидролиза Степень гидролиза αг (доля гидролизованных единиц) Константа гидролиза - Кг.
- 74. Скачать презентацию
















































 Физические свойства минералов
Физические свойства минералов Дифузія у побуті
Дифузія у побуті Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии
Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии  Скорость химических реакций Разработка урока по химии 11 класс
Скорость химических реакций Разработка урока по химии 11 класс Физико – химические характеристики электротехнических материалов
Физико – химические характеристики электротехнических материалов Сера и её соединения
Сера и её соединения Кислородсодержащие. Углеводы. Подготовка к ЕГЭ
Кислородсодержащие. Углеводы. Подготовка к ЕГЭ Реакции ионного обмена
Реакции ионного обмена Презентация по Химии "Особенности металла" - скачать смотреть
Презентация по Химии "Особенности металла" - скачать смотреть  Группа нефелиновых сиенитов-фонолитов
Группа нефелиновых сиенитов-фонолитов Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома. Цели урока: Обобщение и углубление знания о стро
Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома. Цели урока: Обобщение и углубление знания о стро Наука химия. Роль химии в промышленности
Наука химия. Роль химии в промышленности Соединения терпеноидной структуры. Тема № 3
Соединения терпеноидной структуры. Тема № 3 Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Биоэнергетика. Часть первая
Биоэнергетика. Часть первая ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна
ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна  The law of mass conservation
The law of mass conservation Предпрофильный курс Мир химии
Предпрофильный курс Мир химии Металлы. Общая характеристика
Металлы. Общая характеристика Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения
Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения Основы общей химии
Основы общей химии Підготувала Учениця 11 класу Лемак Андріана
Підготувала Учениця 11 класу Лемак Андріана  Ионообменная хроматография и ее применение
Ионообменная хроматография и ее применение Агрохимия растений
Агрохимия растений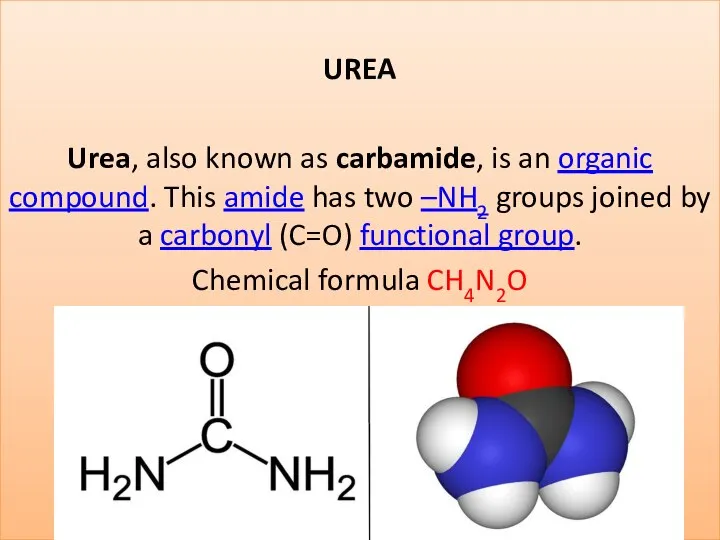 Urea (carbamide)
Urea (carbamide) Химия в строительстве
Химия в строительстве ИК-спектроскопия органических соединений
ИК-спектроскопия органических соединений Физико-химические методы исследования и техника лабораторных работ
Физико-химические методы исследования и техника лабораторных работ