Содержание
- 2. I. НОМЕНКЛАТУРА И ИЗОМЕРИЯ рациональная систематическая номенклатура номенклатура СН ≡ НС ацетилен этин СН3 – С
- 3. II.СПОСОБЫ ПОЛУЧЕНИЯ АЛКИНОВ 1. Промышленные способы получения ацетилена 1) из карбида кальция: t CaCO3 CaO +
- 5. 2. Лабораторные способы получения 1) получение из дигалогенопроизводных углеводородов: Cl | NaOH(спирт.р-р) NaNH2 CH3 – CH
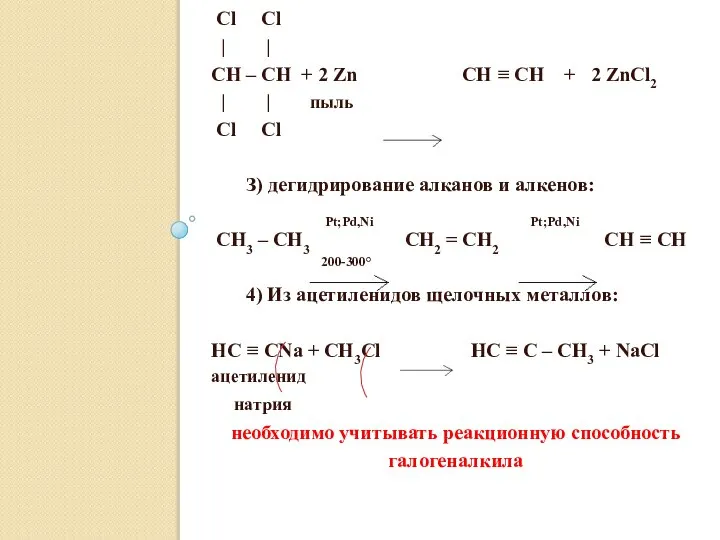
- 6. 2) из тетрагалогенидов: Cl Cl | | CH – CH + 2 Zn CH ≡ CH
- 7. Реакционная способность: CH3 | CH3Hal > CH3 – CH2 > CH3 – CH – CH3 >
- 8. В случае вторичного галогеналкила: HC ≡ CNa + CH3 – CH – CH3 HC ≡ C
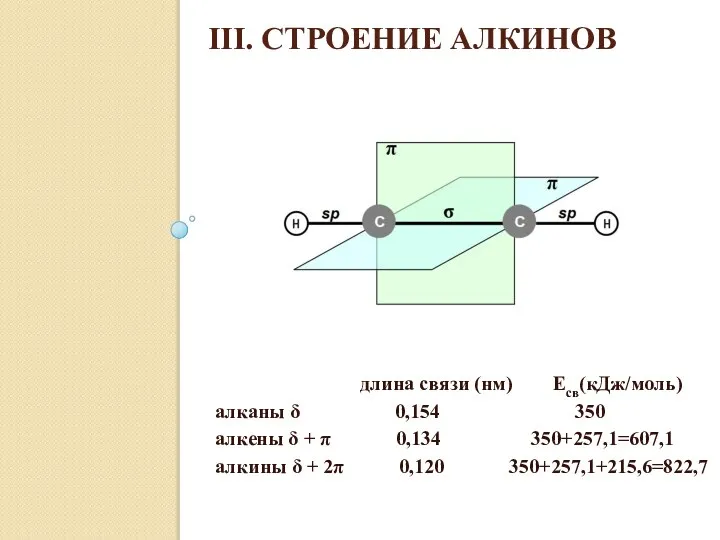
- 9. III. СТРОЕНИЕ АЛКИНОВ длина связи (нм) Есв(кДж/моль) алканы δ 0,154 350 алкены δ + π 0,134
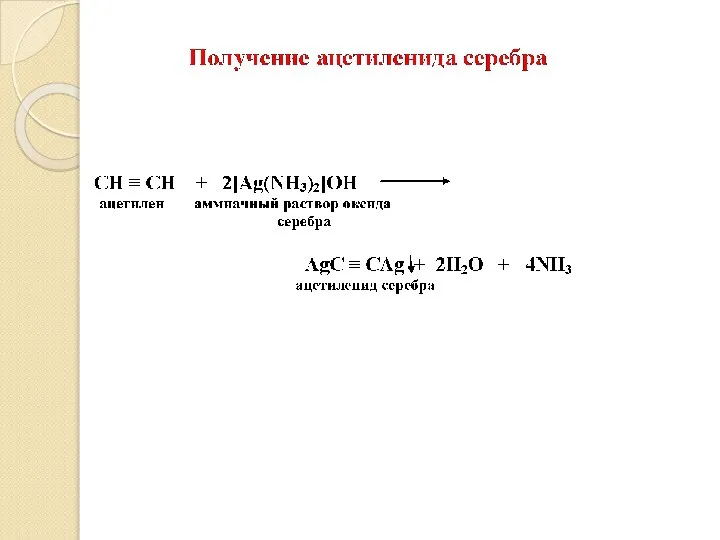
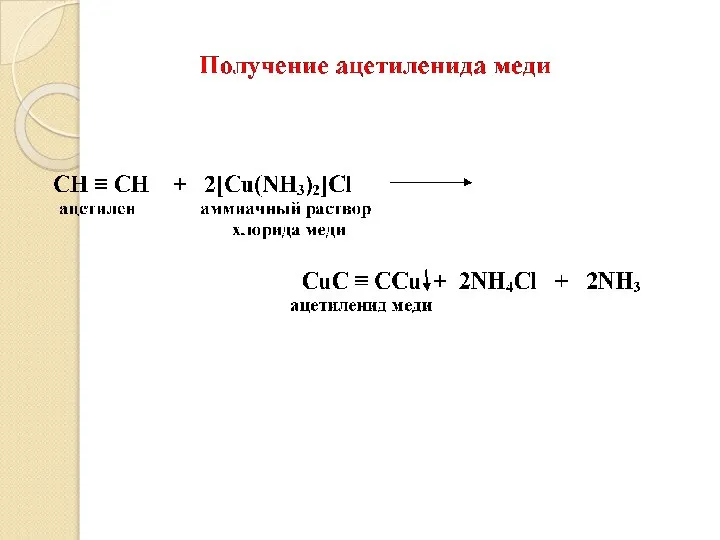
- 10. IV. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ 1. Кислотные свойства (получение ацетиленидов щелочных и тяжелых металлов): HC ≡ CH
- 17. 2. Реакции электрофильного присоединения 1) гидрирование или реакции восстановления: Pt;Pd,Ni + H2 HC ≡ CH +
- 18. 2)реакции галогенирования: H Br Br Br \ / | | HC ≡ CH + Br2 C
- 22. 3) реакции гидрогалогенирования: HC ≡ CH + HCl CH2 = CH | Cl CH3 – C
- 23. 3. Реакции нуклеофильного присоединения: 1) реакции гидратации (реакция Кучерова): HgSO4 HC ≡ CH + H2O CH2
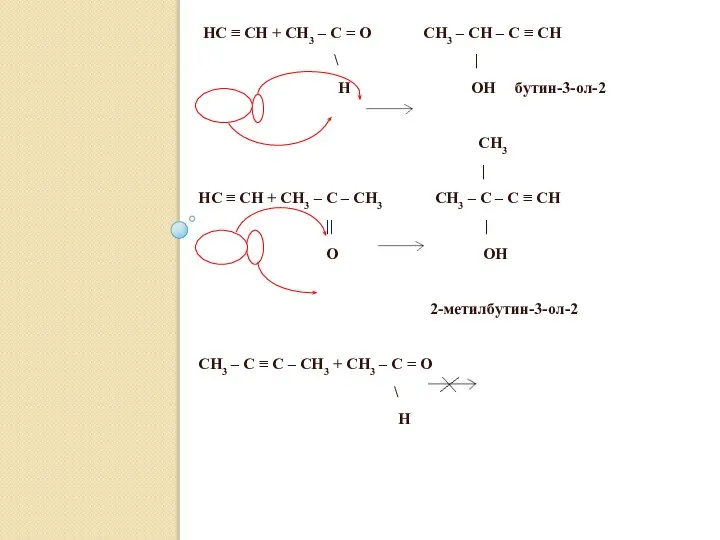
- 24. 2) реакции со спиртом: +H+ CH3 – C ≡ CH + (C2H5O)-H+ CH3 – C =
- 25. 4. Реакции конденсации с карбонильными соединениями (альдегидами и кетонами): HC ≡ CH + CH3 – C
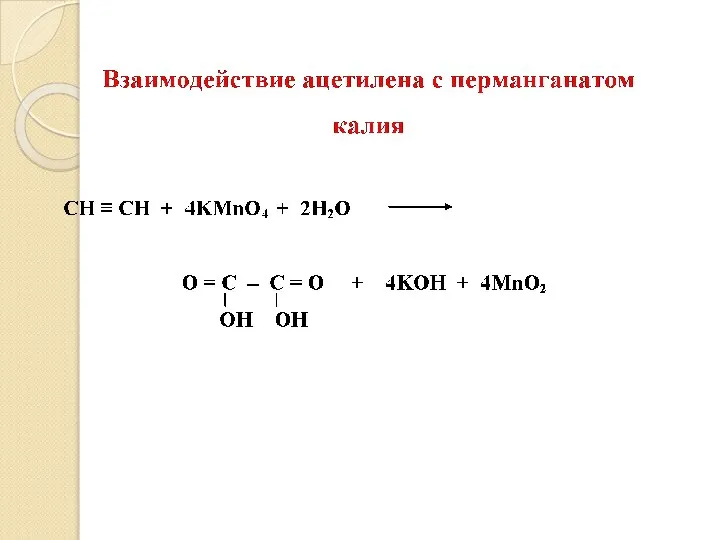
- 26. 5. Реакции окисления: Если имеется концевая тройная связь, то в результате реакции образуется CO2. [O] CH3
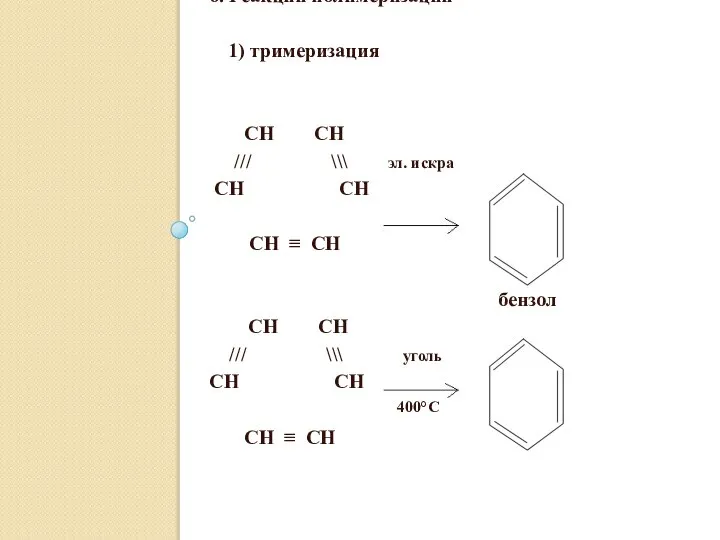
- 32. 6. Реакции полимеризации 1) тримеризация CH СН /// \\\ эл. искра СН CH СН ≡ CH
- 34. Скачать презентацию
























 Дисперсные системы
Дисперсные системы Чистые вещества и смеси
Чистые вещества и смеси Презентация по Химии "Мыло. Синтетические моющие средства" - скачать смотреть
Презентация по Химии "Мыло. Синтетические моющие средства" - скачать смотреть  Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей
Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей  Геохимия агроландшафтов
Геохимия агроландшафтов Презентация по Химии "Вплив побутової хімії на здоров'я людини" - скачать смотреть бесплатно
Презентация по Химии "Вплив побутової хімії на здоров'я людини" - скачать смотреть бесплатно Органічні та біологічні молекули
Органічні та біологічні молекули Майда еритін витаминдер. А,D,E,K витаминдері
Майда еритін витаминдер. А,D,E,K витаминдері Гетероциклические соединения
Гетероциклические соединения Устный журнал «Мы в мире химии» № 1- 2006 Тема: «Пища, которую мы едим». Девиз: «Химики это те, кто действительно понимает мир!. Л.Поли
Устный журнал «Мы в мире химии» № 1- 2006 Тема: «Пища, которую мы едим». Девиз: «Химики это те, кто действительно понимает мир!. Л.Поли Гліцерин (Гліцерол)
Гліцерин (Гліцерол) Гетероциклические соединения. Синтетические пиретроиды
Гетероциклические соединения. Синтетические пиретроиды ГАЛОГЕНЫ
ГАЛОГЕНЫ БИОЛОГИЧЕСКИ АКТИВНЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ ВЕЩЕСТВА
БИОЛОГИЧЕСКИ АКТИВНЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ ВЕЩЕСТВА  Комплексные соединения
Комплексные соединения углерод и его свойства
углерод и его свойства Строение электронных оболочек атомов
Строение электронных оболочек атомов Разработка и исследование системы управления процессом осушки бутанола при производстве н -бутилового спирта
Разработка и исследование системы управления процессом осушки бутанола при производстве н -бутилового спирта Презентация по Химии "Хлор" - скачать смотреть
Презентация по Химии "Хлор" - скачать смотреть  Электроосмос. Практическое применение электроосмоса
Электроосмос. Практическое применение электроосмоса Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Металлы. Из истории металлов
Металлы. Из истории металлов Агрегатные состояния вещества
Агрегатные состояния вещества История мыла
История мыла  Органічні сполуки, як компоненти їжі
Органічні сполуки, як компоненти їжі  Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Свойства воды
Свойства воды Полимеры в нашей жизни (10 класс)
Полимеры в нашей жизни (10 класс)