Содержание
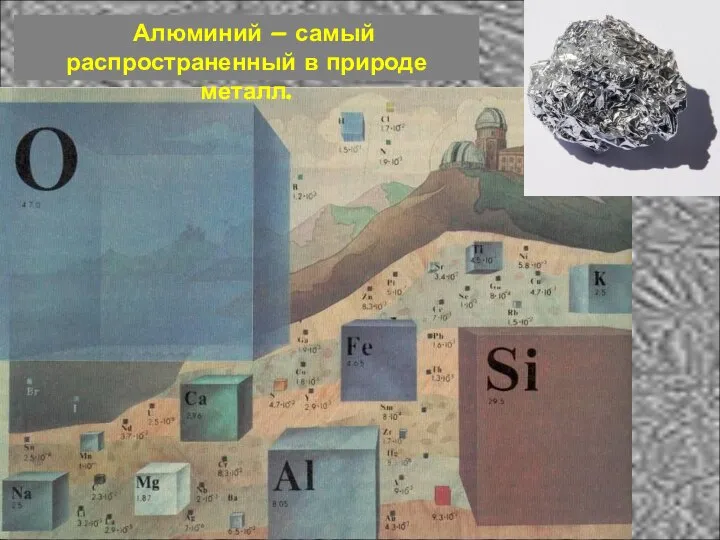
- 2. Алюминий – самый распространенный в природе металл.
- 3. Важнейшим на сегодня минералом алюминия является боксит Основной химический компонент боксита - глинозем (Al2O3) (28 -
- 4. AL2O3 Корунд сапфир рубин Боксит Глинозём
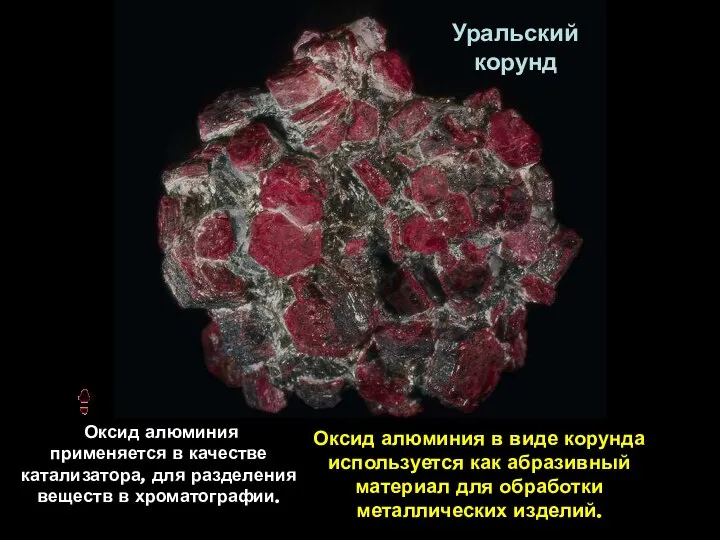
- 5. Уральский корунд Оксид алюминия в виде корунда используется как абразивный материал для обработки металлических изделий. Оксид
- 6. Применение сапфиров знаменитые сапфиры английской королевской семьи
- 7. Применение рубинов
- 8. Рубины и сапфиры в наше время получают искусственным путем в промышленных масштабах. Оксид алюминия в виде
- 9. Алюминий входит в состав глин, полевых шпатов, слюд. Важнейший минерал алюминия – боксит содержит 28-60% глинозёма
- 10. Алюминий ( лат. Aluminium название образовано от лат. «Aluminis» – квасцы)- химический элемент третьей группы периодической
- 11. Составьте схему строения атома алюминия. Определите какая степень окисления характерна для алюминия в соединениях? Какие свойства
- 12. Алюминий – серебристый металл, его плотность – 2,7 г/ см3, tпл = 660 0C, tкип =
- 14. Будучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества, если изобрести способ
- 15. Поль Эру (1863-1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне
- 16. химические свойства : I. Реакции с простыми веществами:
- 18. б) с серой, образуя сульфид алюминия: Al + S = …. в) с азотом, образуя нитрид
- 19. 1. с водой (после удаления защитной оксидной пленки) Al + H2O = ….. 2. с растворами
- 20. III. Соединения алюминия Соединения алюминия Оксид алюминия (AL2O3) Гидроксид алюминия AL(OH)3
- 21. Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами Реагирует с щелочами AL2O3 + 6HCL=2ALCL3 +
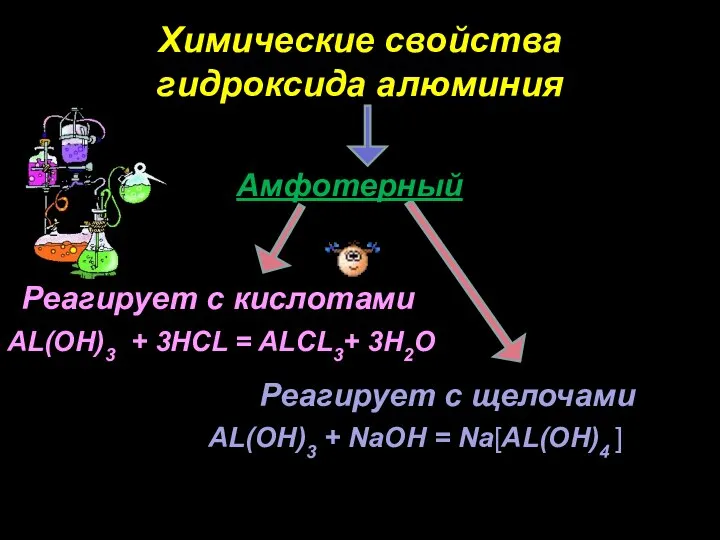
- 22. Гидроксид алюминия AL(OH)3
- 23. Реагирует с кислотами Реагирует с щелочами AL(OH)3 + 3HCL = ALCL3+ 3H2O AL(OH)3 + NaOH =
- 24. Закончите уравнения реакций и запишите их в ионном виде: AL2O3+ NaOH + H2O = Na[AL(OH)4] Al2O3
- 25. Применение алюминия и его соединений
- 27. Скачать презентацию





















 Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой
Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой Автомобильные бензины и дизельные топлива. Характеристика и классификация автомобильных топлив
Автомобильные бензины и дизельные топлива. Характеристика и классификация автомобильных топлив Сырьё для получения фенолальдегидных полимеров
Сырьё для получения фенолальдегидных полимеров Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1)
Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1) Химия. 6я группа элементов. 9 класс
Химия. 6я группа элементов. 9 класс Капиллярлық құбылыстардың дамуына үлес қосқан ғалымдар
Капиллярлық құбылыстардың дамуына үлес қосқан ғалымдар Критерии оценки качества природного газа
Критерии оценки качества природного газа Относительная атомная и относительная молекулярная масса
Относительная атомная и относительная молекулярная масса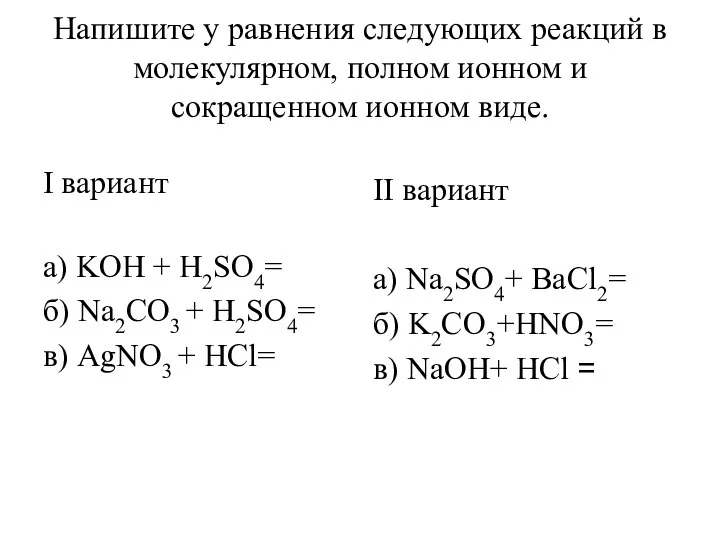 Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде
Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде Тотығу дәрежесі. Тотығу-тотықсыздану реакция теңдеулері
Тотығу дәрежесі. Тотығу-тотықсыздану реакция теңдеулері Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП
Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Методы очистки нефтяных фракций
Методы очистки нефтяных фракций Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Кислоты вокруг нас
Кислоты вокруг нас Общая фармакопейная статья
Общая фармакопейная статья Происхождение химических элементов
Происхождение химических элементов Выполнил: ученик 10 «А» класса МБОУ «СОШ № 28» Леньшин Максим Набережные Челны 2013г.
Выполнил: ученик 10 «А» класса МБОУ «СОШ № 28» Леньшин Максим Набережные Челны 2013г. Проблемное обучение на уроках химии
Проблемное обучение на уроках химии Производство метанола и этанола
Производство метанола и этанола Презентация по Химии "Железо" - скачать смотреть
Презентация по Химии "Железо" - скачать смотреть  Дисперсные системы. Лиофобные дисперсные системы (часть 2)
Дисперсные системы. Лиофобные дисперсные системы (часть 2) Дисахариды Ширяева София ХБ-4 г.Липецк 2012
Дисахариды Ширяева София ХБ-4 г.Липецк 2012 Природный газ
Природный газ Пятичленные гетероциклические соединения. Профильный уровень
Пятичленные гетероциклические соединения. Профильный уровень Сероводородная кислота
Сероводородная кислота Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Сульфатна кислота. Фізичні та хімічні властивості сульфатної кислоти
Сульфатна кислота. Фізичні та хімічні властивості сульфатної кислоти