Содержание
- 2. Цель: Получить представление о взаимосвязи химического строения и биологической роли аминокислот, пептидов и белков
- 3. План лекции 1. Медико-биологическое значение аминокислот, пептидов и белков; 2. Строение, классификация аминокислот 3. Стереоизомерия α-аминокислот
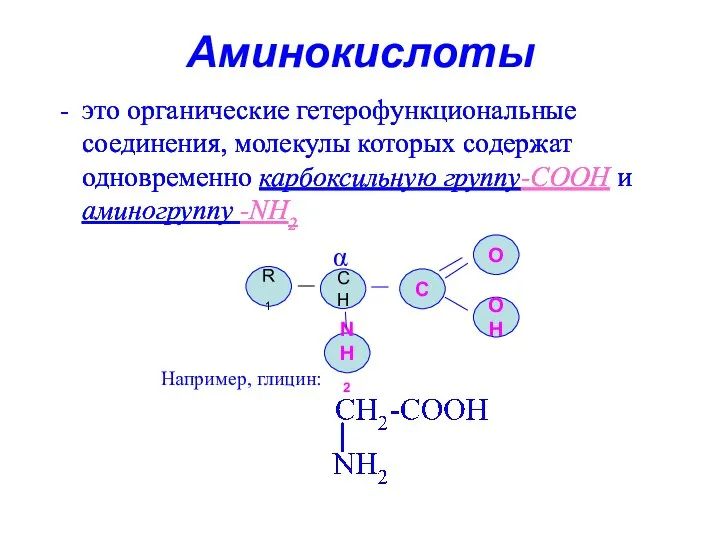
- 4. Аминокислоты это органические гетерофункциональные соединения, молекулы которых содержат одновременно карбоксильную группу-СООН и аминогруппу -NН2 NH2 СH
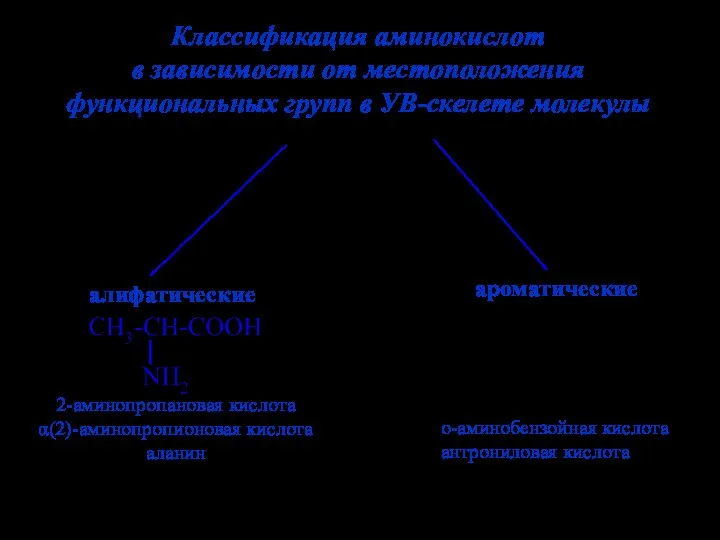
- 5. Классификация аминокислот в зависимости от местоположения функциональных групп в УВ-скелете молекулы алифатические ароматические 2-аминопропановая кислота α(2)-аминопропионовая
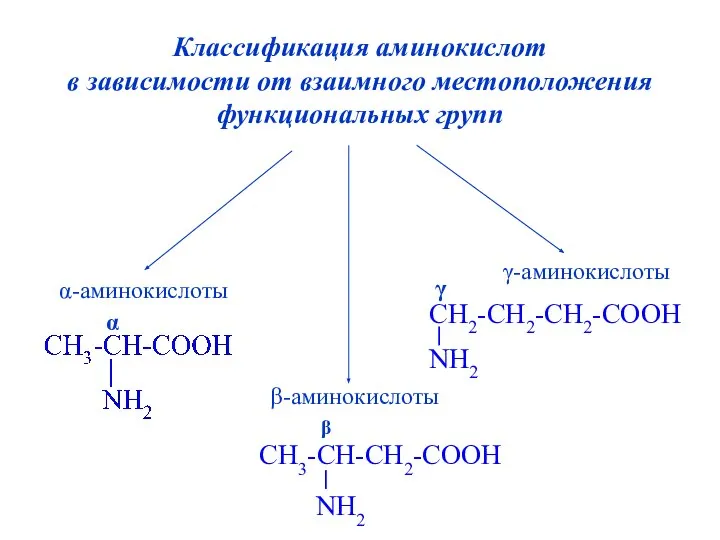
- 6. Классификация аминокислот в зависимости от взаимного местоположения функциональных групп α-аминокислоты γ-аминокислоты β-аминокислоты α CH3-CH-CH2-COOH NH2 β
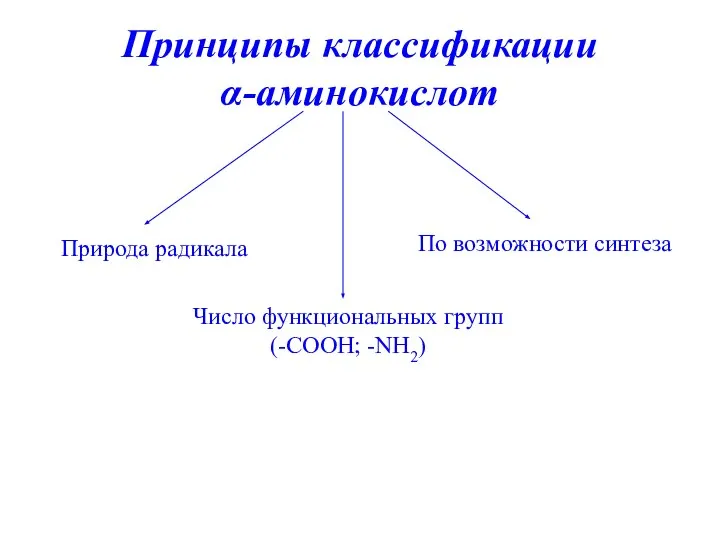
- 7. Принципы классификации α-аминокислот Природа радикала Число функциональных групп (-СООН; -NH2) По возможности синтеза
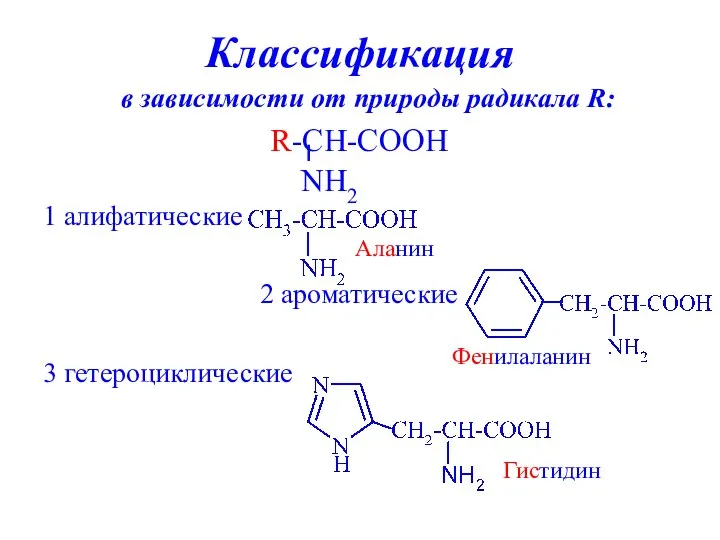
- 8. Классификация в зависимости от природы радикала R: 1 алифатические 2 ароматические 3 гетероциклические Аланин Фенилаланин Гистидин
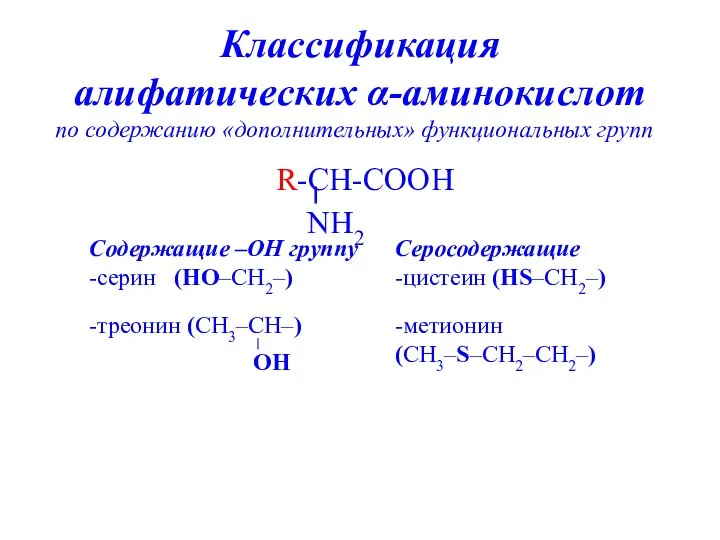
- 9. Классификация алифатических α-аминокислот по содержанию «дополнительных» функциональных групп Содержащие –ОН группу -серин (НО–СН2–) -треонин (СН3–СН–) Серосодержащие
- 10. Классификация в зависимости от числа карбоксильных и аминогрупп - Нейтральные – одна NH2 и одна СООН
- 11. Классификация α-аминокислот по возможности синтеза Заменимые Незаменимые синтезируются в организме не синтезируются в организме -валин -лейцин
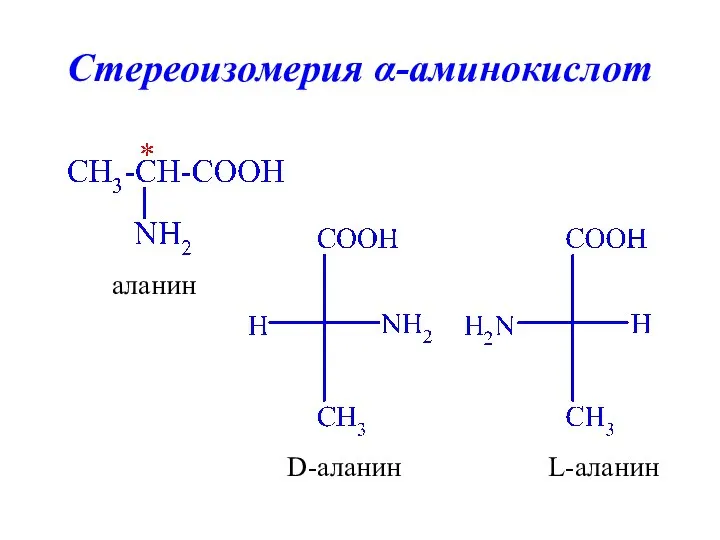
- 12. Стереоизомерия α-аминокислот аланин L-аланин D-аланин
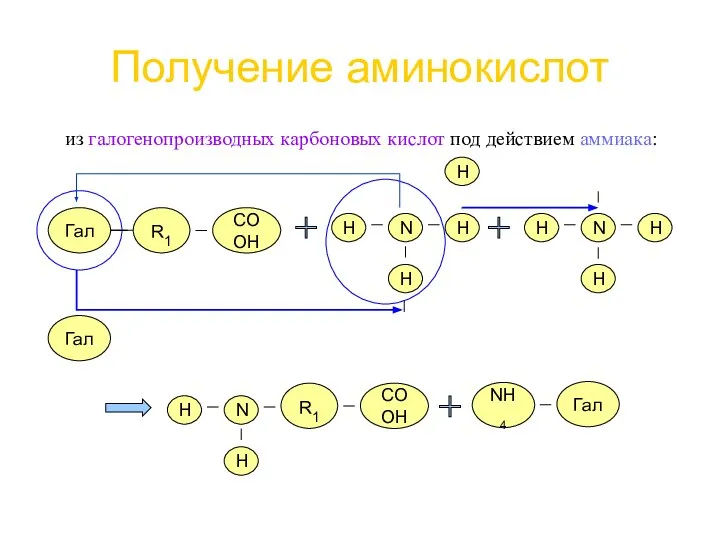
- 13. Получение аминокислот из галогенопроизводных карбоновых кислот под действием аммиака: R1 Гал COOH H N H H
- 14. Физические свойства Аминокислоты: бесцветные кристаллические вещества сладкие на вкус хорошо растворяются в воде имеют температуру плавления
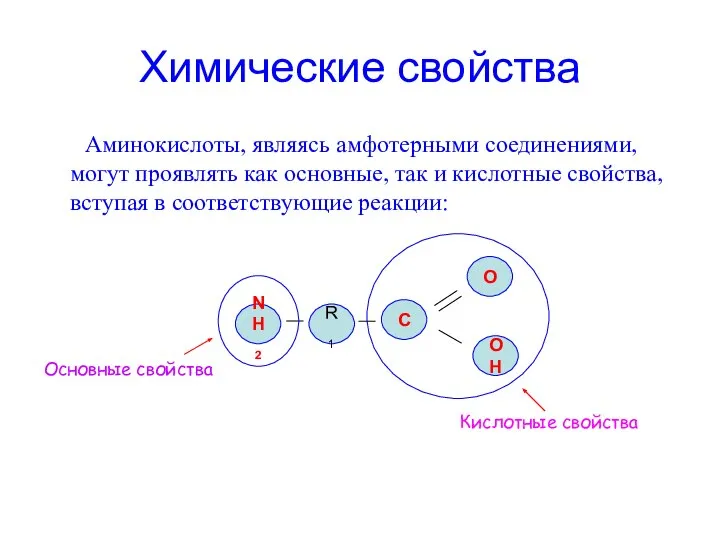
- 15. Химические свойства Аминокислоты, являясь амфотерными соединениями, могут проявлять как основные, так и кислотные свойства, вступая в
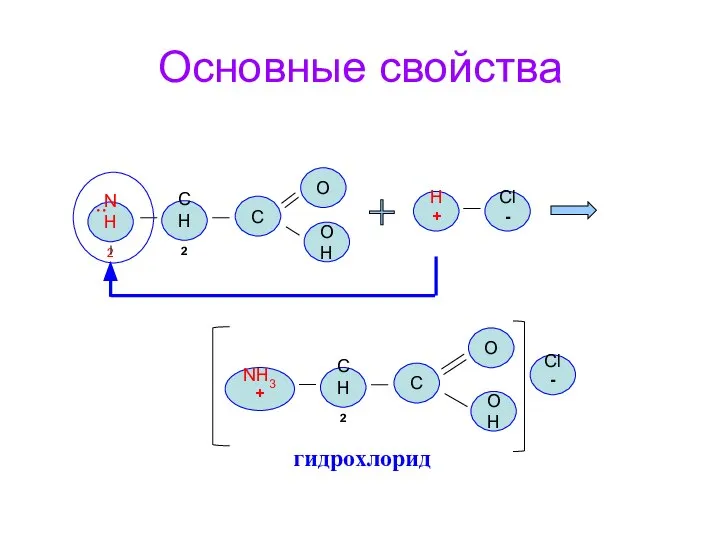
- 16. Основные свойства NH2 CH2 О OH C NH3+ CH2 О OH C H+ Cl- Cl- ..
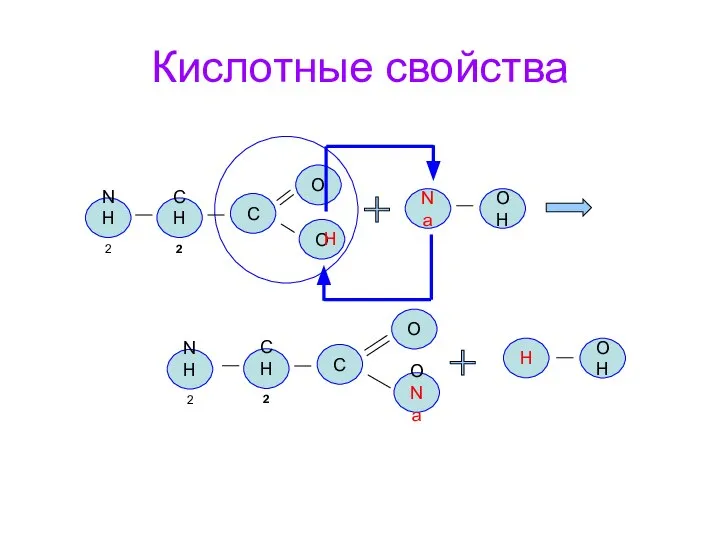
- 17. Кислотные свойства NH2 CH2 O O C CH2 О ONa C Na OH H OH H
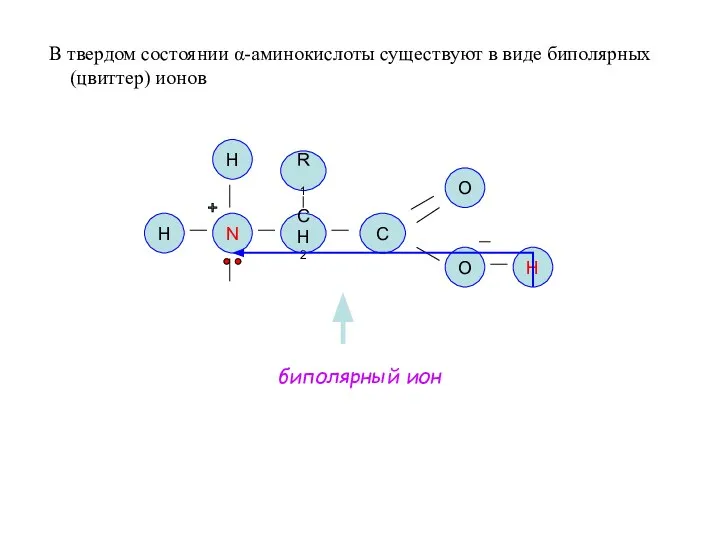
- 18. В твердом состоянии α-аминокислоты существуют в виде биполярных (цвиттер) ионов N СН2 C O O H
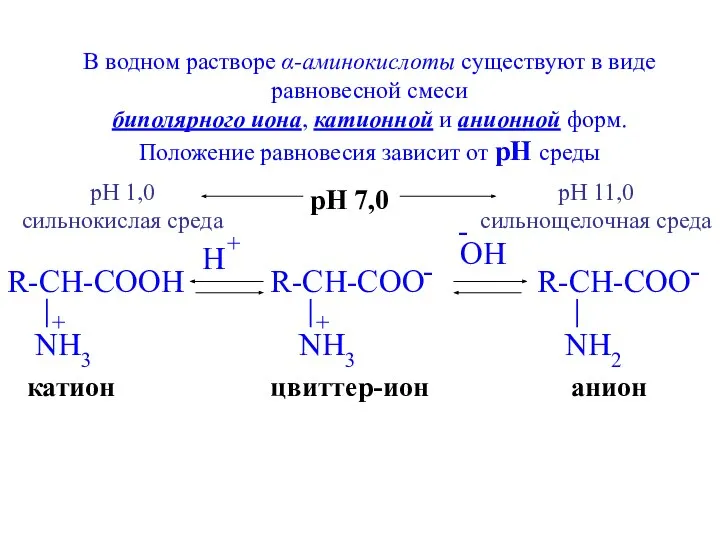
- 19. цвиттер-ион анион катион В водном растворе α-аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и
- 20. Изоэлектрическая точка α-аминокислоты – это то значение pH раствора, при котором большинство молекул существуют в виде
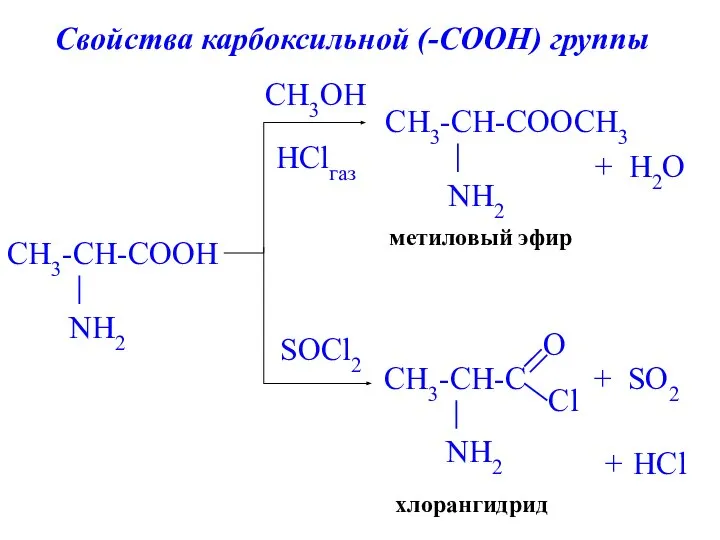
- 21. метиловый эфир + H2O HClгаз хлорангидрид + CH3OH SOCl2 SO2 + HCl Свойства карбоксильной (-СООН) группы
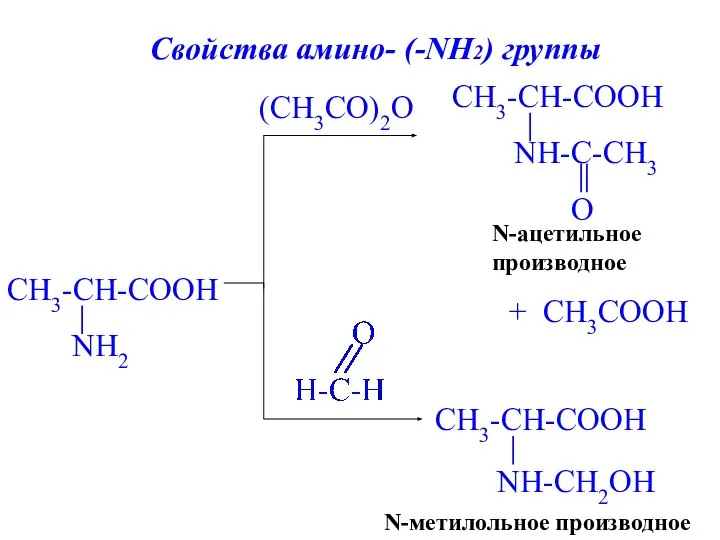
- 22. (CH3СO)2O N-метилольное производное + CH3COOH N-ацетильное производное Свойства амино- (-NH2) группы
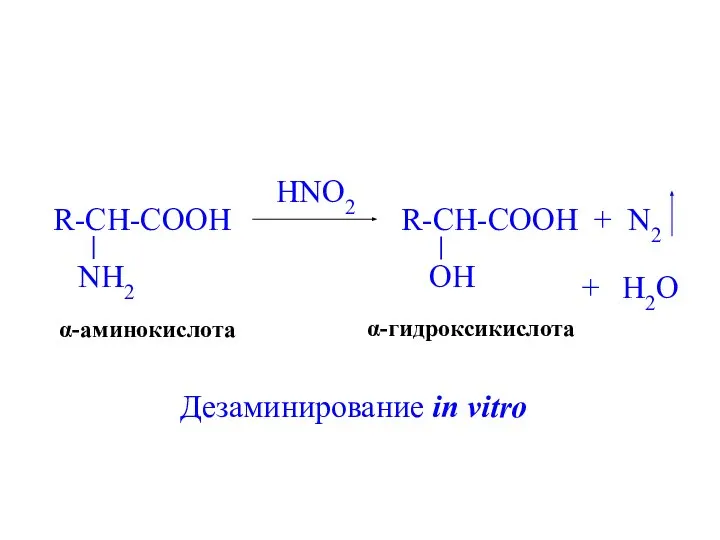
- 23. HNO2 + N2 + H2O α-аминокислота α-гидроксикислота Дезаминирование in vitro
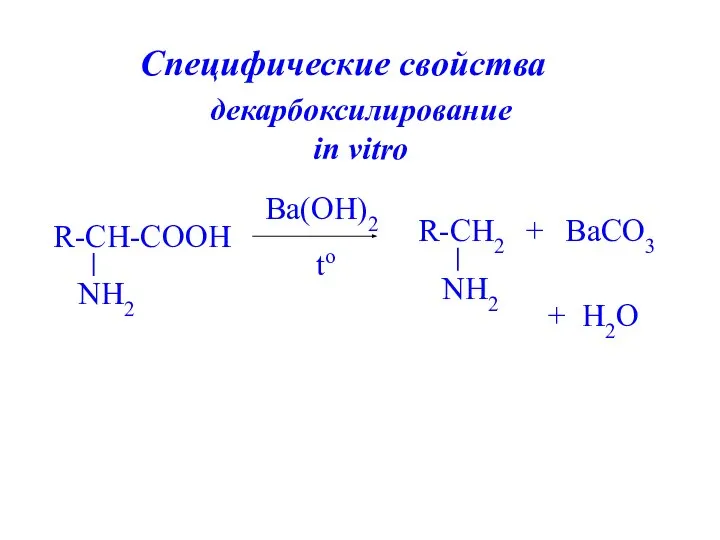
- 24. декарбоксилирование in vitro Ba(OH)2 to + BaCO3 + H2O Специфические свойства
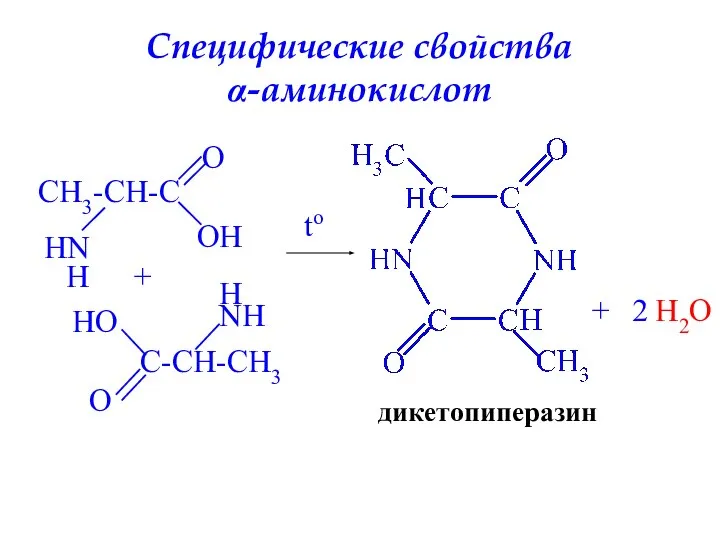
- 25. Специфические свойства α-аминокислот CH3-CH-C HN H O O H C-CH-CH3 O H O NH H +
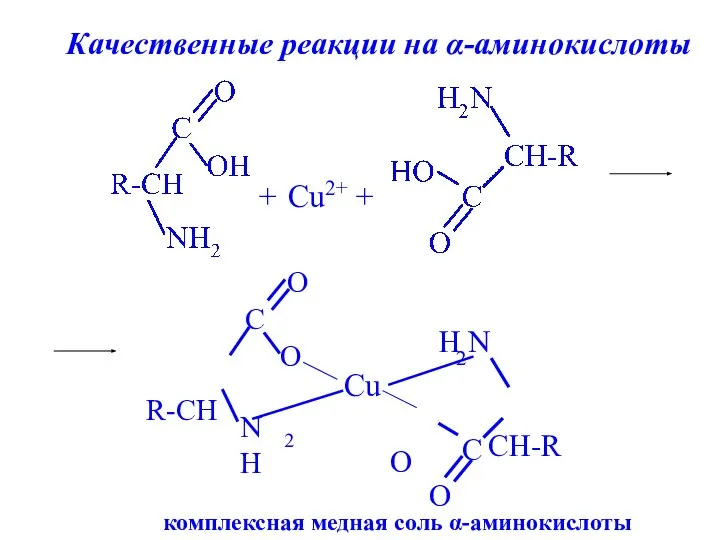
- 26. + Cu2+ + комплексная медная соль α-аминокислоты Качественные реакции на α-аминокислоты
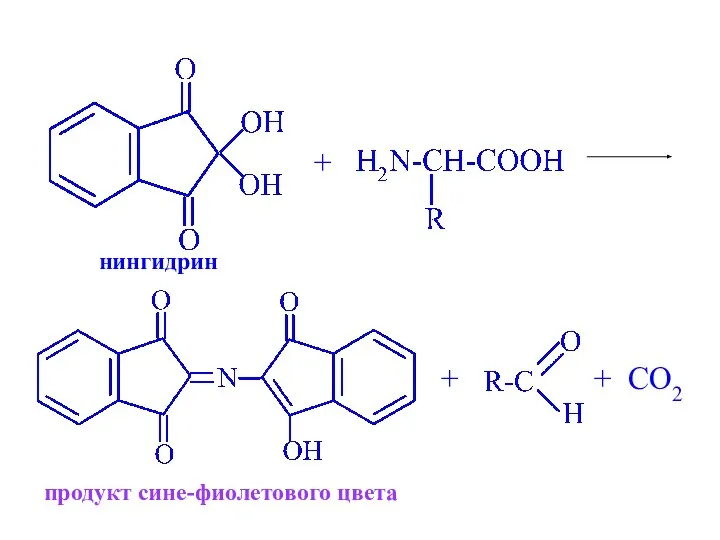
- 27. + + + CO2 нингидрин продукт сине-фиолетового цвета
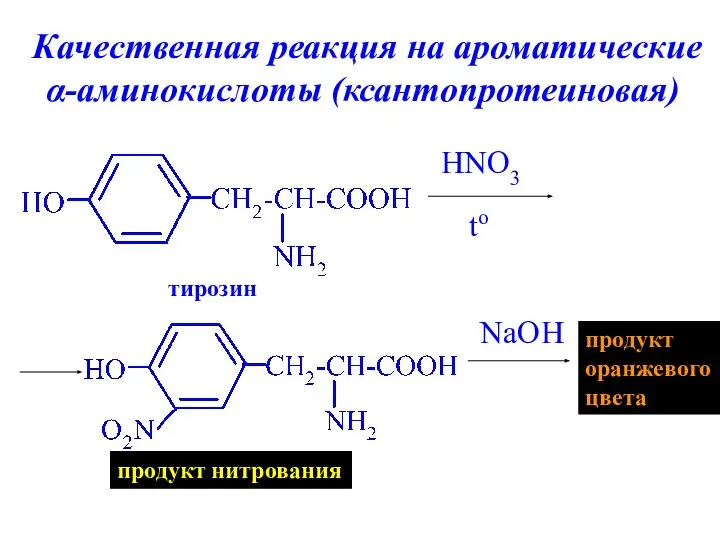
- 28. Качественная реакция на ароматические α-аминокислоты (ксантопротеиновая) HNO3 to NaOH тирозин продукт нитрования продукт оранжевого цвета
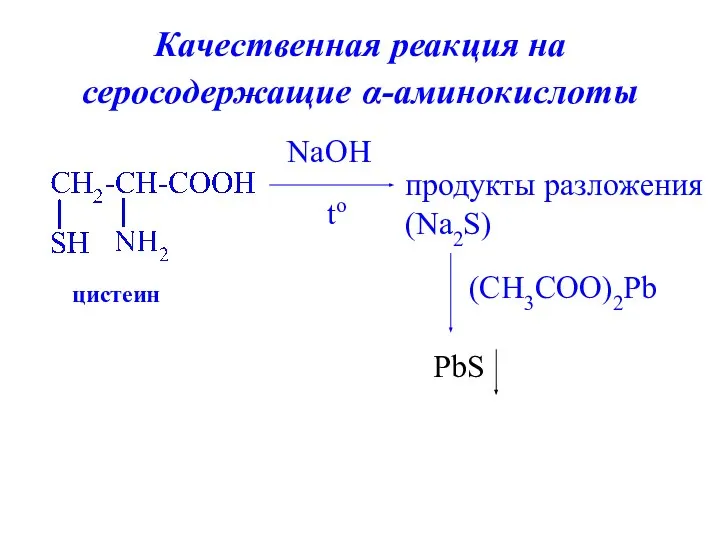
- 29. Качественная реакция на серосодержащие α-аминокислоты цистеин NaOH to продукты разложения (Na2S) (CH3COO)2Pb PbS
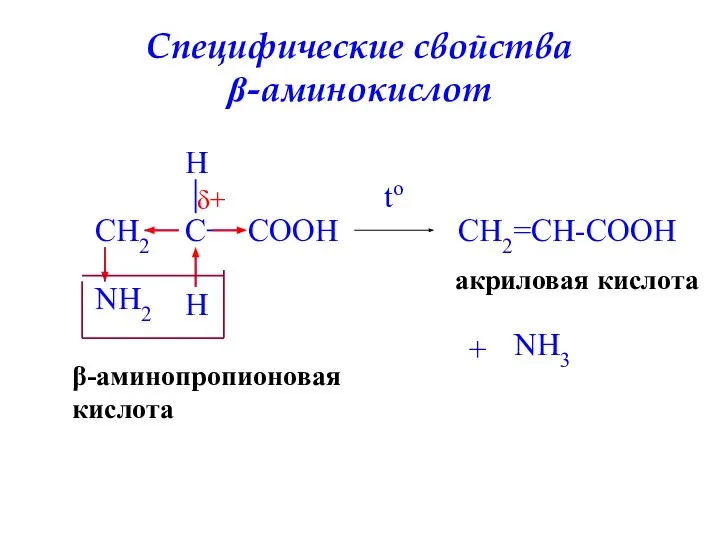
- 30. Специфические свойства β-аминокислот CH2 C COOH NH2 H H to CH2=CH-COOH акриловая кислота + NH3 β-аминопропионовая
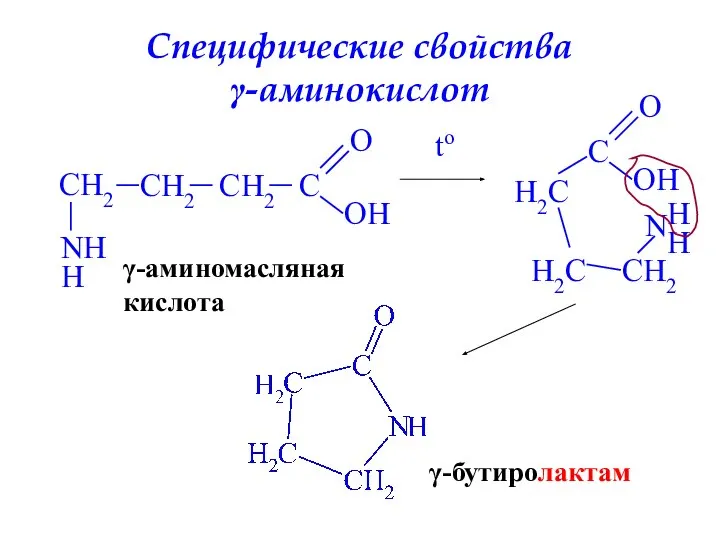
- 31. Специфические свойства γ-аминокислот CH2 CH2 CH2 C O OH N H H γ-аминомасляная кислота to C
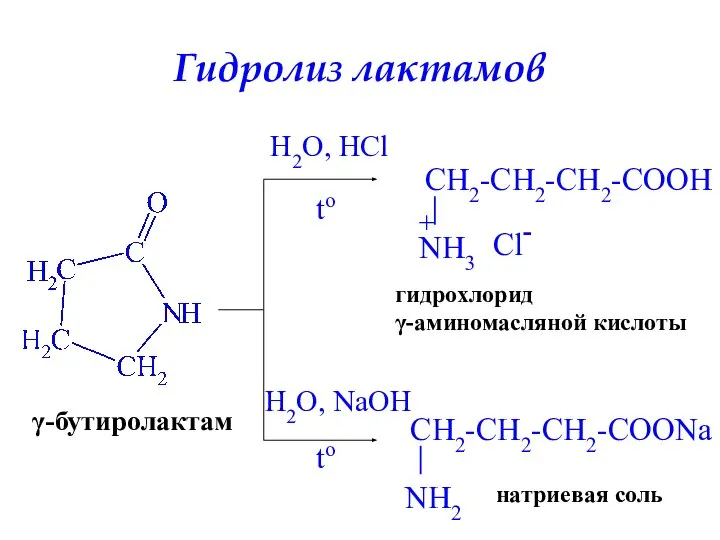
- 32. Гидролиз лактамов γ-бутиролактам H2O, HCl to гидрохлорид γ-аминомасляной кислоты H2O, NaOH to натриевая соль
- 33. Реакции α-аминокислот in vivo декарбоксилирование дезаминирование - окислительное; - неокислительное переаминирование образование пептидной связи
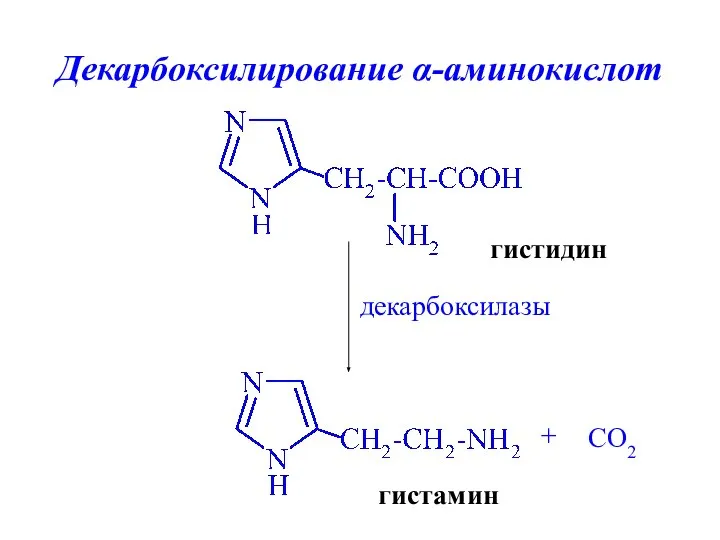
- 34. Декарбоксилирование α-аминокислот гистидин гистамин + CO2 декарбоксилазы
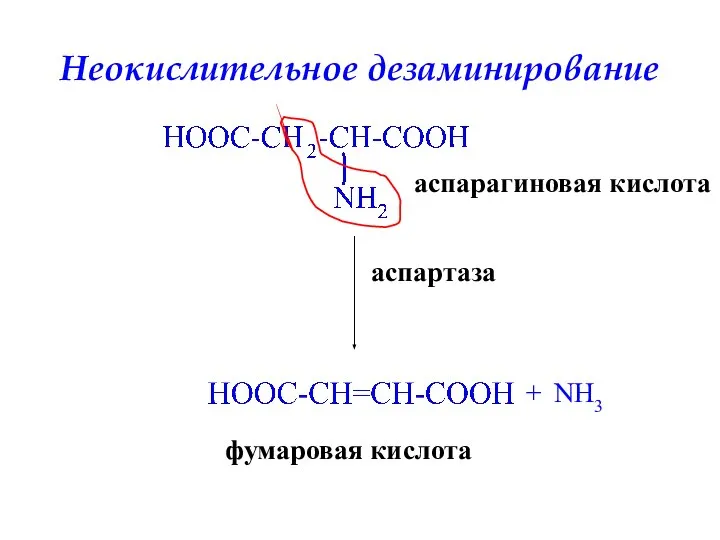
- 35. Неокислительное дезаминирование аспартаза + NH3 аспарагиновая кислота фумаровая кислота
- 36. Окислительное дезаминирование аланин [O] фермент α-иминокислота H2O фермент пировиноградная кислота + NH3
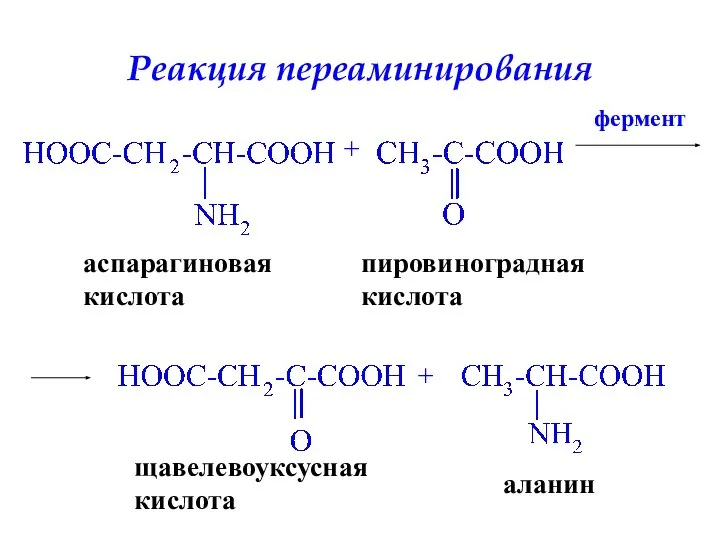
- 37. Реакция переаминирования аспарагиновая кислота + фермент + пировиноградная кислота щавелевоуксусная кислота аланин
- 38. Методы количественного определения α-аминокислот - метод формольного титрования; метод Фишера; метод Ван-Слайка; электрофорез
- 39. Пептиды и белки
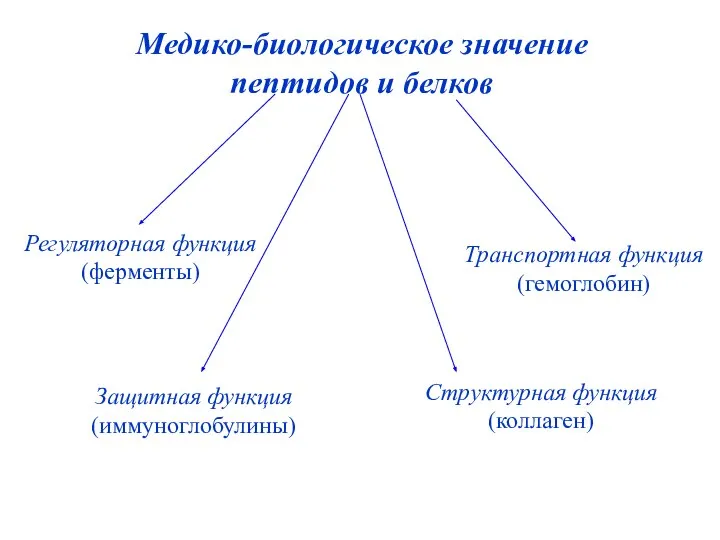
- 40. Медико-биологическое значение пептидов и белков Регуляторная функция (ферменты) Защитная функция (иммуноглобулины) Транспортная функция (гемоглобин) Структурная функция
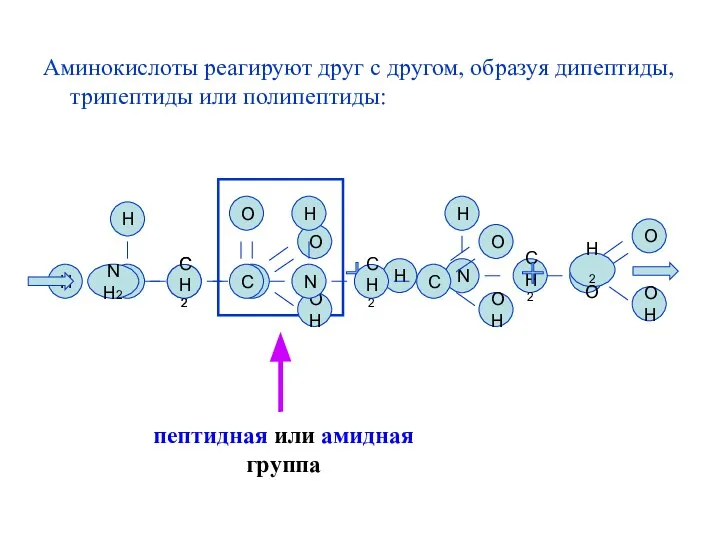
- 41. Аминокислоты реагируют друг с другом, образуя дипептиды, трипептиды или полипептиды: N СН2 C OH O H
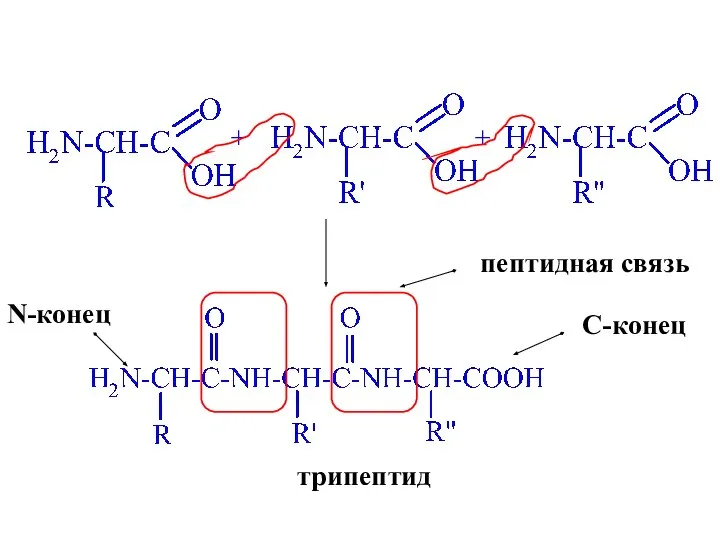
- 42. + + трипептид пептидная связь N-конец C-конец
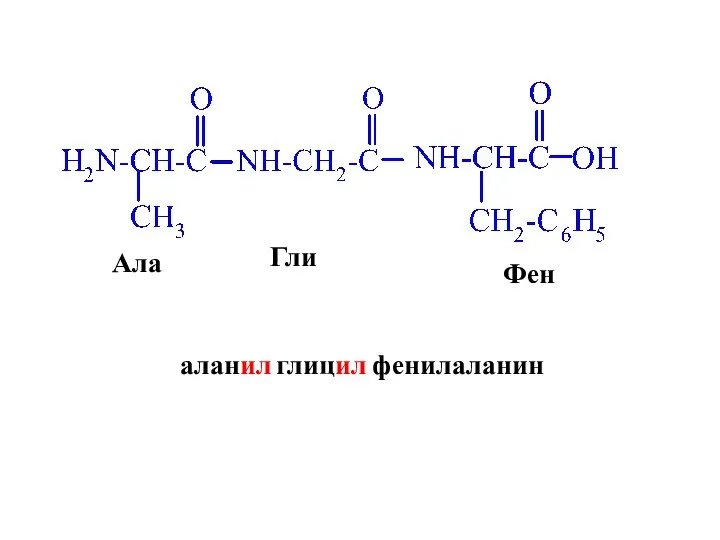
- 43. Ала Гли Фен аланил глицил фенилаланин
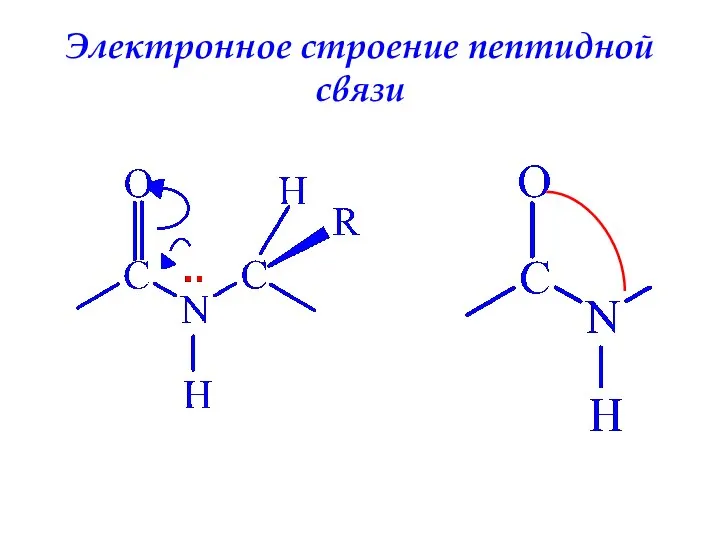
- 44. Электронное строение пептидной связи
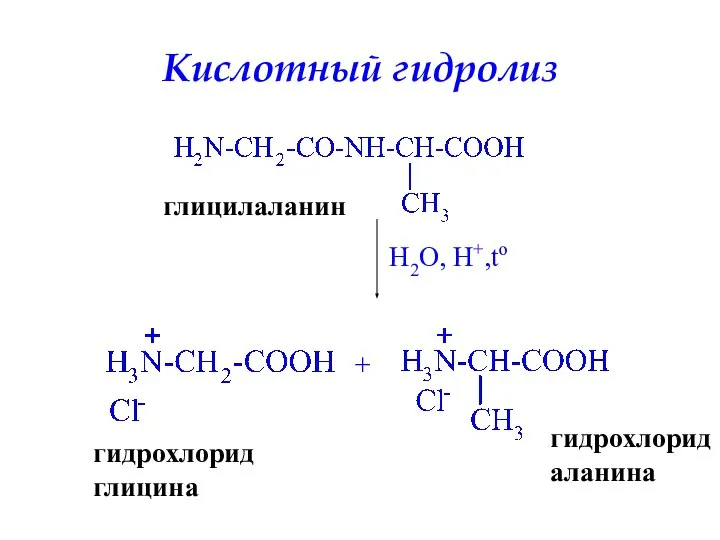
- 46. Кислотный гидролиз глицилаланин H2O, H+,to + гидрохлорид глицина гидрохлорид аланина
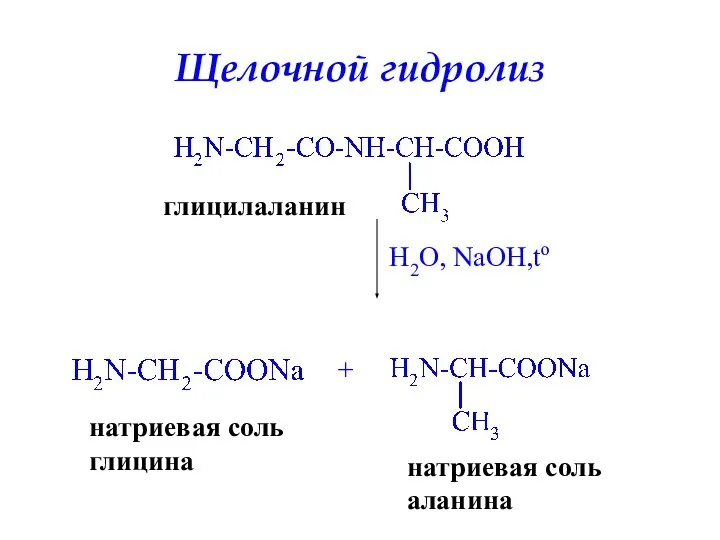
- 47. Щелочной гидролиз глицилаланин H2O, NaOH,to + натриевая соль глицина натриевая соль аланина
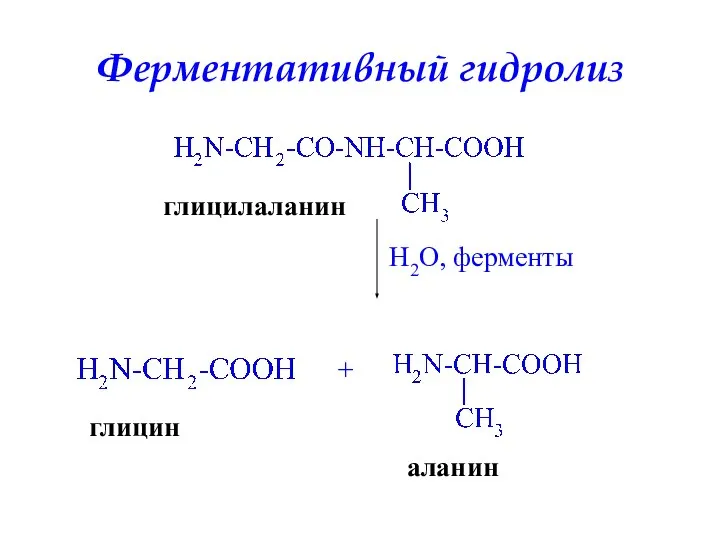
- 48. Ферментативный гидролиз глицилаланин H2O, ферменты + глицин аланин
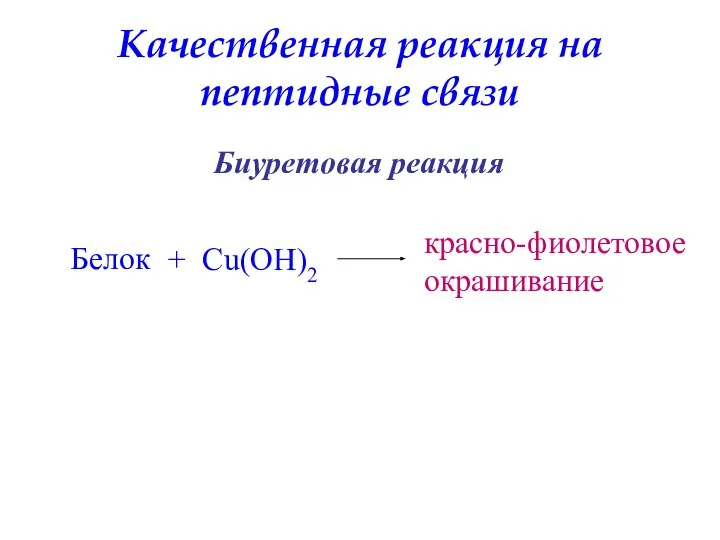
- 49. Качественная реакция на пептидные связи Белок + Cu(OH)2 красно-фиолетовое окрашивание Биуретовая реакция
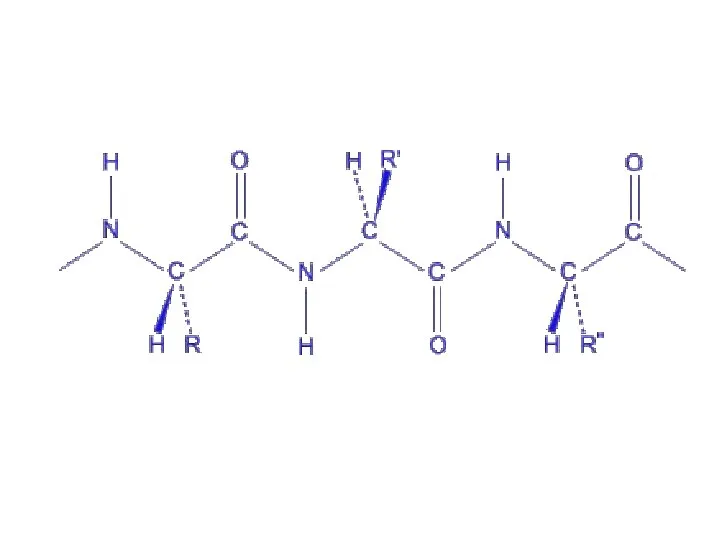
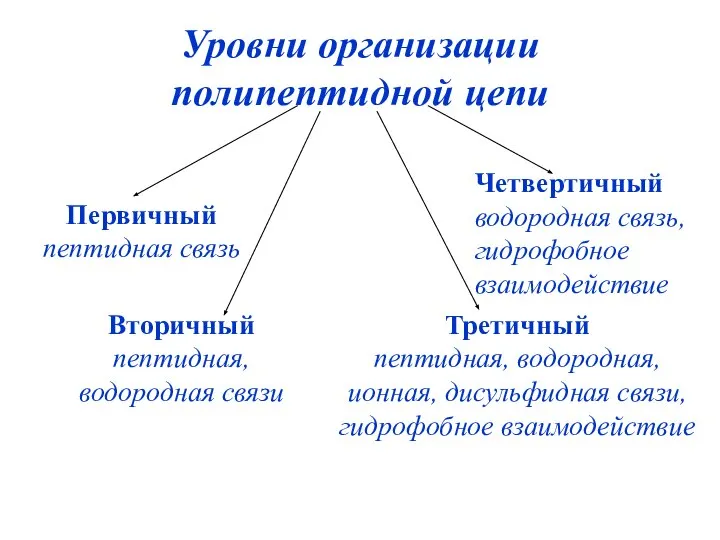
- 50. Уровни организации полипептидной цепи Первичный пептидная связь Вторичный пептидная, водородная связи Третичный пептидная, водородная, ионная, дисульфидная
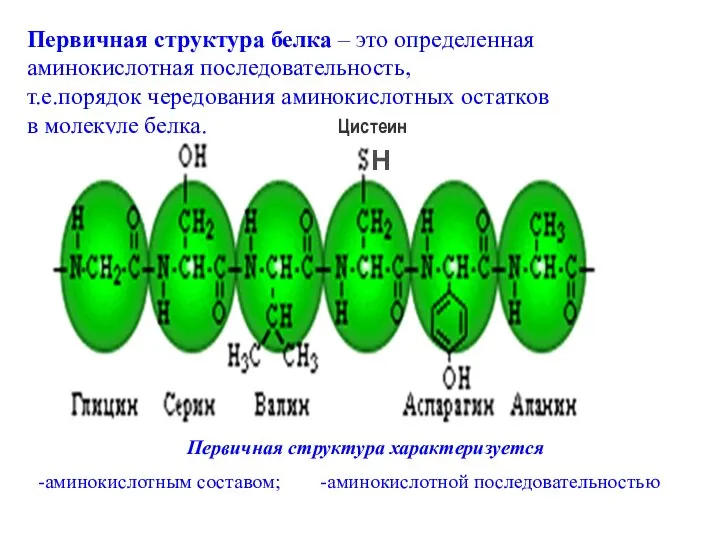
- 51. Первичная структура белка – это определенная аминокислотная последовательность, т.е.порядок чередования аминокислотных остатков в молекуле белка. Первичная
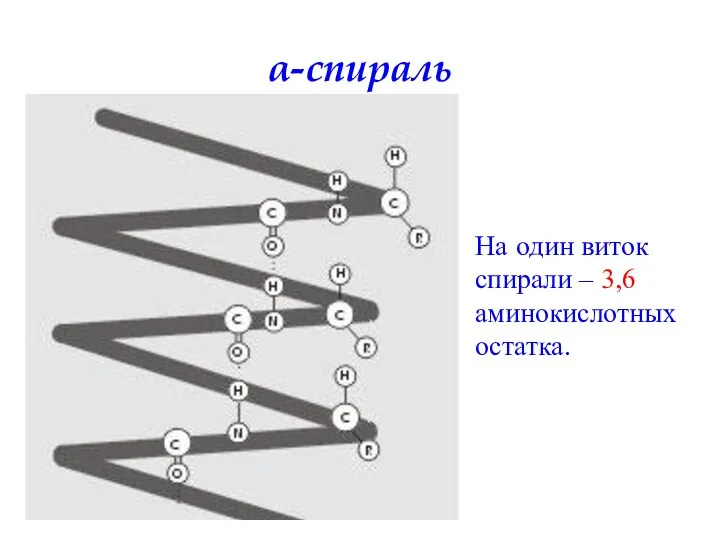
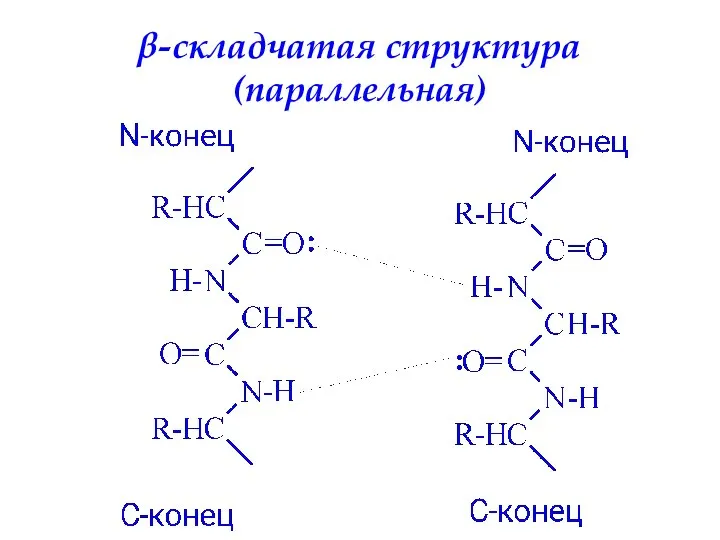
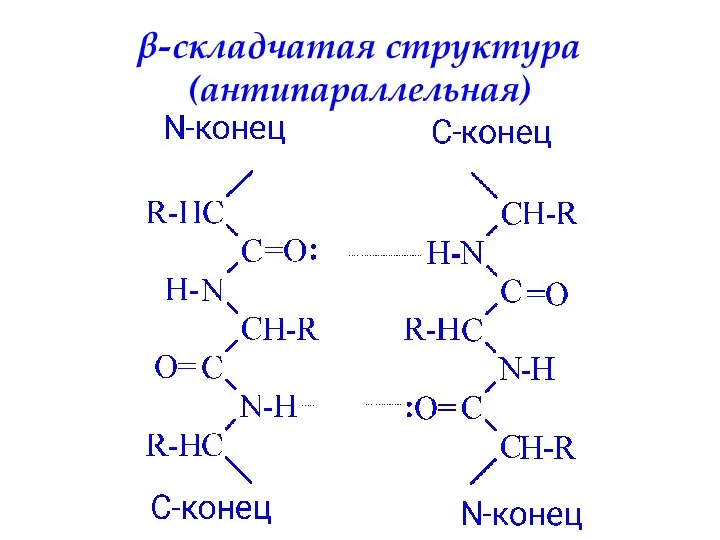
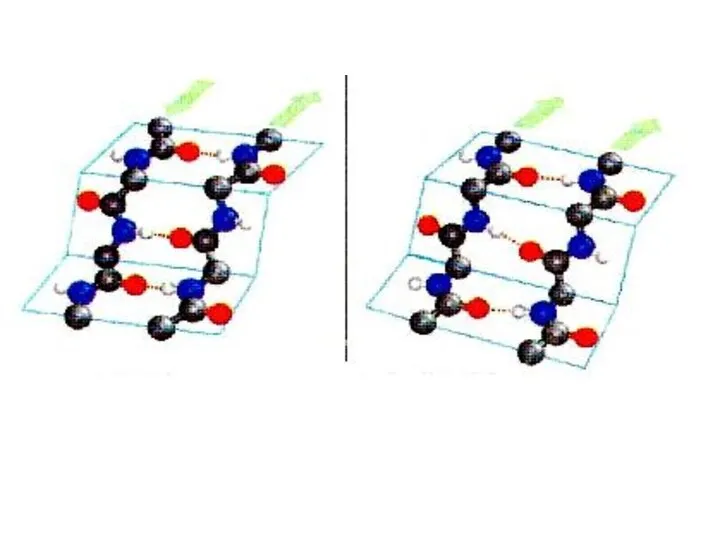
- 52. Вторичная структура белка – определенное пространственное расположение полипептидной цепи. α-спираль β-складчатая структура
- 53. На один виток спирали – 3,6 аминокислотных остатка. α-спираль
- 54. β-складчатая структура (параллельная)
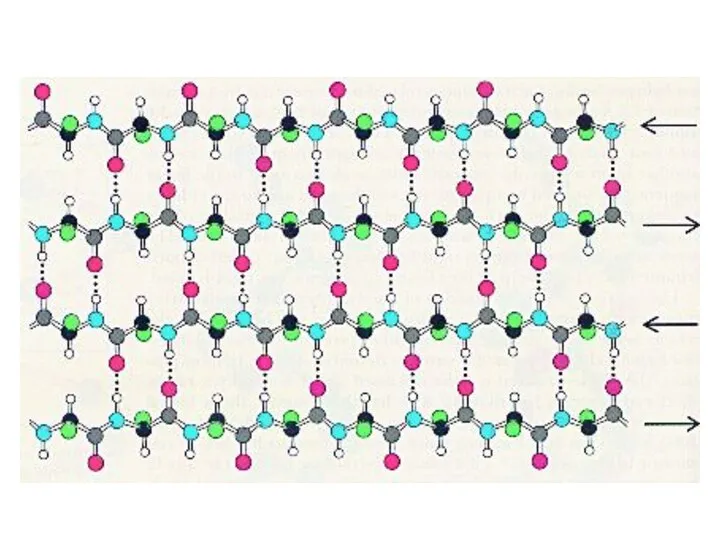
- 55. β-складчатая структура (антипараллельная)
- 58. Третичная структура белка
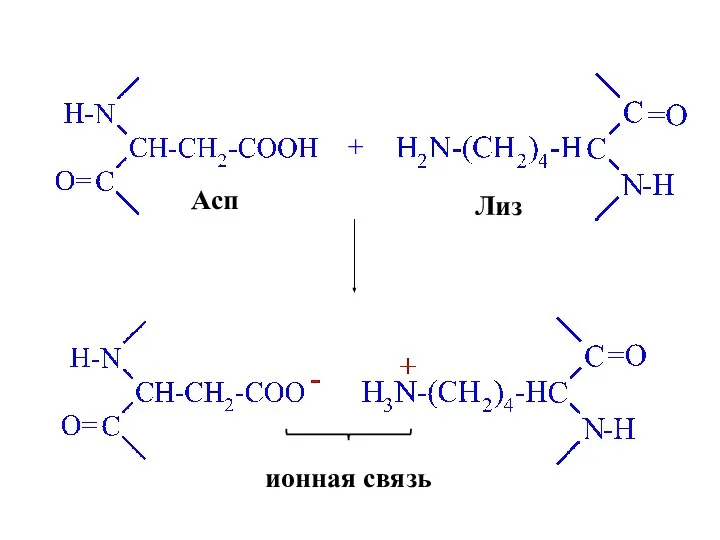
- 59. Асп + Лиз ионная связь
- 61. Скачать презентацию







![Окислительное дезаминирование аланин [O] фермент α-иминокислота H2O фермент пировиноградная кислота + NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/711225/slide-35.jpg)




 Кристаллические системы
Кристаллические системы «Волшебный» витамин или химические элементы в живой клетке
«Волшебный» витамин или химические элементы в живой клетке Двойной электрический слой (ДЭС)
Двойной электрический слой (ДЭС) Влияние вида основы на качество эмульсионной мази с калия йодидом при изготовлении в аптеке
Влияние вида основы на качество эмульсионной мази с калия йодидом при изготовлении в аптеке Классификация неорганических веществ
Классификация неорганических веществ Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома
Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома Органикалық қосылыстар
Органикалық қосылыстар ПРЕЗЕНТАЦИЯ ПО ХИМИИ ТЕМА: «ЛАУРЕАТ НОБЕЛЕВСКОЙ ПРЕМИИ У.РАМЗАЙ» ПОДГОТОВИЛИ: ШРАЙНЕР МАТИШОВ 8 «А» КЛАСС
ПРЕЗЕНТАЦИЯ ПО ХИМИИ ТЕМА: «ЛАУРЕАТ НОБЕЛЕВСКОЙ ПРЕМИИ У.РАМЗАЙ» ПОДГОТОВИЛИ: ШРАЙНЕР МАТИШОВ 8 «А» КЛАСС  Металлы. Разнообразие металлов
Металлы. Разнообразие металлов Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Минералы и их строение
Минералы и их строение Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Целестин мінерал Підготувала учениця 8 – А класу Мостєпан Ксенія
Целестин мінерал Підготувала учениця 8 – А класу Мостєпан Ксенія Классификация автомобильных масел
Классификация автомобильных масел Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть  Химический состав клеток. Углеводы. Липиды
Химический состав клеток. Углеводы. Липиды Электрохимия. Окислительно-восстановительные реакции
Электрохимия. Окислительно-восстановительные реакции Термостабилизаторы. Доноры водорода
Термостабилизаторы. Доноры водорода Вода и ее свойства
Вода и ее свойства Титан. История открытия титана
Титан. История открытия титана Презентация по Химии "Изучение химического состава кристаллов и синтезирование в лабораторных условиях" - скачать смотреть
Презентация по Химии "Изучение химического состава кристаллов и синтезирование в лабораторных условиях" - скачать смотреть  Химические элементы O2 и N2
Химические элементы O2 и N2 Лекция № 14. Виды лакокрасочных составов, свойства и применение
Лекция № 14. Виды лакокрасочных составов, свойства и применение Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Энергетическое топливо
Энергетическое топливо Биополимеры: естественные и искусственные
Биополимеры: естественные и искусственные Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса Гидролиз. Граф структуры
Гидролиз. Граф структуры