Содержание
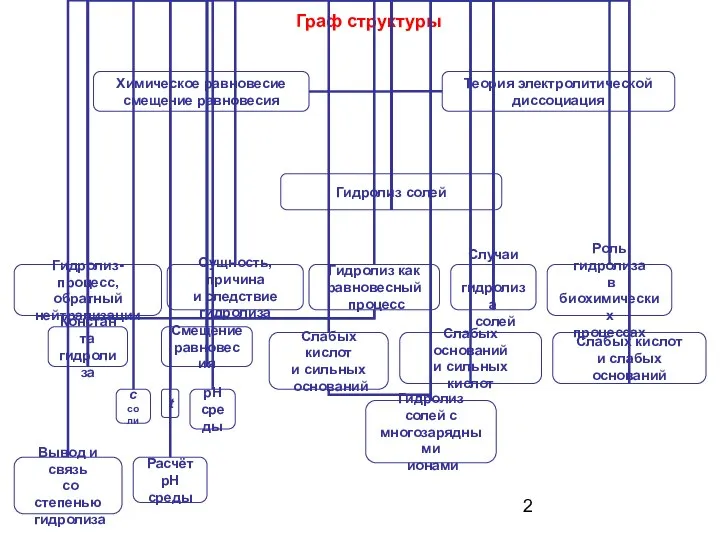
- 2. Граф структуры
- 3. Гидролиз солей – реакция обмена между солью и водой (взаимодействие ионов соли с молекулами воды). Причина
- 5. 1. с M раствор соли, образованной слабой кислотой HyAn с константой диссоциации Ka (при y >
- 6. Соли KF и Na3PO4 Если y > 1, то теоретически кроме 1-ой ступени гидролиз возможен еще
- 7. При c/Kh > 100 используют более простые уравнения: 0,05 M раствор Sr(CN)2; pKa(HCN) = 9,31 pH
- 8. При c/Kh > 100 (h ≤ 0,05): Чем слабее кислота, образующая соль (меньше Ka), тем больше
- 9. Выражение константы гидролиза (равновесная концентрация жидкой воды [H2O] не входит в выражение) Домножим числитель и знаменатель
- 10. Если x > 1, то теоретически кроме 1-ой ступени гидролиз возможен еще в несколько (x-1) ступеней,
- 11. При c/Kh > 100 используют более простые уравнения: 0,04 M раствор AlCl3; pKb,III(Al(OH)3) = 8,98 pH
- 12. 3. с M раствор соли, образованной слабым основанием M(OH)x с константой диссоциации Kb (при x >
- 13. Соли AgF и Mg(NO2)2 Вывод уравнения для расчета pH раствора такой соли в общем виде очень
- 14. h раствора такой соли не зависит от ее концентрации!
- 15. pH раствора такой соли не зависит от ее концентрации! Раствор MgSO3S; pKb,II(Mg(OH)2) = 2,58; pKa,II(H2SO3S) =
- 16. 4. с M раствор кислой соли, образованной слабой кислотой HyAn (y > 1) и сильным основанием.
- 18. Раствор NaHSO3 имеет слабокислую среду Раствор питьевой соды NaHCO3 имеет слабощелочную среду и используется в медицине
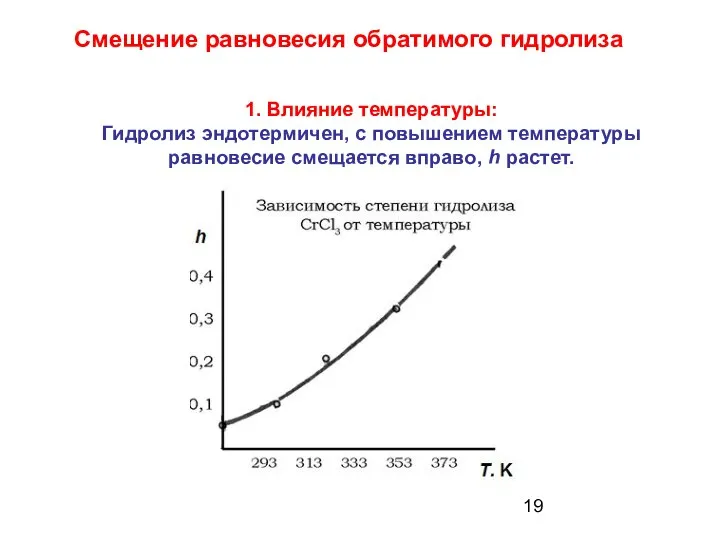
- 19. 1. Влияние температуры: Гидролиз эндотермичен, с повышением температуры равновесие смещается вправо, h растет. Смещение равновесия обратимого
- 20. 2. Добавление сильных кислот (H+) и щелочей (ОН–). а) В случае обратимого гидролиза по катиону одним
- 21. 3. Разбавление раствора. Оно смещает вправо равновесие обратимого гидролиза по одному виду ионов (по катиону, по
- 22. Необратимый гидролиз Если продукт гидролиза накапливается в растворе в таком количестве, что может выпасть в осадок
- 23. Частным случаем последнего варианта является взаимное усиление гидролиза, протекающее при попытке получить по обменной реакции в
- 24. Роль гидролиза биоорганических соединений в процессах жизнедеятельности пепсин желудочного сока активен при рН = 1,5–2,0; каталаза
- 25. 1. Каждый из ферментов активен при строго определенных значениях рН. Без ферментативного гидролиза невозможно усвоение пищевых
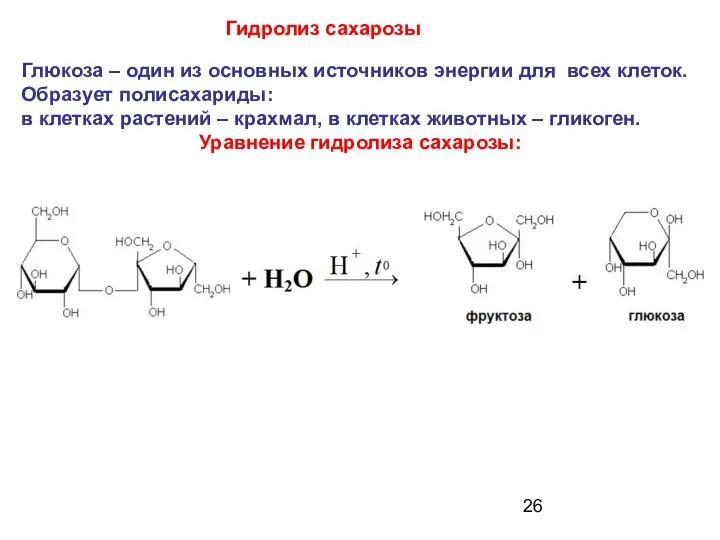
- 26. Гидролиз сахарозы Глюкоза – один из основных источников энергии для всех клеток. Образует полисахариды: в клетках
- 27. Белки – основной строительный материал клеток (рыба, творог, сыр, говядина, крупы) Вещества, молекулы которых состоят из
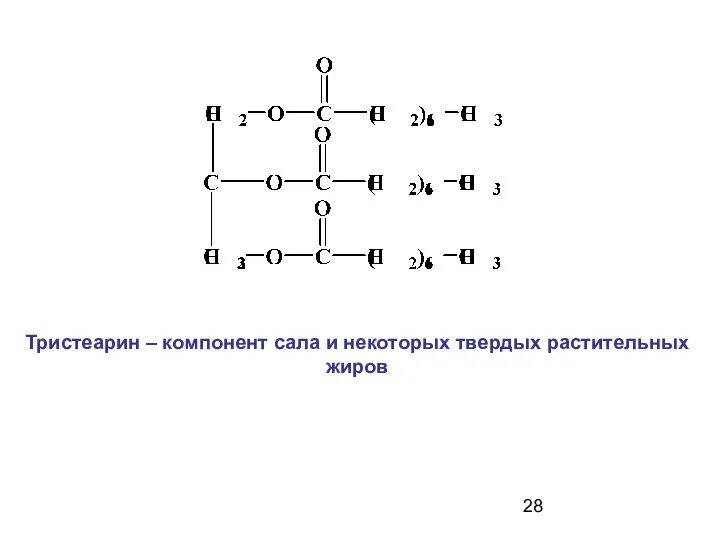
- 28. Тристеарин – компонент сала и некоторых твердых растительных жиров
- 29. 2. Гидролиз АТФ – источник энергии в организме. Человек получает энергию как за счет многостадийного процесса
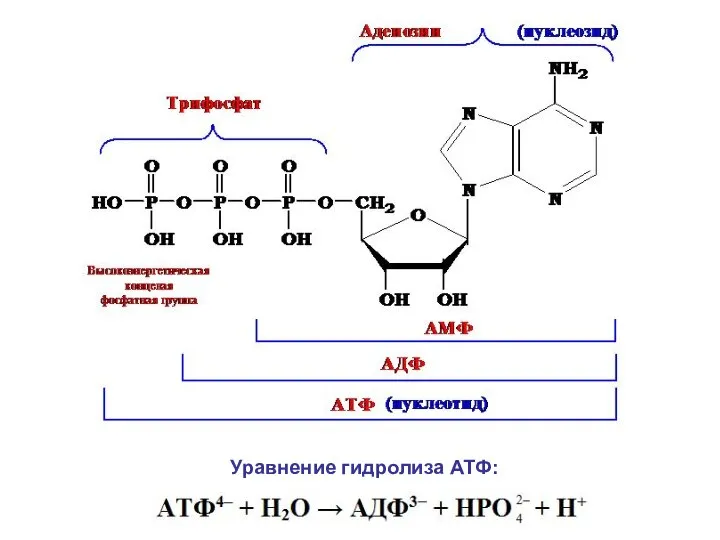
- 30. Уравнение гидролиза АТФ:
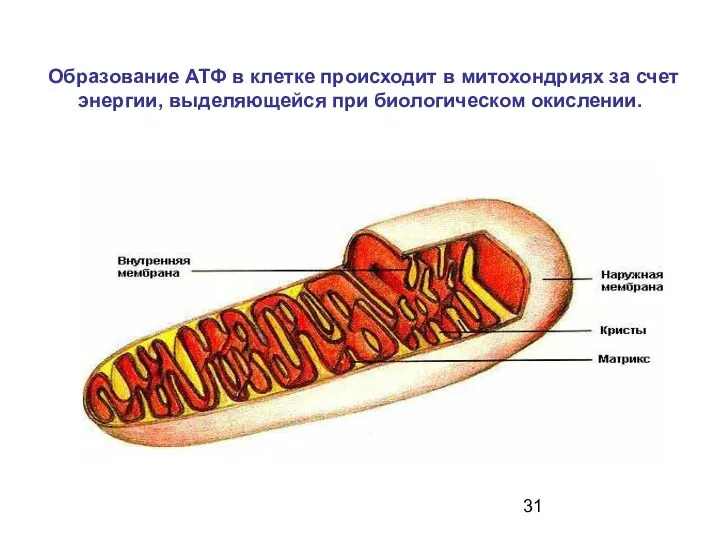
- 31. Образование АТФ в клетке происходит в митохондриях за счет энергии, выделяющейся при биологическом окислении.
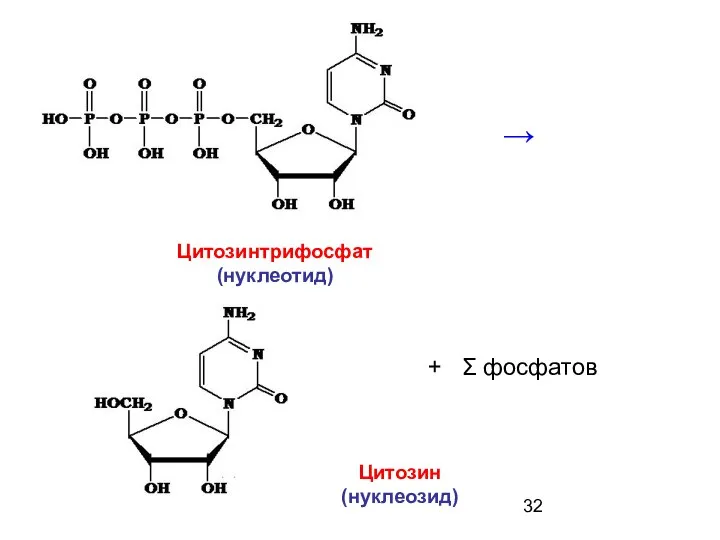
- 32. Цитозин (нуклеозид) Цитозинтрифосфат (нуклеотид) → + Σ фосфатов
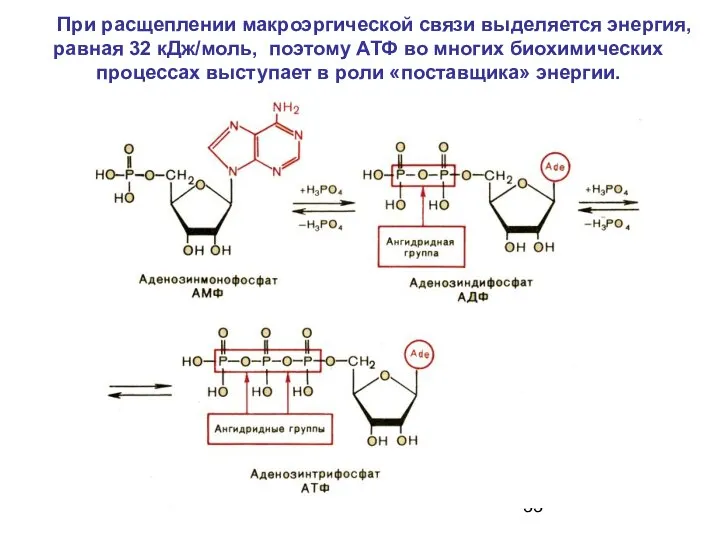
- 33. При расщеплении макроэргической связи выделяется энергия, равная 32 кДж/моль, поэтому АТФ во многих биохимических процессах выступает
- 34. 3. Гидролиз – один из важнейших путей метаболизма лекарственных препаратов и пищевых продуктов Процесс гидролиза может
- 35. Большинство лекарственных веществ метаболизируются в печени, располагающей для этого набором ферментных систем весьма большой мощности. Эти
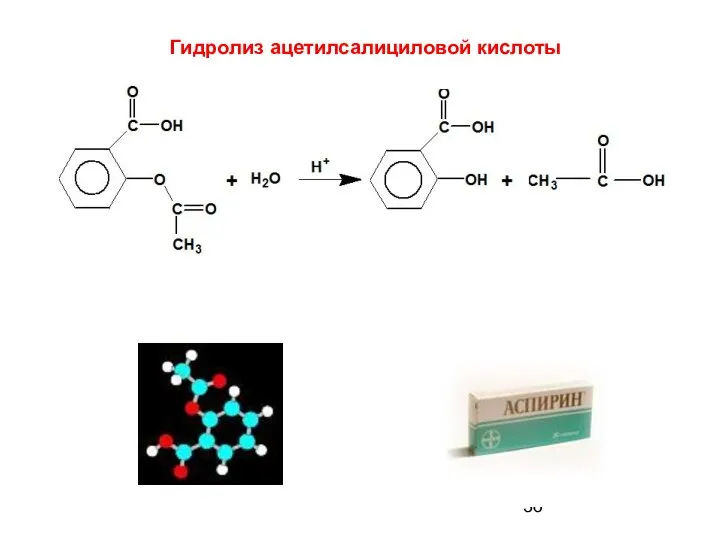
- 36. Гидролиз ацетилсалициловой кислоты
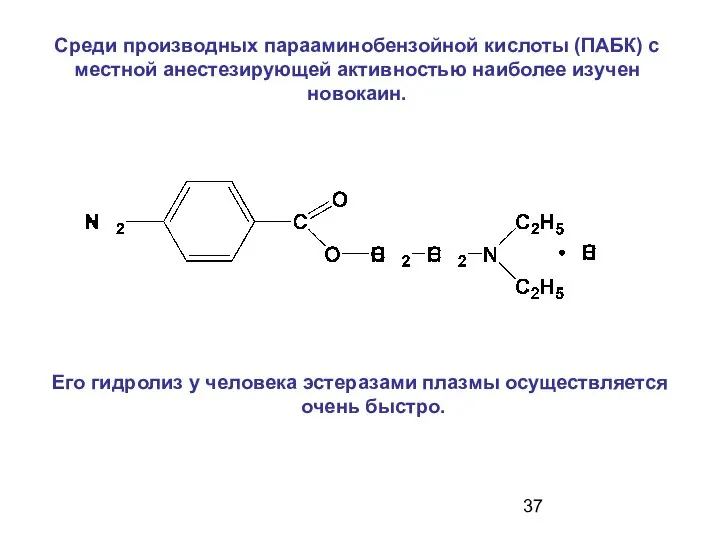
- 37. Среди производных парааминобензойной кислоты (ПАБК) с местной анестезирующей активностью наиболее изучен новокаин. Его гидролиз у человека
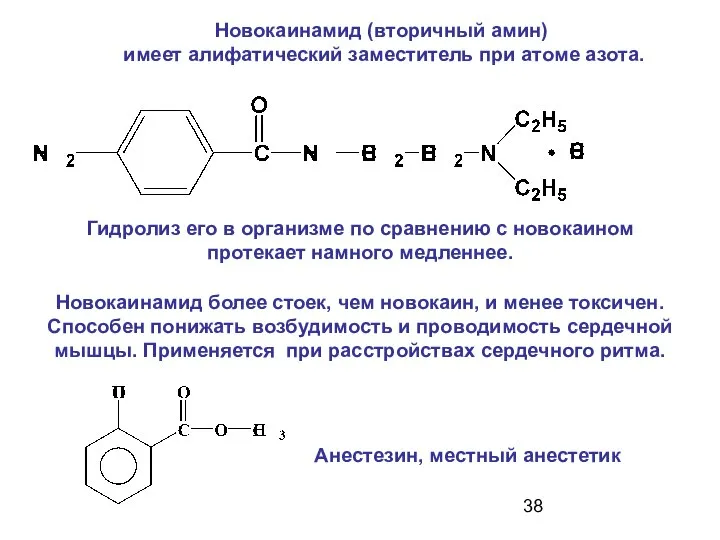
- 38. Новокаинамид (вторичный амин) имеет алифатический заместитель при атоме азота. Новокаинамид более стоек, чем новокаин, и менее
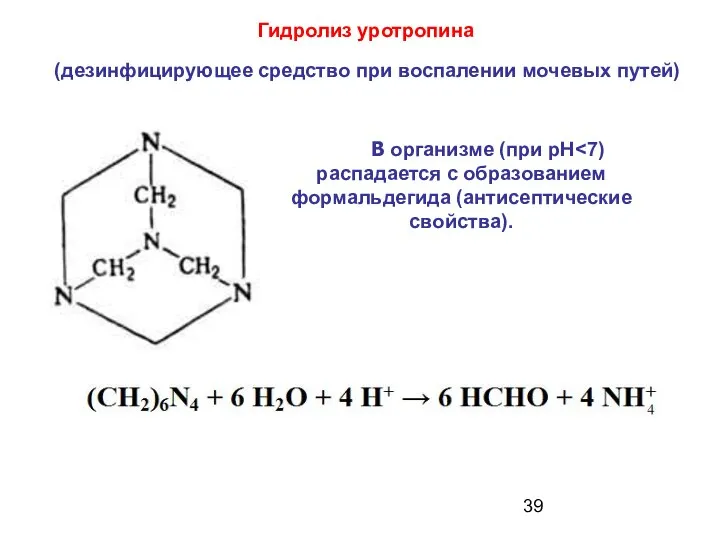
- 39. Гидролиз уротропина В организме (при pH (дезинфицирующее средство при воспалении мочевых путей)
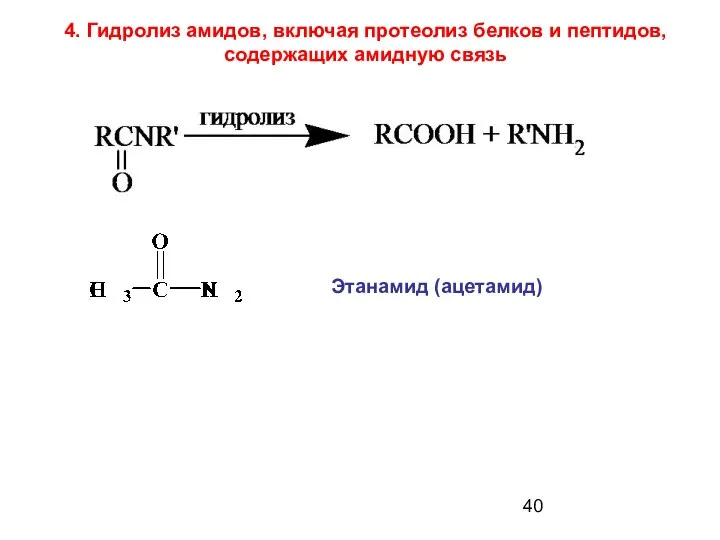
- 40. Этанамид (ацетамид) 4. Гидролиз амидов, включая протеолиз белков и пептидов, содержащих амидную связь
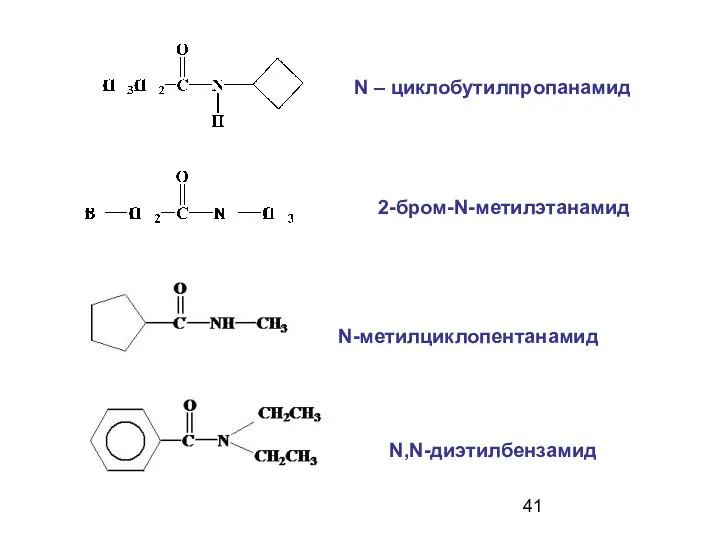
- 41. N – циклобутилпропанамид 2-бром-N-метилэтанамид N-метилциклопентанамид N,N-диэтилбензамид
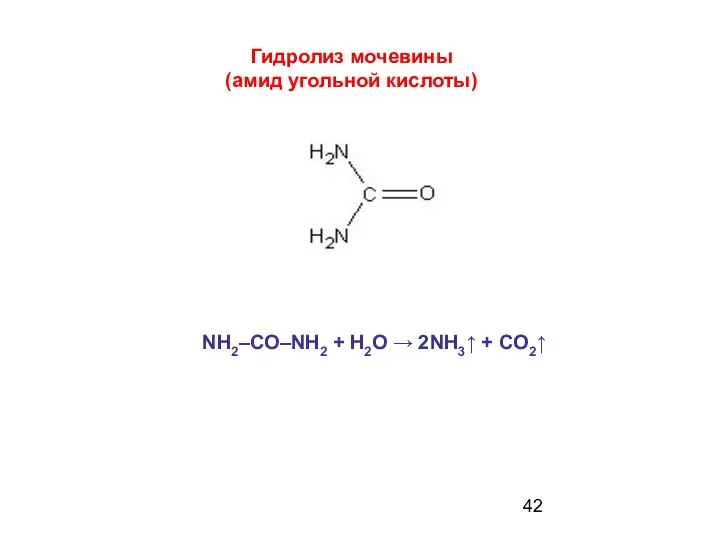
- 42. Гидролиз мочевины (амид угольной кислоты) NH2–CO–NH2 + H2O → 2NH3↑ + CO2↑
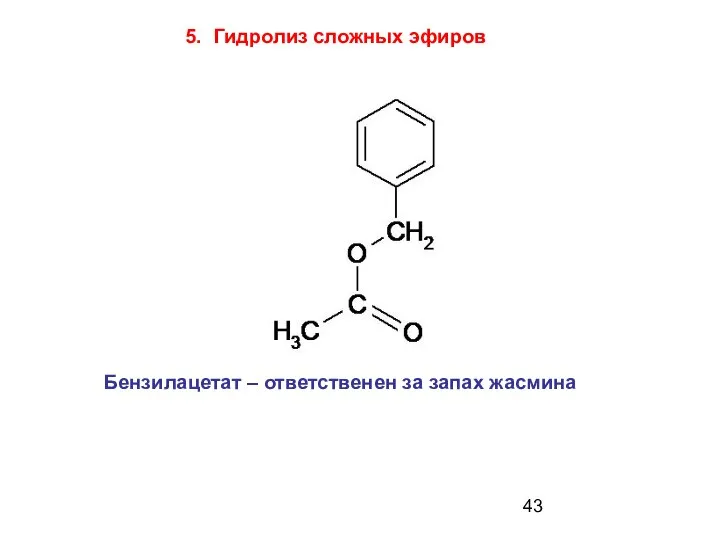
- 43. Бензилацетат – ответственен за запах жасмина 5. Гидролиз сложных эфиров
- 45. Скачать презентацию






![Выражение константы гидролиза (равновесная концентрация жидкой воды [H2O] не входит в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1386862/slide-8.jpg)


















 Основные характеристики различных сортов меда
Основные характеристики различных сортов меда Механические свойства полезных ископаемых
Механические свойства полезных ископаемых Влияние состава вещества на эффективность таяния льда и замерзания водных растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных растворов Подготовка учащихся к практическим турам олимпиад по химии
Подготовка учащихся к практическим турам олимпиад по химии Extremely hazardous chemicals
Extremely hazardous chemicals Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда
Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда Химические свойства оксидов
Химические свойства оксидов Установление структуры биополимеров
Установление структуры биополимеров Медико-биологическое значение соединений алюминия
Медико-биологическое значение соединений алюминия Еще раз про электролиз…
Еще раз про электролиз… Электролиты и неэлектролиты. Понятие об электролитической диссоциации. (9 класс)
Электролиты и неэлектролиты. Понятие об электролитической диссоциации. (9 класс) Аллотропные модификации. Углерод
Аллотропные модификации. Углерод Моль. Молярная масса
Моль. Молярная масса Рефлексия
Рефлексия Химия
Химия Классификация смесевой химической продукции
Классификация смесевой химической продукции Спирт µндіру технологиясы
Спирт µндіру технологиясы Простые и сложные вещества
Простые и сложные вещества Химические свойства бензола Савенков Сергей 10 «Б» кл.
Химические свойства бензола Савенков Сергей 10 «Б» кл.  Основы химической коррозии
Основы химической коррозии Ароматические соединения. Лекция 10
Ароматические соединения. Лекция 10 Перекисное окисление липидов
Перекисное окисление липидов Изомерия и ее виды
Изомерия и ее виды Элементы группы галогенов
Элементы группы галогенов Щелочноземельные металлы
Щелочноземельные металлы Предел упругости
Предел упругости Несгораемая купюра
Несгораемая купюра Ионизирующее излучение и окружающая среда
Ионизирующее излучение и окружающая среда