Содержание
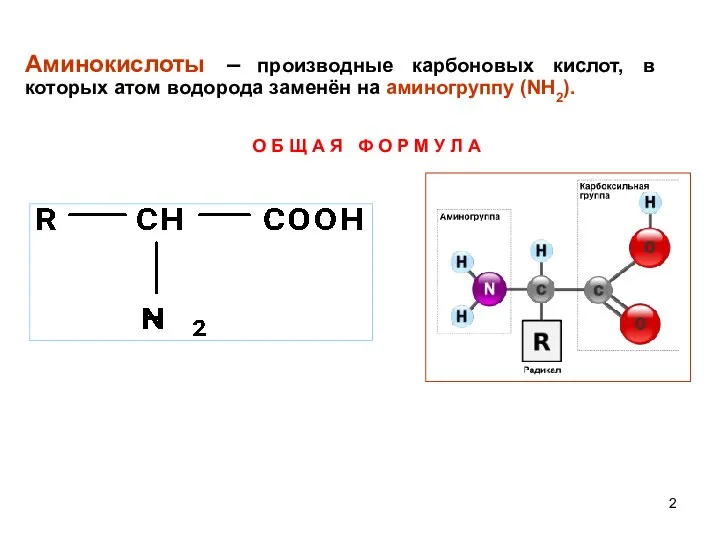
- 2. Аминокислоты – производные карбоновых кислот, в которых атом водорода заменён на аминогруппу (NH2). О Б Щ
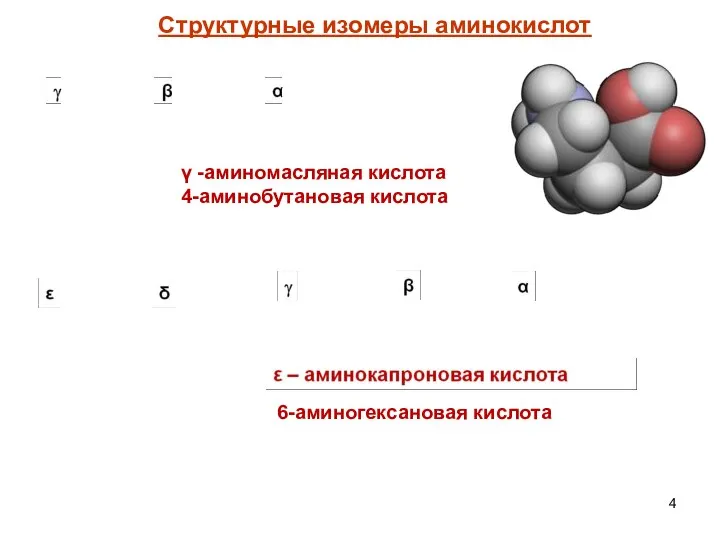
- 3. По положению аминогруппы различают α, β, γ, ε – структурные изомеры. CH2 CH2 COOH NH2 3-аминопропановая
- 4. γ -аминомасляная кислота 4-аминобутановая кислота 6-аминогексановая кислота Структурные изомеры аминокислот
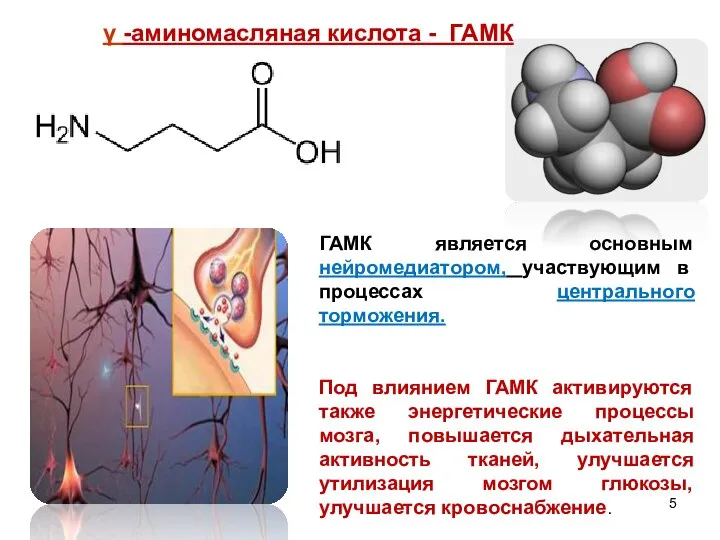
- 5. ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения. Под влиянием ГАМК активируются также энергетические процессы
- 6. . γ-Аминомасляная кислота выполняет в организме функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в
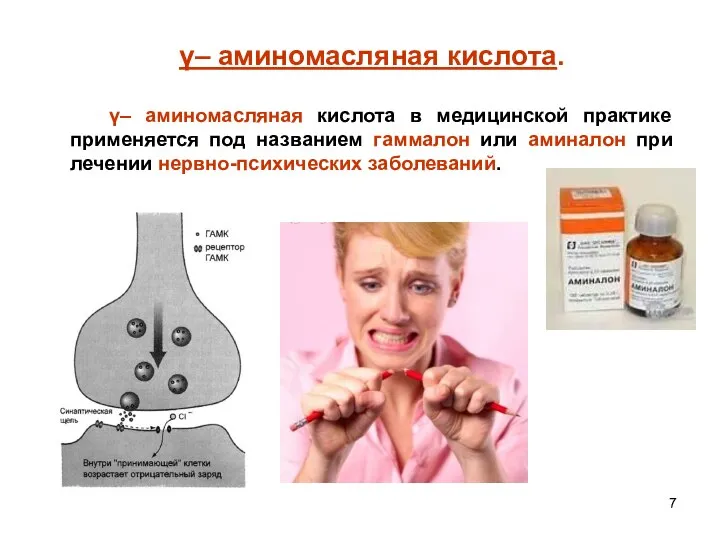
- 7. γ– аминомасляная кислота. γ– аминомасляная кислота в медицинской практике применяется под названием гаммалон или аминалон при
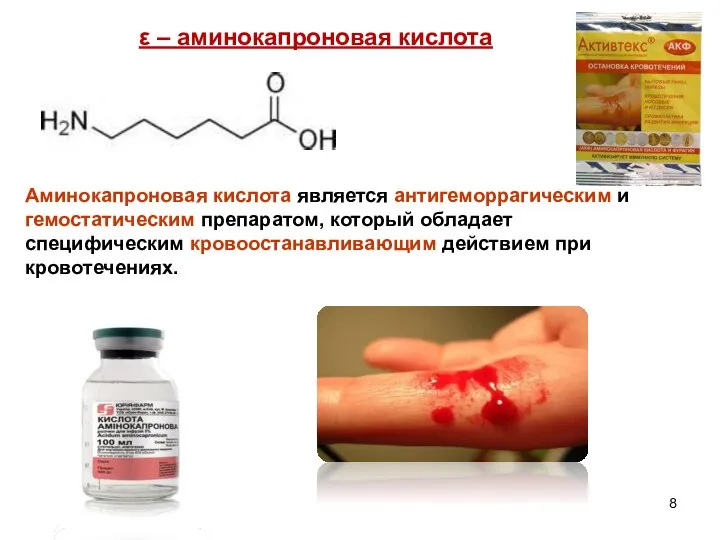
- 8. ε – аминокапроновая кислота Аминокапроновая кислота является антигеморрагическим и гемостатическим препаратом, который обладает специфическим кровоостанавливающим действием
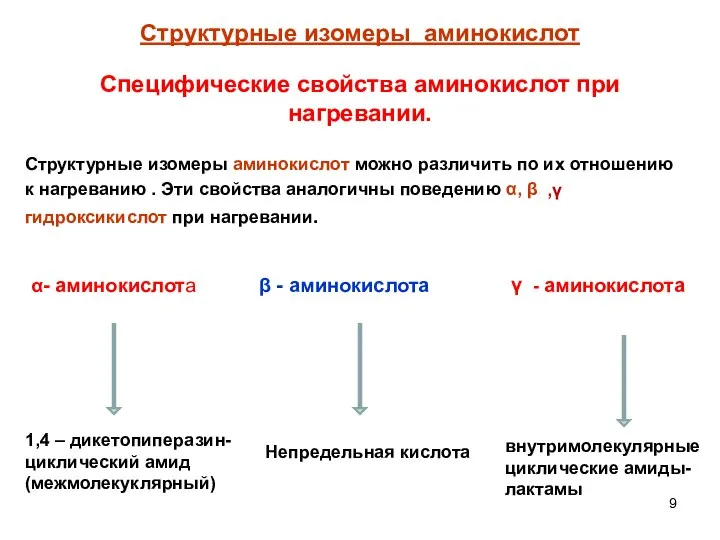
- 9. Структурные изомеры аминокислот Структурные изомеры аминокислот можно различить по их отношению к нагреванию . Эти свойства
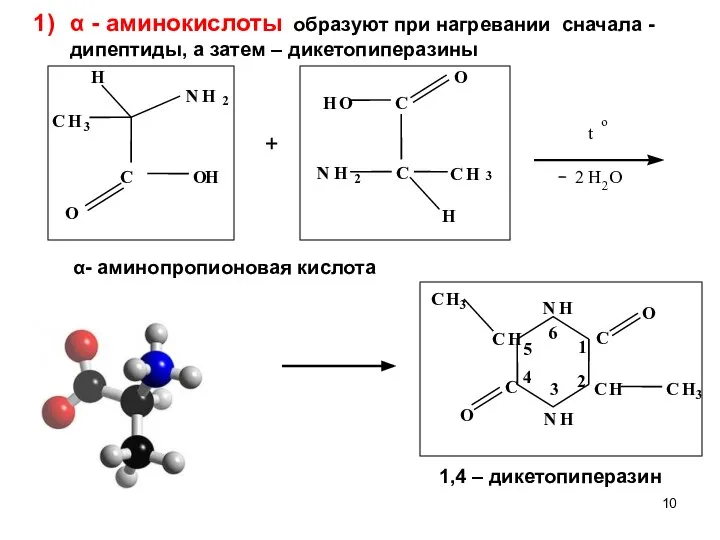
- 10. α - аминокислоты образуют при нагревании сначала - дипептиды, а затем – дикетопиперазины α- аминопропионовая кислота
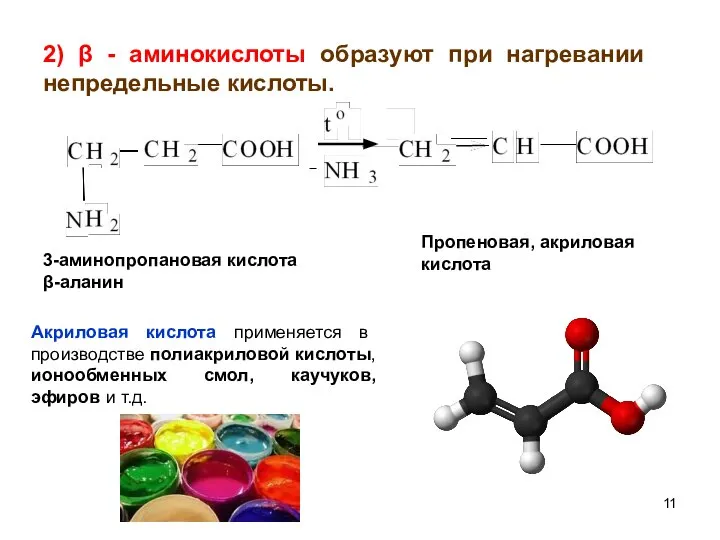
- 11. 2) β - аминокислоты образуют при нагревании непредельные кислоты. 3-аминопропановая кислота β-аланин Пропеновая, акриловая кислота Акриловая
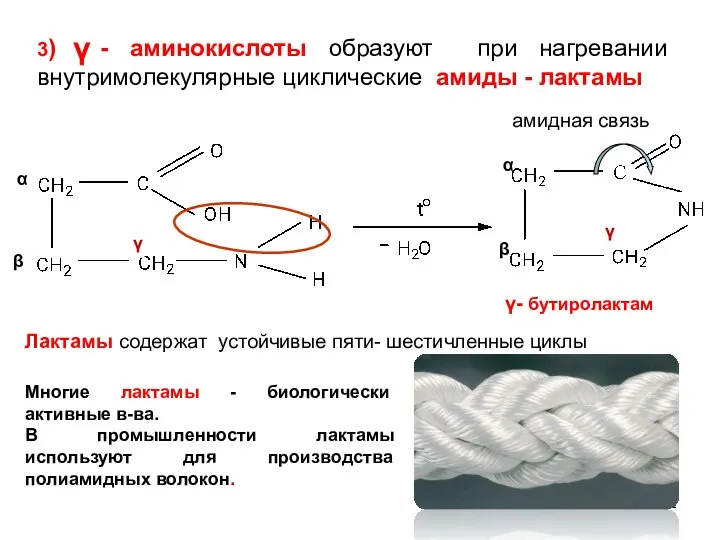
- 12. амидная связь α β α β 3) - аминокислоты образуют при нагревании внутримолекулярные циклические амиды -
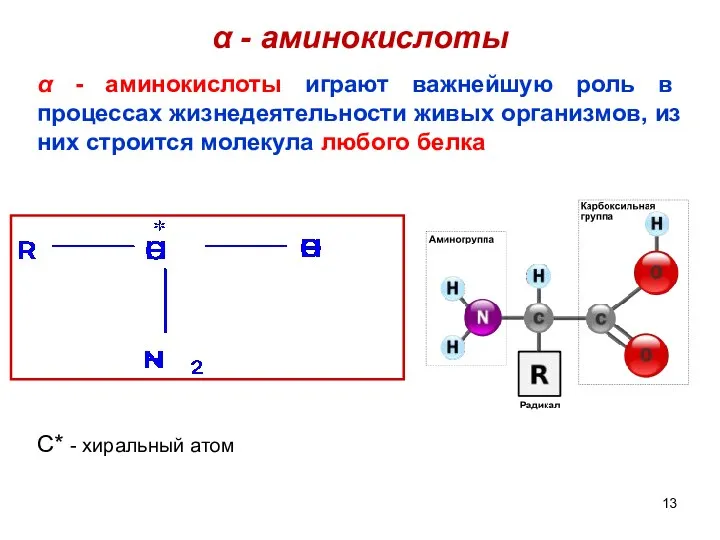
- 13. α - аминокислоты α - аминокислоты играют важнейшую роль в процессах жизнедеятельности живых организмов, из них
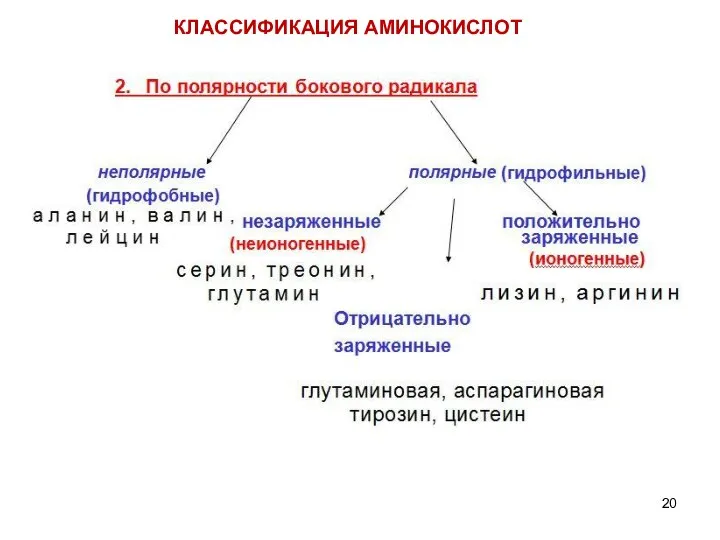
- 14. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ Для аминокислот существует несколько классификаций в зависимости от того, какой признак положен в основу.
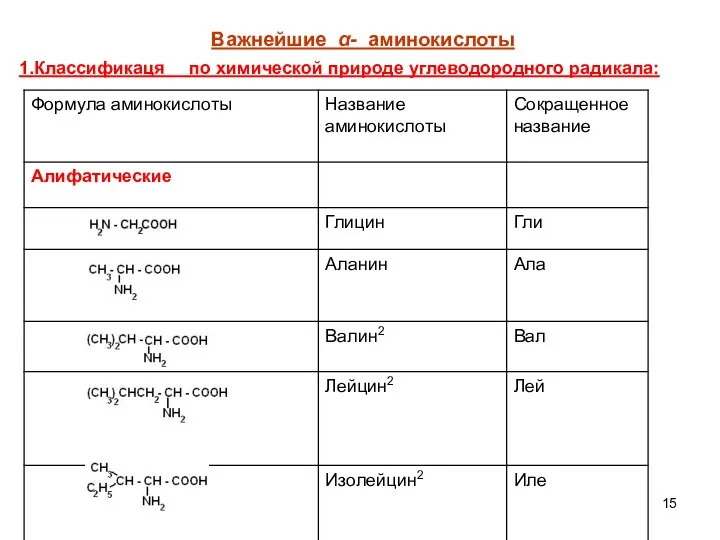
- 15. Важнейшие α- аминокислоты 1.Классификаця по химической природе углеводородного радикала:
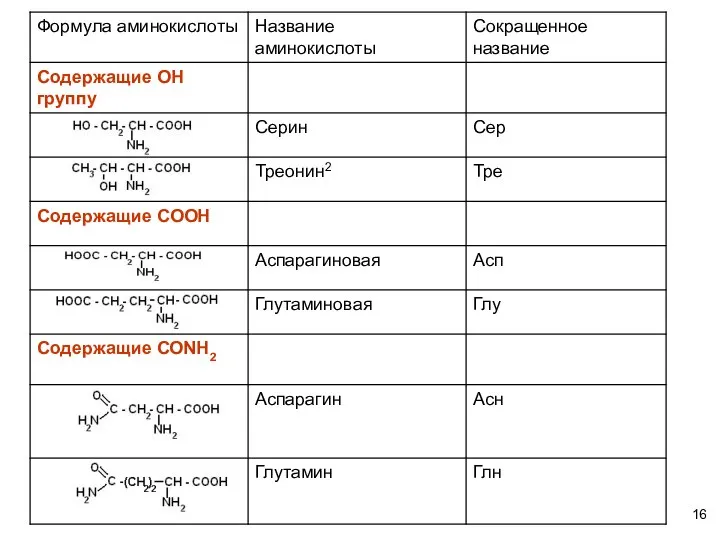
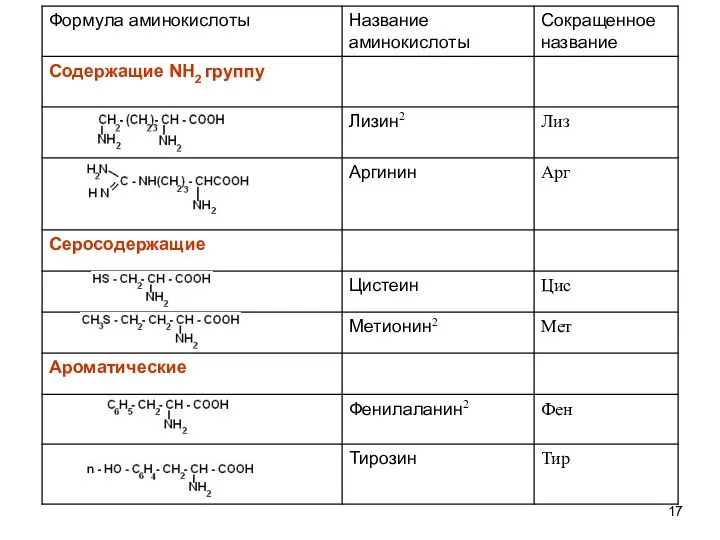
- 18. Формула аминокислоты
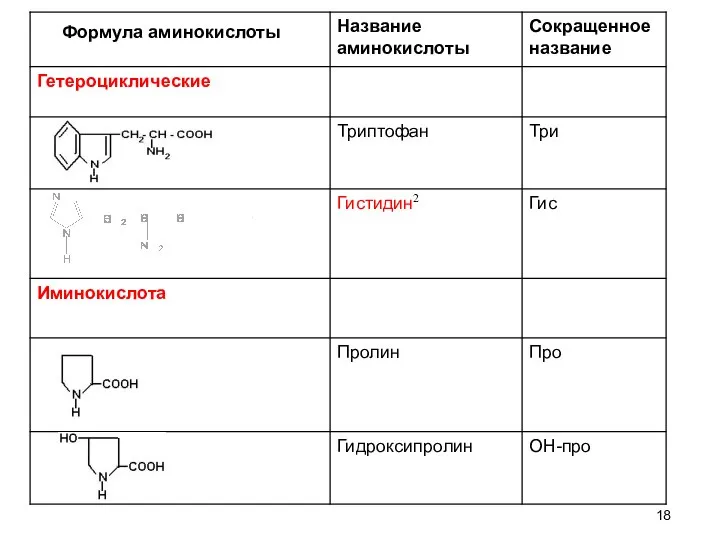
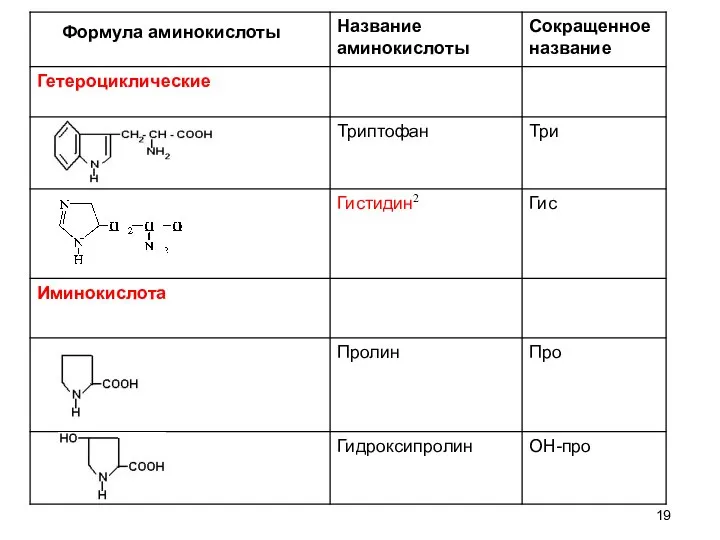
- 19. Формула аминокислоты
- 20. КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
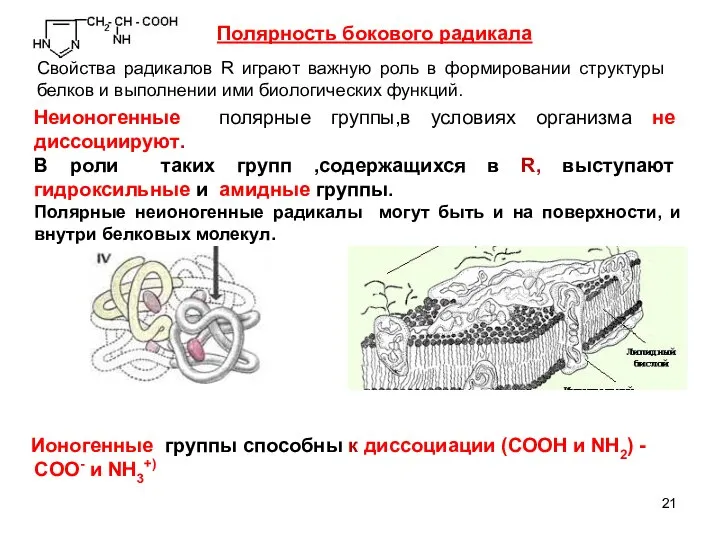
- 21. Полярность бокового радикала Свойства радикалов R играют важную роль в формировании структуры белков и выполнении ими
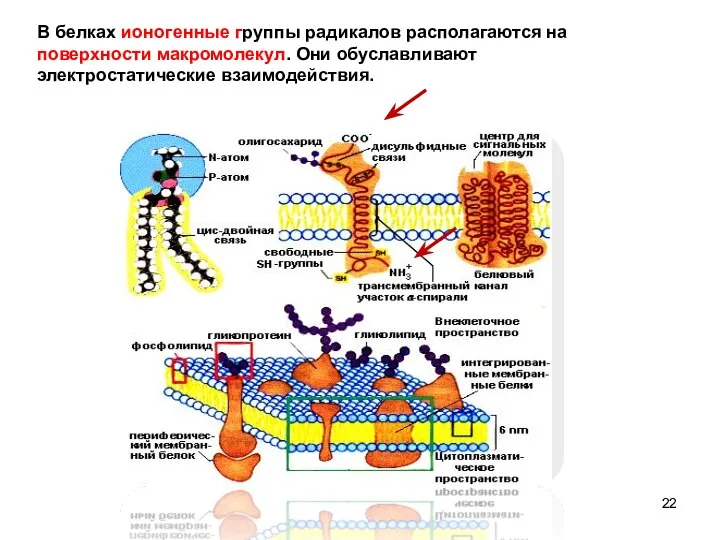
- 22. В белках ионогенные группы радикалов располагаются на поверхности макромолекул. Они обуславливают электростатические взаимодействия.
- 23. 3. По количеству амино - и карбоксильных групп : 1 амино- и 1 карбоксильная группа –
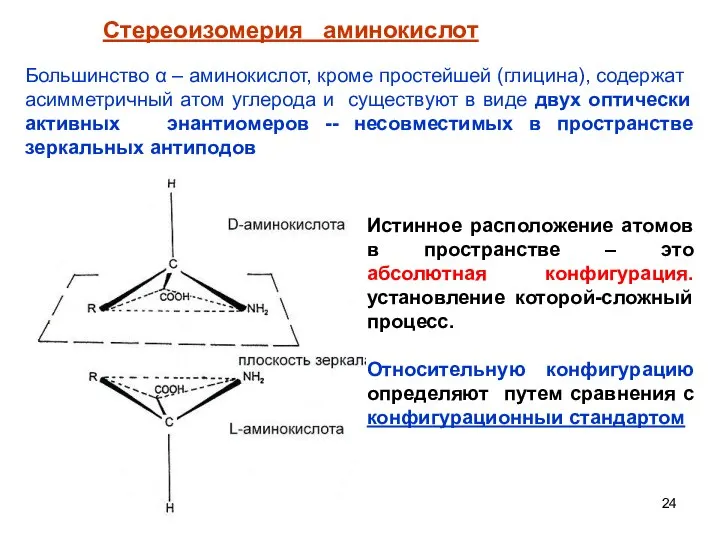
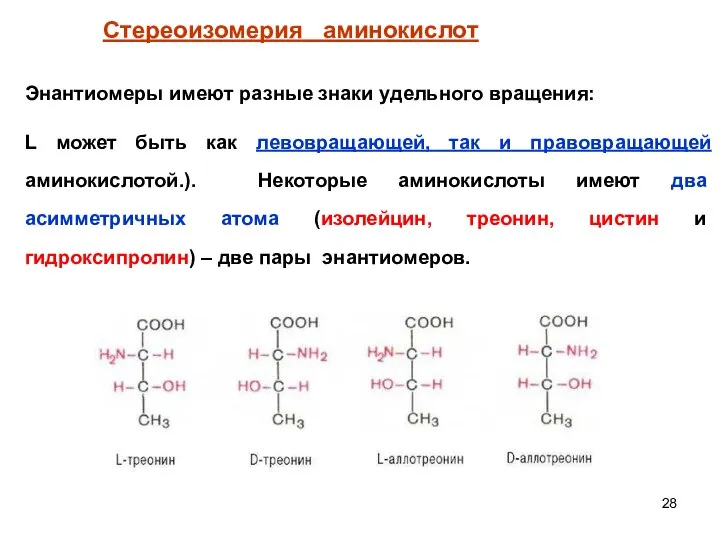
- 24. Стереоизомерия аминокислот Большинство α – аминокислот, кроме простейшей (глицина), содержат асимметричный атом углерода и существуют в
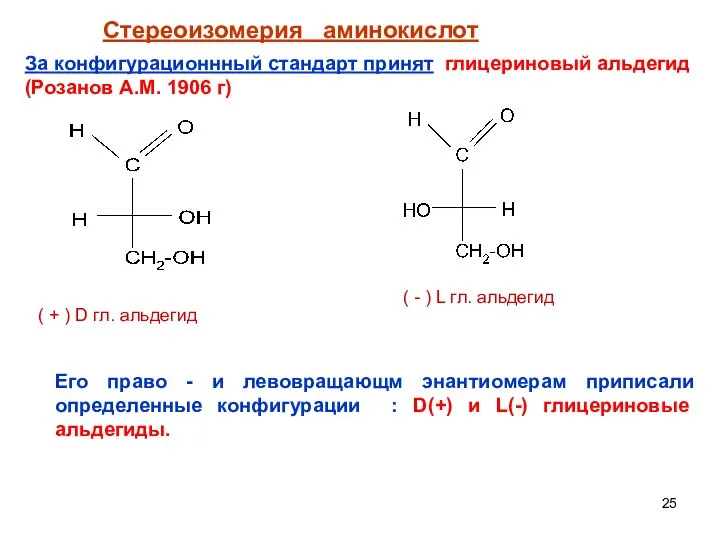
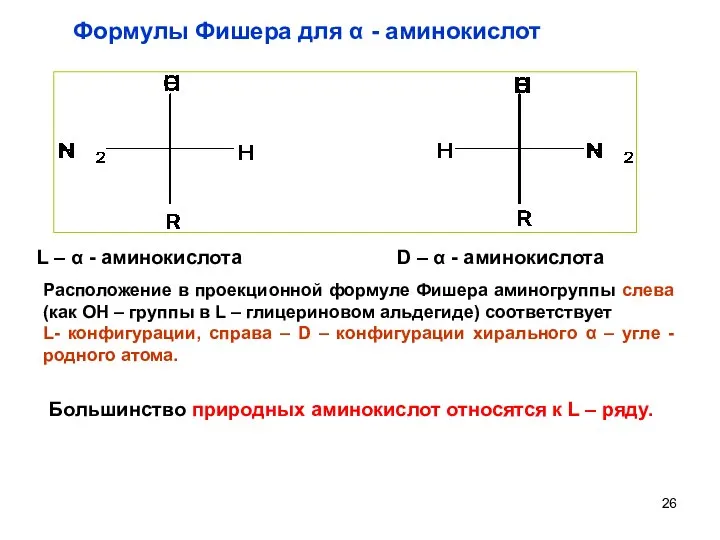
- 25. Стереоизомерия аминокислот За конфигурационнный стандарт принят глицериновый альдегид (Розанов А.М. 1906 г) Его право - и
- 26. L – α - аминокислота D – α - аминокислота Большинство природных аминокислот относятся к L
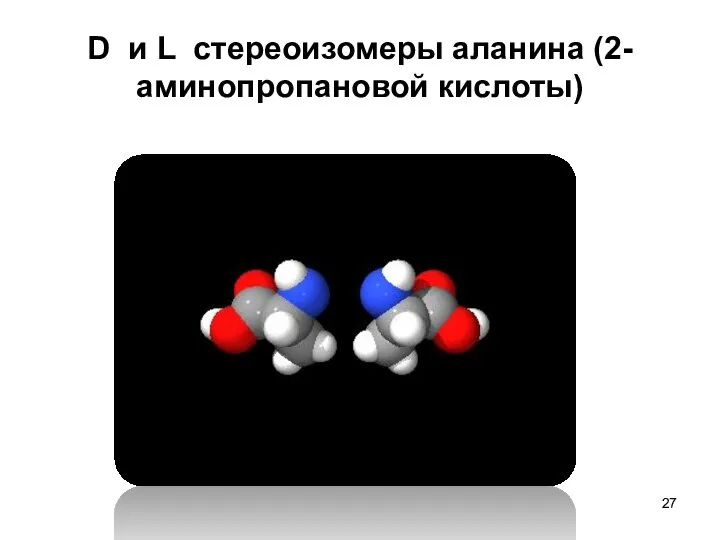
- 27. D и L стереоизомеры аланина (2-аминопропановой кислоты)
- 28. Энантиомеры имеют разные знаки удельного вращения: L может быть как левовращающей, так и правовращающей аминокислотой.). Некоторые
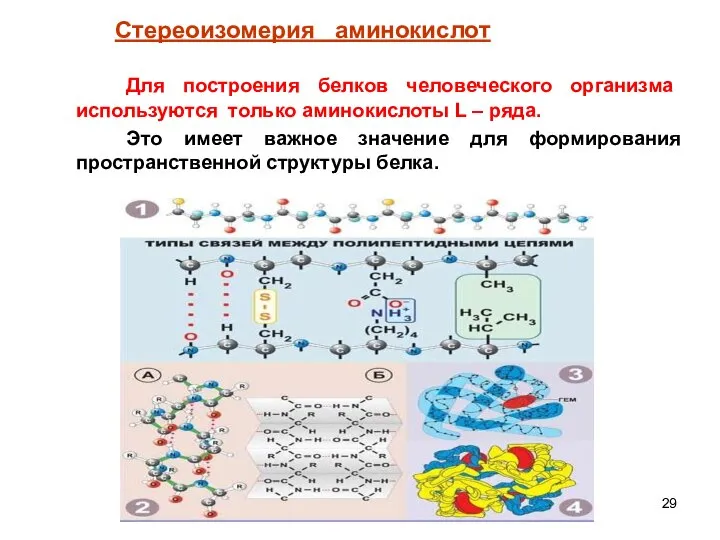
- 29. Для построения белков человеческого организма используются только аминокислоты L – ряда. Это имеет важное значение для
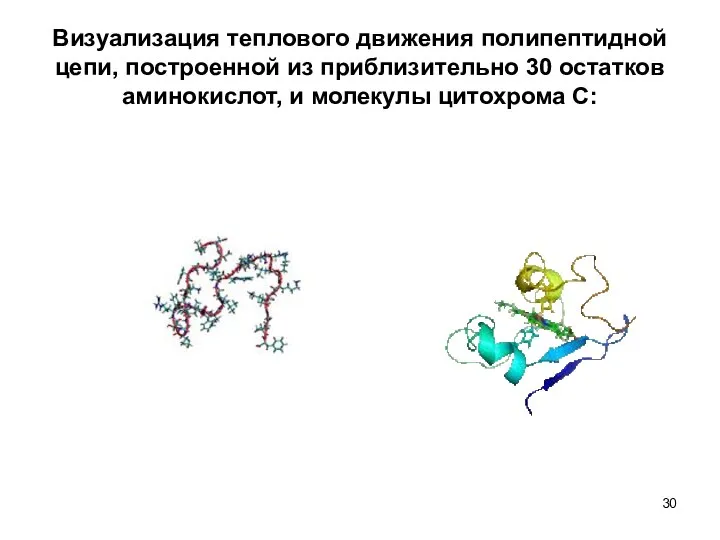
- 30. Визуализация теплового движения полипептидной цепи, построенной из приблизительно 30 остатков аминокислот, и молекулы цитохрома С:
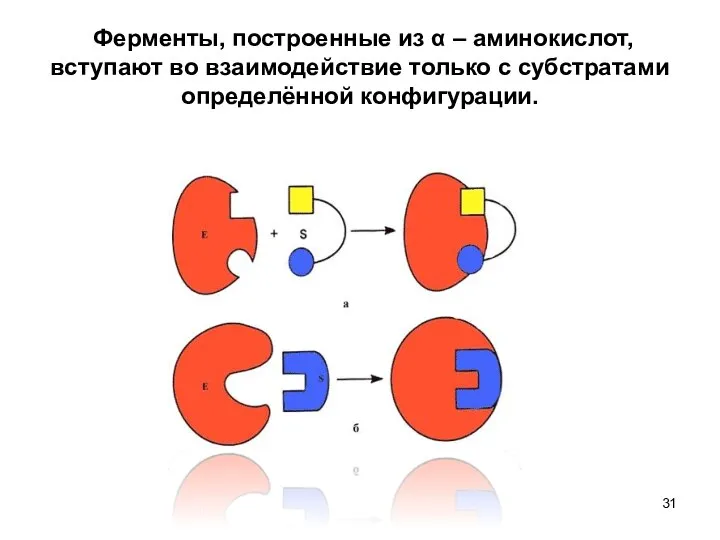
- 31. Ферменты, построенные из α – аминокислот, вступают во взаимодействие только с субстратами определённой конфигурации.
- 32. D – аминокислоты (неприродные) встречаются во многих природных пептидах, образованных с помощью микроорганизмов, в антибиотиках (грамицидин,
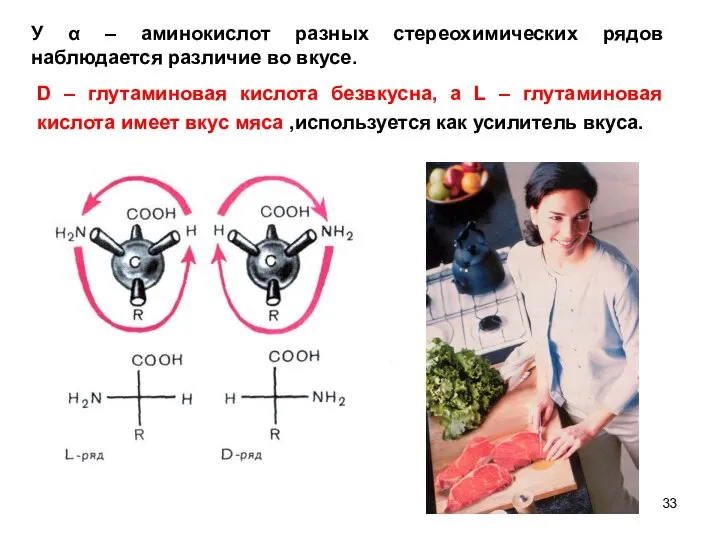
- 33. У α – аминокислот разных стереохимических рядов наблюдается различие во вкусе. D – глутаминовая кислота безвкусна,
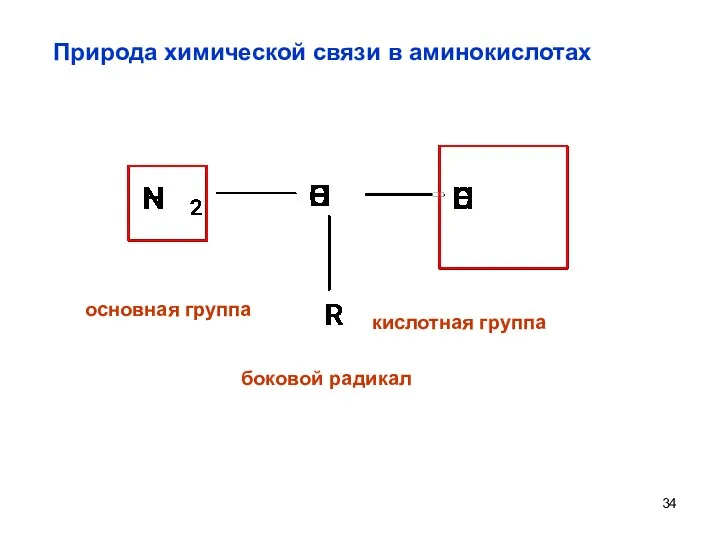
- 34. Природа химической связи в аминокислотах боковой радикал основная группа кислотная группа
- 35. кислотно-основные свойства, то есть амфотерные свойства карбоксильной группы (образование функциональных производных – реакции SN). свойства аминогруппы
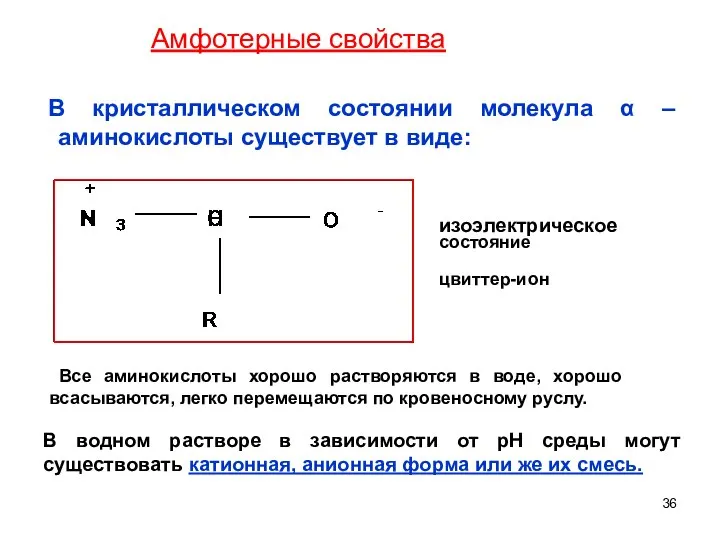
- 36. В кристаллическом состоянии молекула α – аминокислоты существует в виде: изоэлектрическое состояние цвиттер-ион В водном растворе
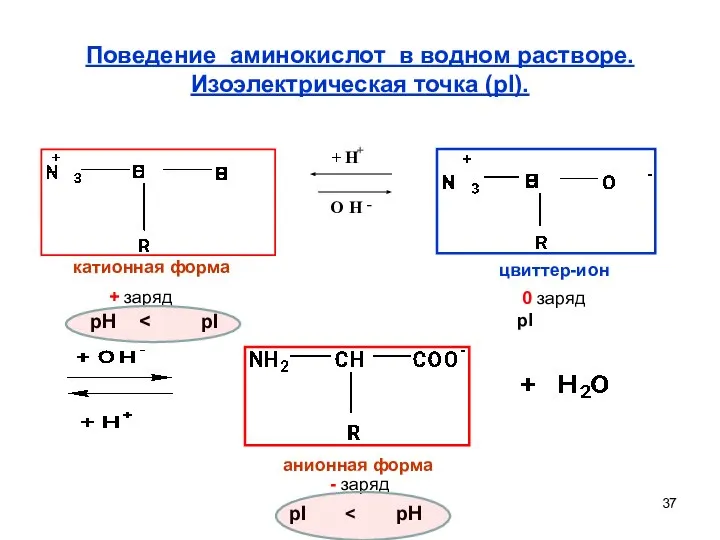
- 37. Поведение аминокислот в водном растворе. Изоэлектрическая точка (pI). катионная форма цвиттер-ион анионная форма + заряд 0
- 38. Поведение аминокислот в водном растворе. Катионная форма +заряд цвиттер-ион 0 заряд анионная форма - заряд pH
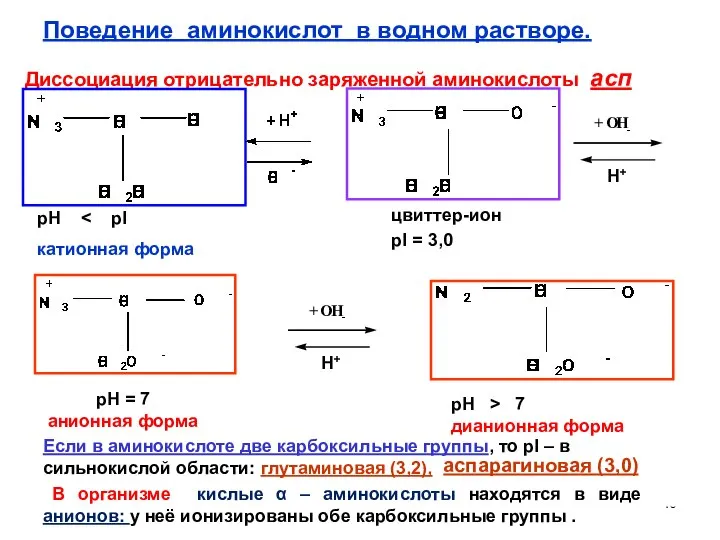
- 39. Для большинства аминокислот pI лежит в слабокислой области. Если в аминокислоте две карбоксильные группы, то pI
- 40. Диссоциация отрицательно заряженной аминокислоты асп цвиттер-ион pI = 3,0 pH = 7 анионная форма pH катионная
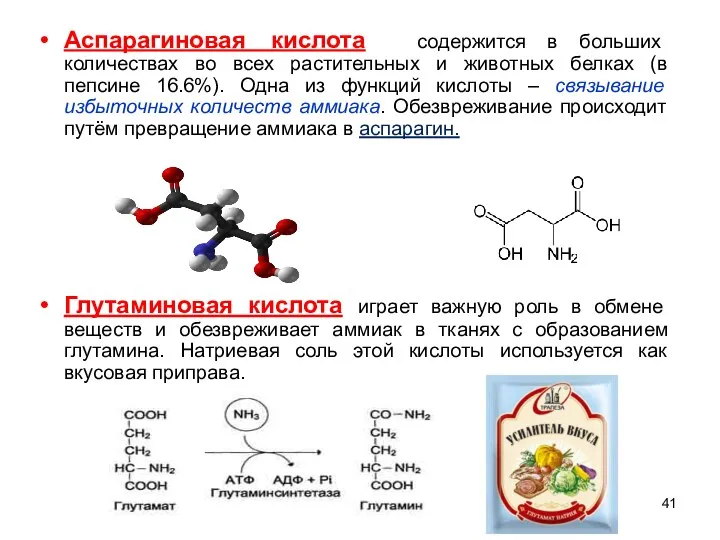
- 41. Аспарагиновая кислота содержится в больших количествах во всех растительных и животных белках (в пепсине 16.6%). Одна
- 42. Поведение аминокислот в водном растворе. Диссоциация положительно заряженной аминокислоты - лизина Если в аминокислоте две аминогруппы,
- 43. Поведение аминокислот в водном растворе. Диссоциация положительно заряженной аминокислоты - лизина Если в аминокислоте две аминогруппы,
- 44. В изоэлектрической точке аминокислота обладает особыми свойствами: минимальной электрофоретической подвижностью минимальной растворимостью максимальным осаждением in vivo
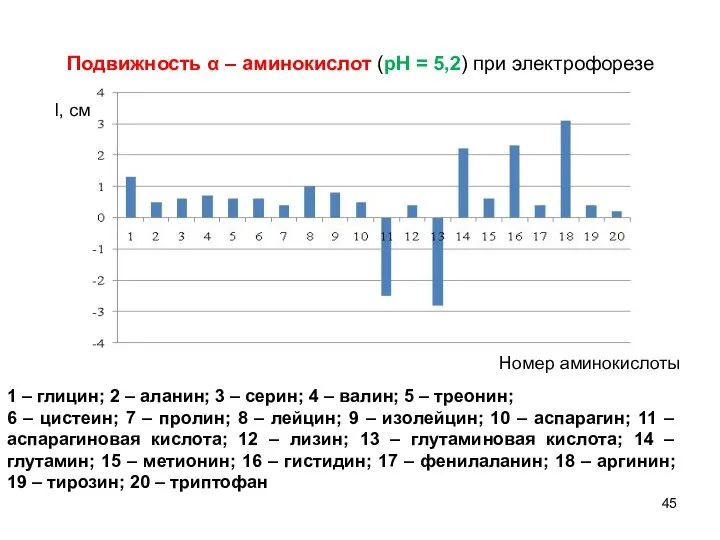
- 45. Подвижность α – аминокислот (рН = 5,2) при электрофорезе l, см Номер аминокислоты 1 – глицин;
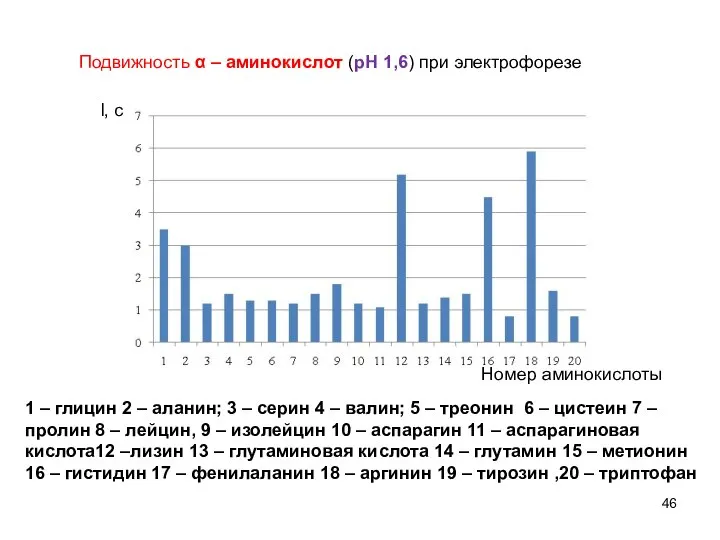
- 46. l, см Подвижность α – аминокислот (рН 1,6) при электрофорезе Номер аминокислоты 1 – глицин 2
- 47. Химические свойства аминокислот
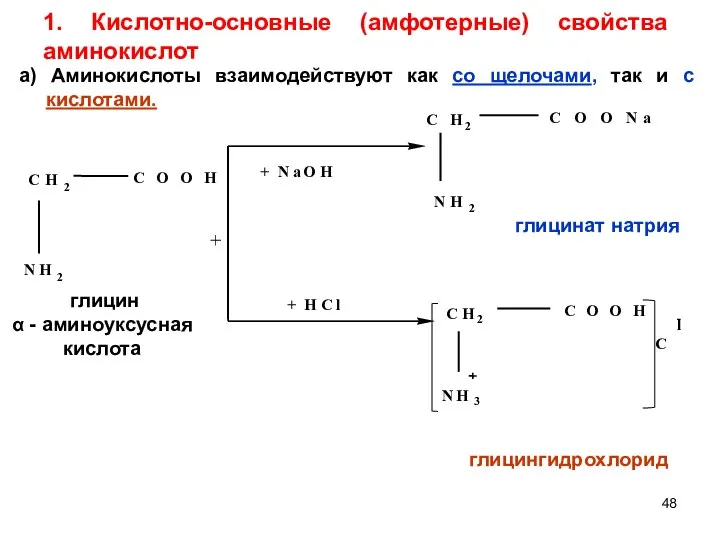
- 48. 1. Кислотно-основные (амфотерные) свойства аминокислот + глицингидрохлорид глицинат натрия глицин α - аминоуксусная кислота а) Аминокислоты
- 49. Важнейшие аминокислоты Глицин не содержит асимметрического углеродного атома, и поэтому в растворах оптически не активен. Глицин
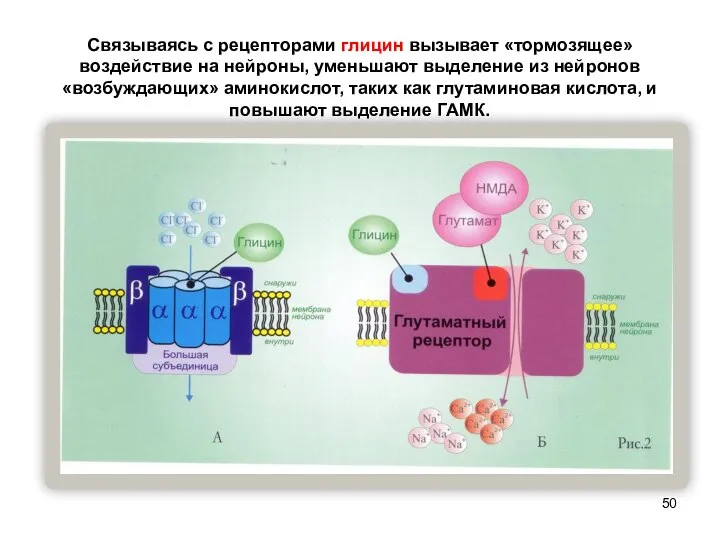
- 50. Связываясь с рецепторами глицин вызывает «тормозящее» воздействие на нейроны, уменьшают выделение из нейронов «возбуждающих» аминокислот, таких
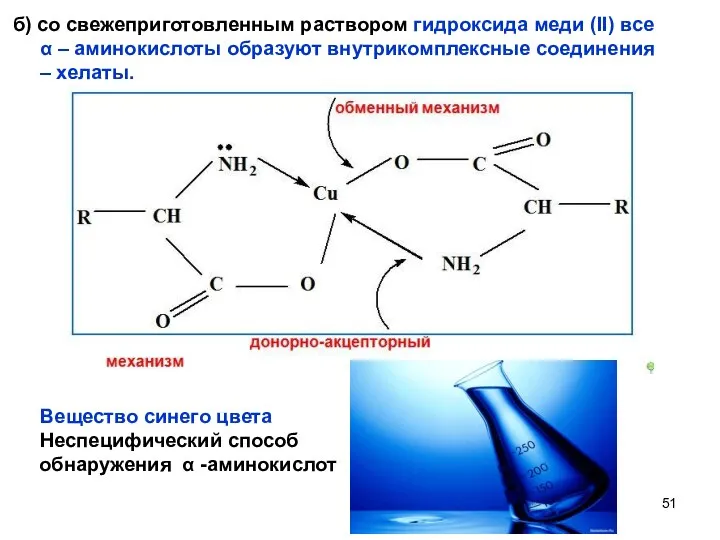
- 51. б) со свежеприготовленным раствором гидроксида меди (II) все α – аминокислоты образуют внутрикомплексные соединения – хелаты.
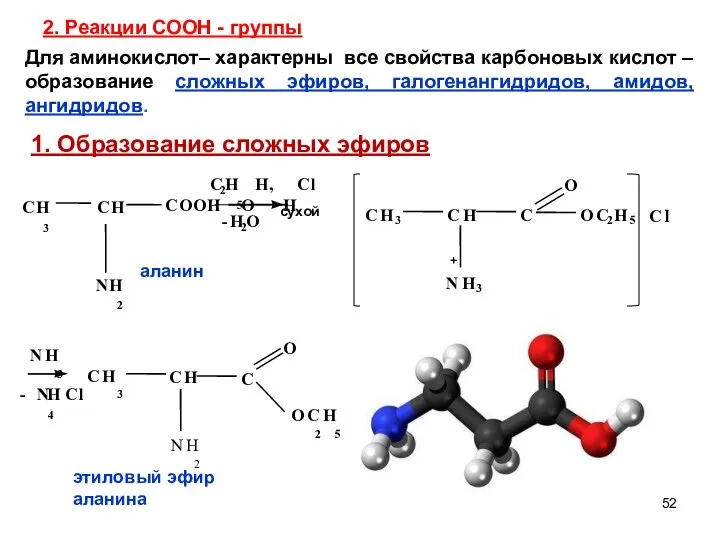
- 52. 2. Реакции СООН - группы O Для аминокислот– характерны все свойства карбоновых кислот – образование сложных
- 53. Применение сложных эфиров Образование сложных эфиров лежит в основе метода разделения α-аминокислот (эфирный метод). Разделение α-аминокислот
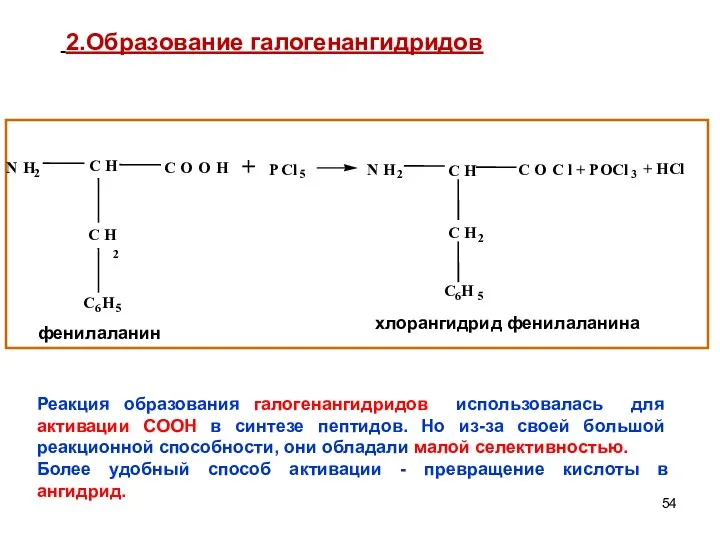
- 54. + 2.Образование галогенангидридов Реакция образования галогенангидридов использовалась для активации СООН в синтезе пептидов. Но из-за своей
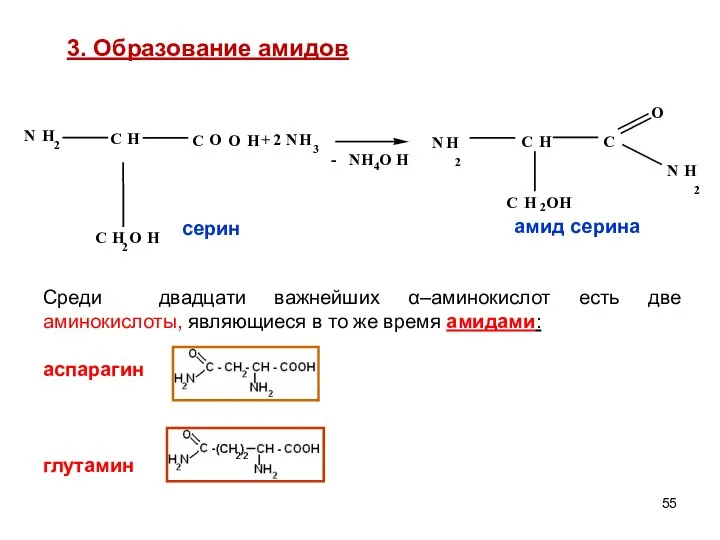
- 55. 3. Образование амидов Среди двадцати важнейших α–аминокислот есть две аминокислоты, являющиеся в то же время амидами:
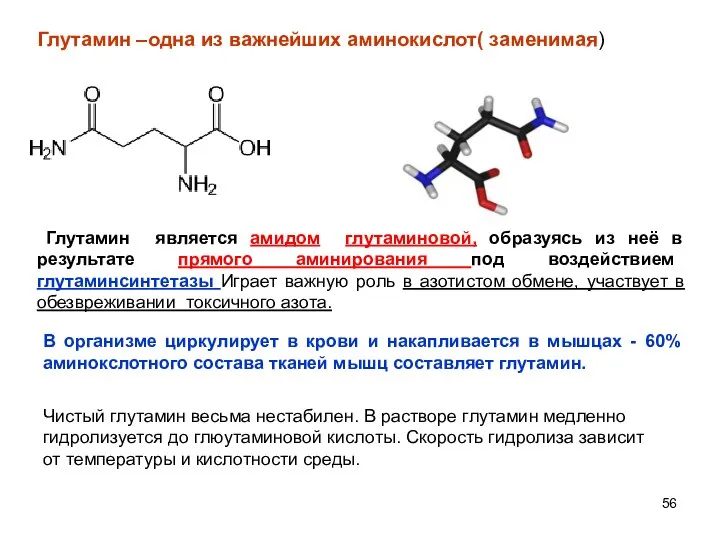
- 56. Глутамин –одна из важнейших аминокислот( заменимая) Чистый глутамин весьма нестабилен. В растворе глутамин медленно гидролизуется до
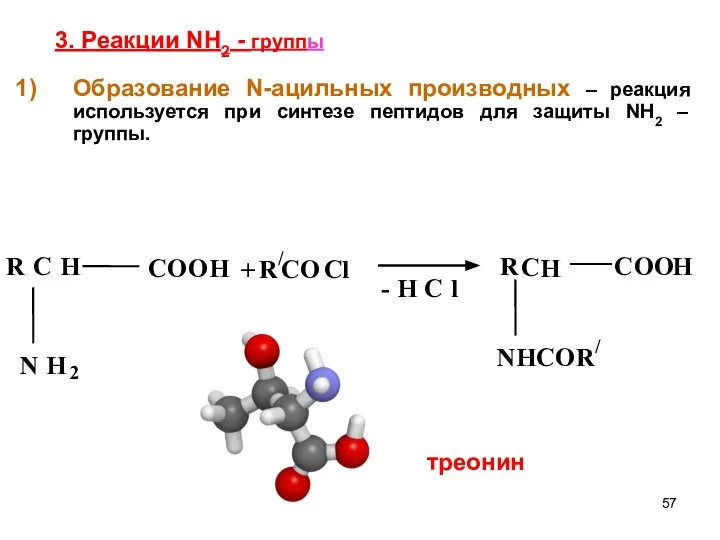
- 57. 3. Реакции NH2 - группы Образование N-ацильных производных – реакция используется при синтезе пептидов для защиты
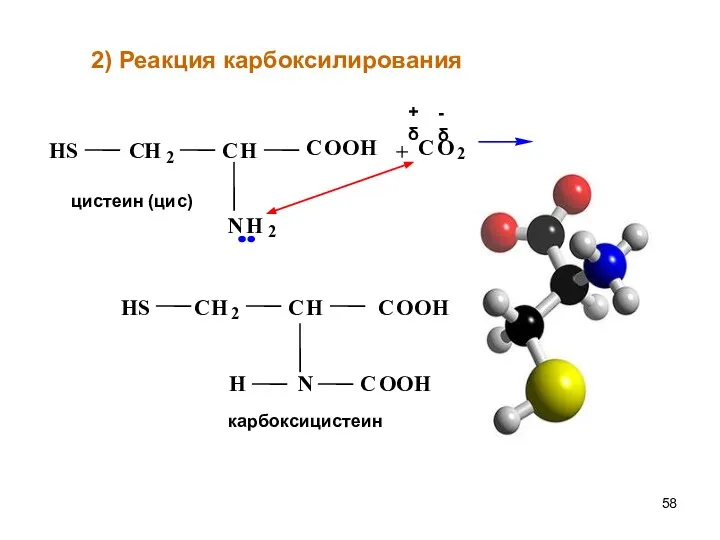
- 58. + 2) Реакция карбоксилирования
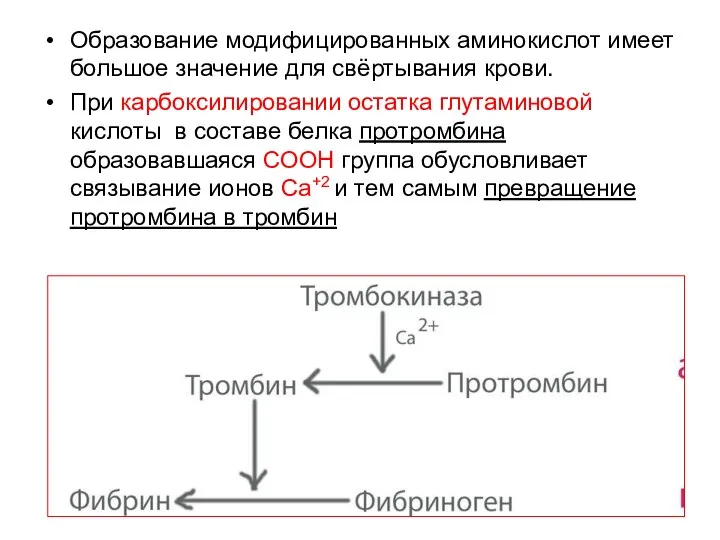
- 59. Образование модифицированных аминокислот имеет большое значение для свёртывания крови. При карбоксилировании остатка глутаминовой кислоты в составе
- 60. Цистеин играет большую роль как восстановитель и как источник серы. Один из самых мощных антиоксидантов Окисляясь,
- 61. 4.Биохимические превращения аминокислот α – аминокислоты и белки не запасаются организмами и должны поступать пищей. Основным
- 62. Эндогенным источником α – аминокислот –– служат тканевые белки организма. Они, подвергаясь метаболизму, освобождают входящие в
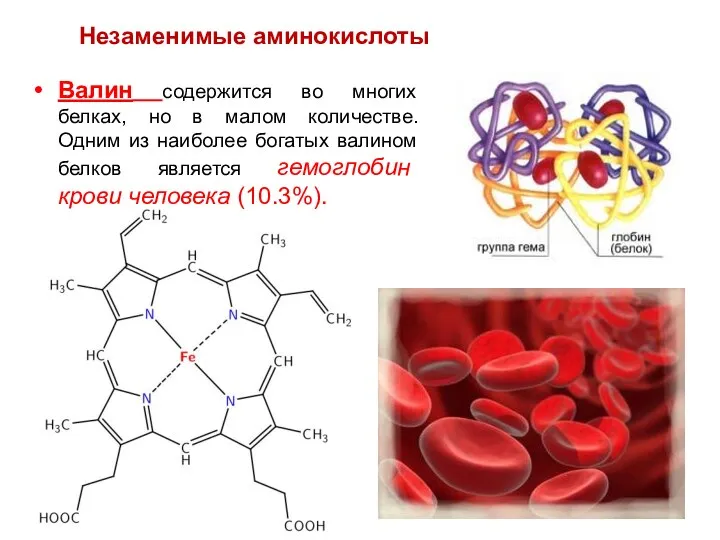
- 63. Валин содержится во многих белках, но в малом количестве. Одним из наиболее богатых валином белков является
- 64. Лейцин содержится во всех белках в значительном количестве. В заметном количестве содержится в прорастающем зерне, при
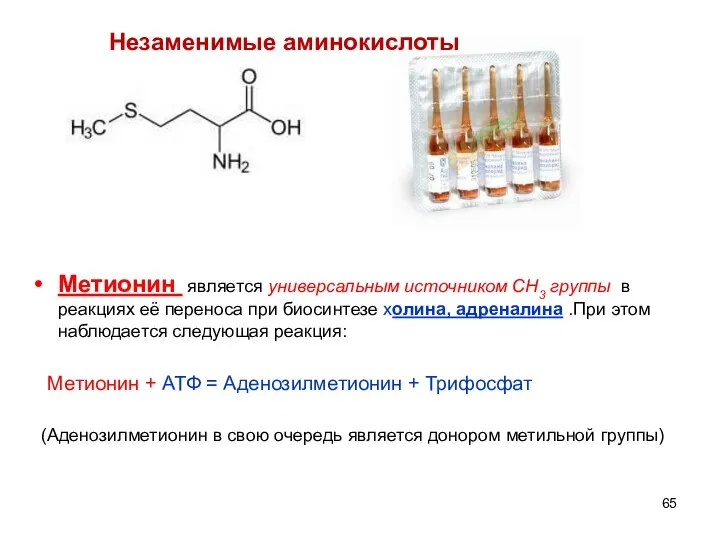
- 65. Незаменимые аминокислоты Метионин является универсальным источником СН3 группы в реакциях её переноса при биосинтезе холина, адреналина
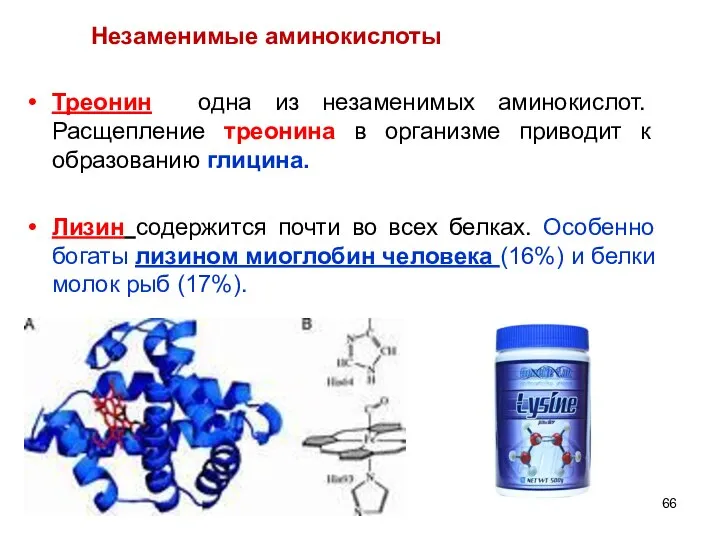
- 66. Треонин одна из незаменимых аминокислот. Расщепление треонина в организме приводит к образованию глицина. Лизин содержится почти
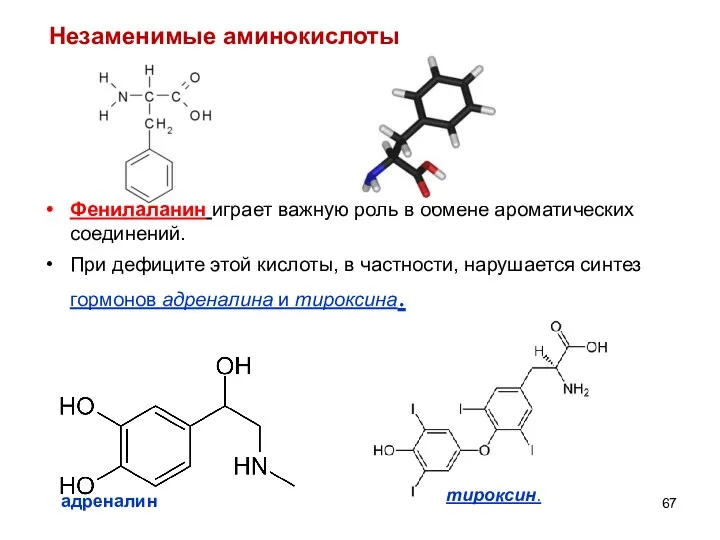
- 67. Фенилаланин играет важную роль в обмене ароматических соединений. При дефиците этой кислоты, в частности, нарушается синтез
- 68. Наряду с заменимыми и незаменимыми аминокислотами существуют так называемые частично заменимые аминокислоты. Появление этой группы связано
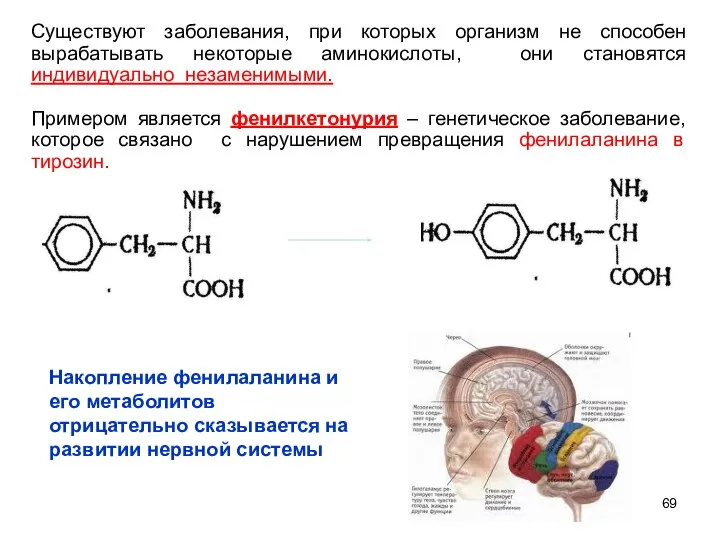
- 69. Существуют заболевания, при которых организм не способен вырабатывать некоторые аминокислоты, они становятся индивидуально незаменимыми. Примером является
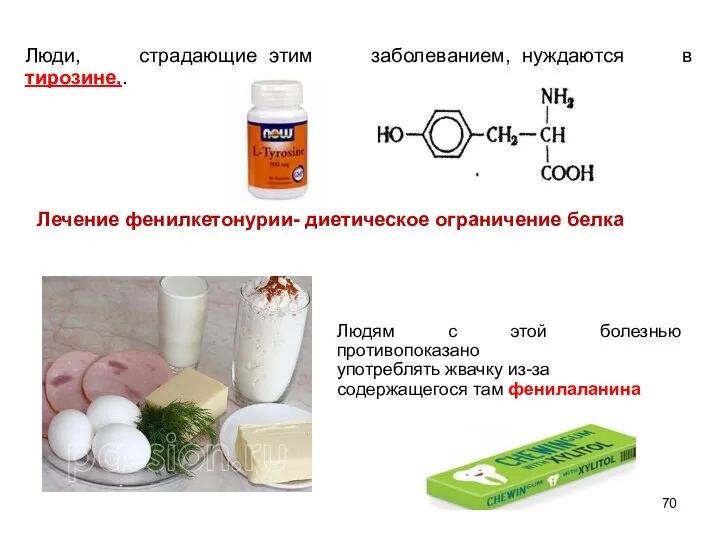
- 70. Люди, страдающие этим заболеванием, нуждаются в тирозине,. Лечение фенилкетонурии- диетическое ограничение белка Людям с этой болезнью
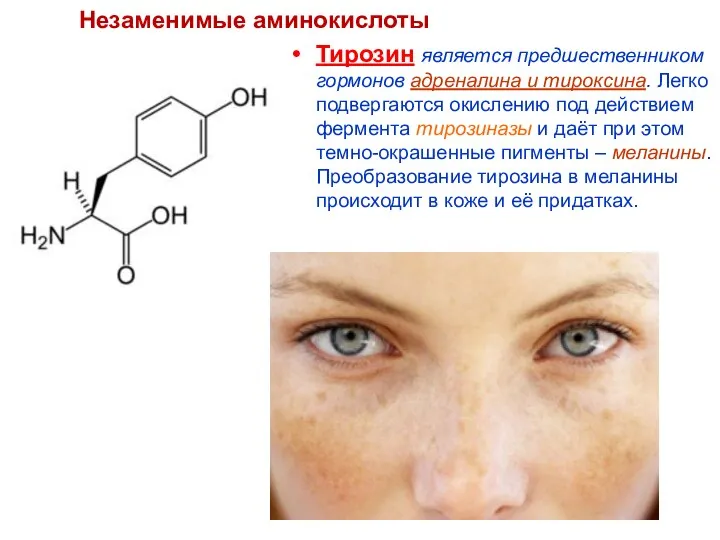
- 71. Тирозин является предшественником гормонов адреналина и тироксина. Легко подвергаются окислению под действием фермента тирозиназы и даёт
- 72. Большинство реакций превращения аминокислот протекает в печени. Для каждой аминокислоты существует индивидуальный способ обмена, но всё
- 73. 1) Декарбоксилирование – образование биогенных аминов из α - аминокислот ( лиз, цис, три, сер, асп)
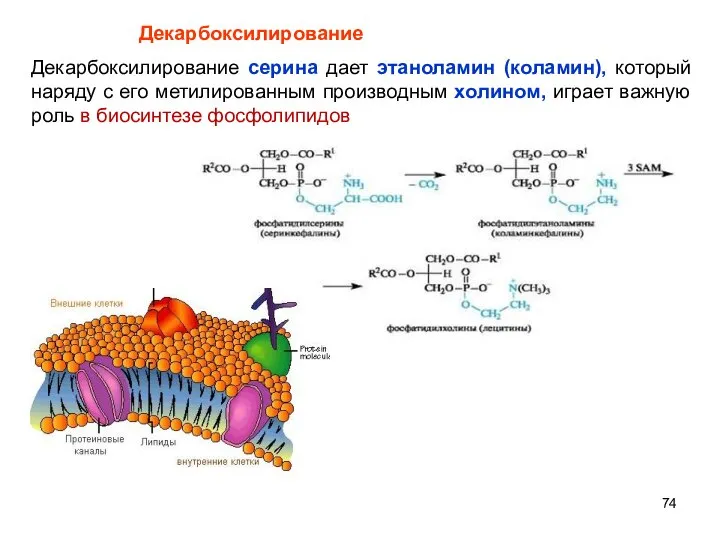
- 74. Декарбоксилирование серина дает этаноламин (коламин), который наряду с его метилированным производным холином, играет важную роль в
- 75. гистамин гистидин Биологически важные химические реакции-декарбоксилирование В животных тканях с высокой скоростью протекает декарбоксилирование гистидина под
- 76. Гистамин имеет отношение к аллергическим реакциям в организме.
- 77. Биологически важные химические реакции - декарбоксилирование При декарбоксилировании лизина и орнитина, а также при гниении белков
- 78. Биологически важные химические реакции - трансаминирование 2.Трансаминирование - это основной путь биосинтеза заменимых α - аминокислот
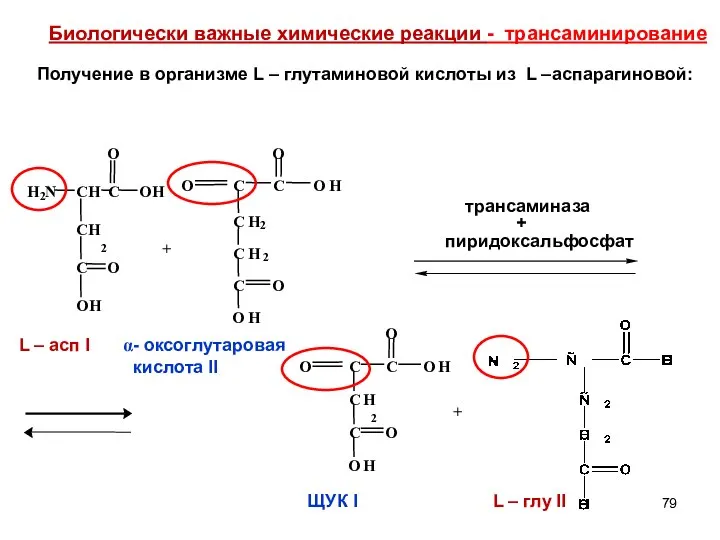
- 79. + + - оксоглутаровая кислота II Биологически важные химические реакции - трансаминирование Получение в организме L
- 80. Биологически важные химические реакции - трансаминирование Процесс трансаминирования является связующим звеном между метаболизмом белков (аминокислоты) и
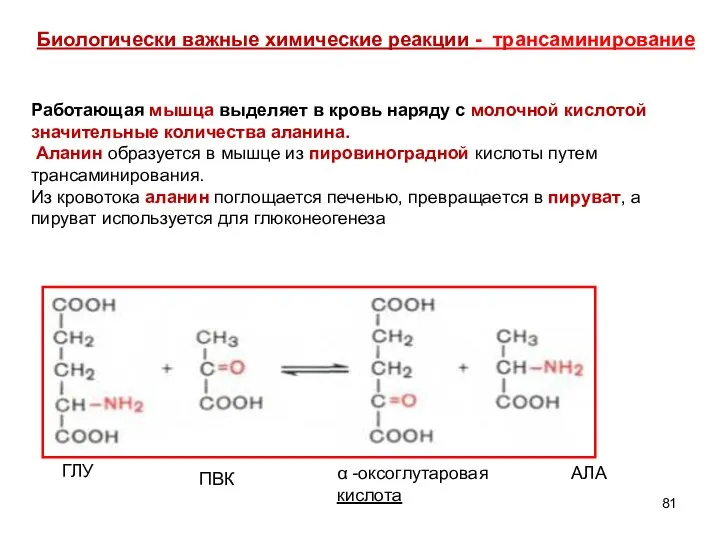
- 81. Биологически важные химические реакции - трансаминирование ГЛУ ПВК α -оксоглутаровая кислота АЛА Работающая мышца выделяет в
- 82. неокислительное под действием Е окислительное Е - оксидаза в цикл мочевины П В К гидролитическое восстановительное
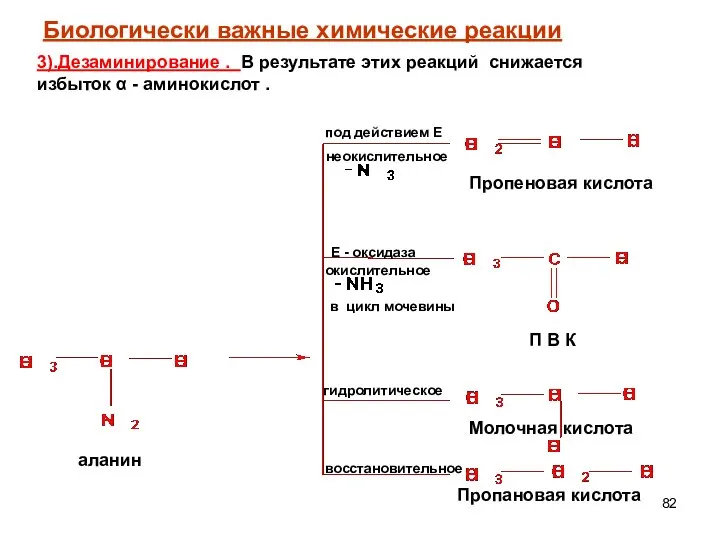
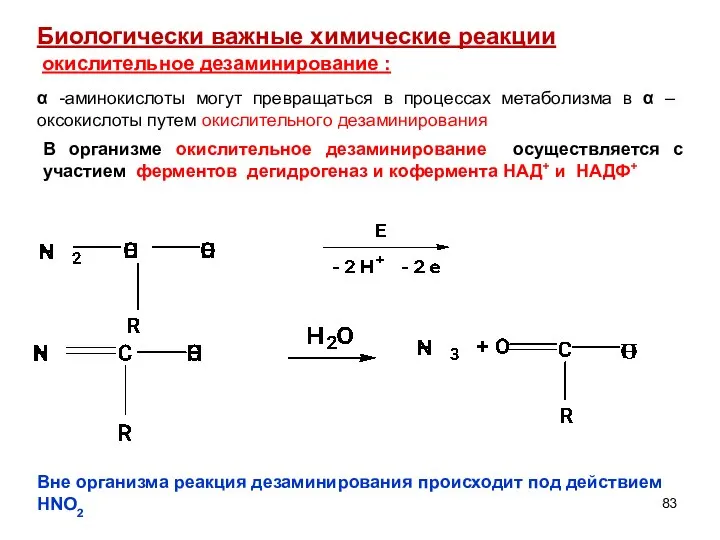
- 83. окислительное дезаминирование : Биологически важные химические реакции α -аминокислоты могут превращаться в процессах метаболизма в α
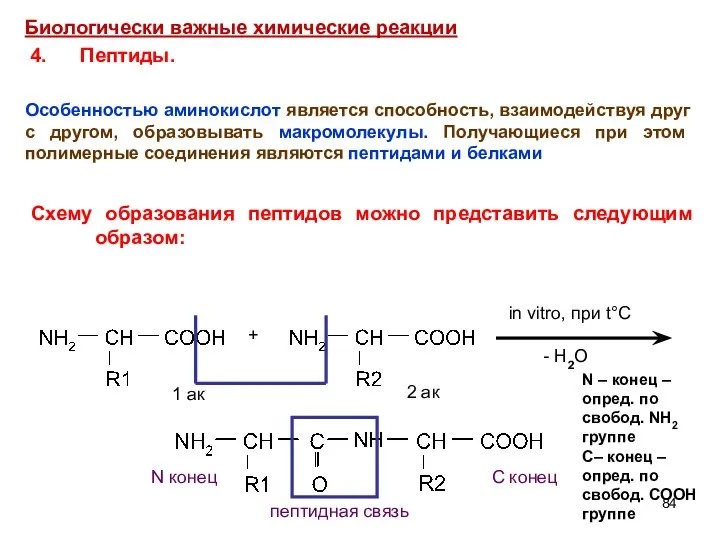
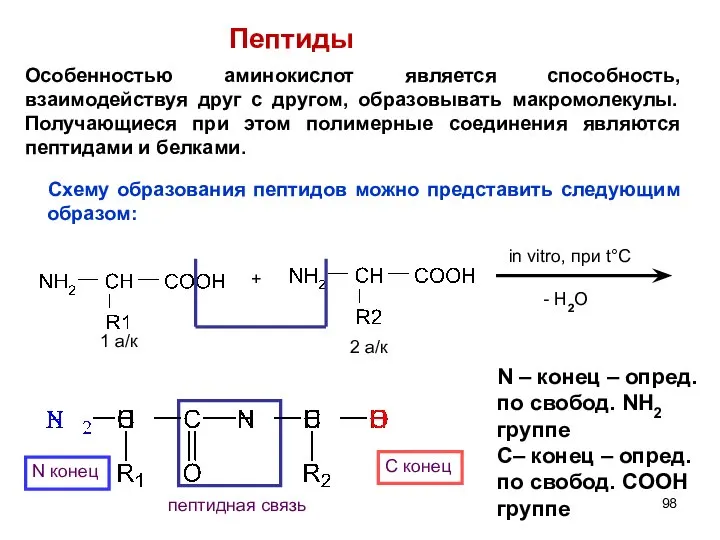
- 84. + in vitro, при t°C - H2O 1 ак 2 ак N конец С конец пептидная
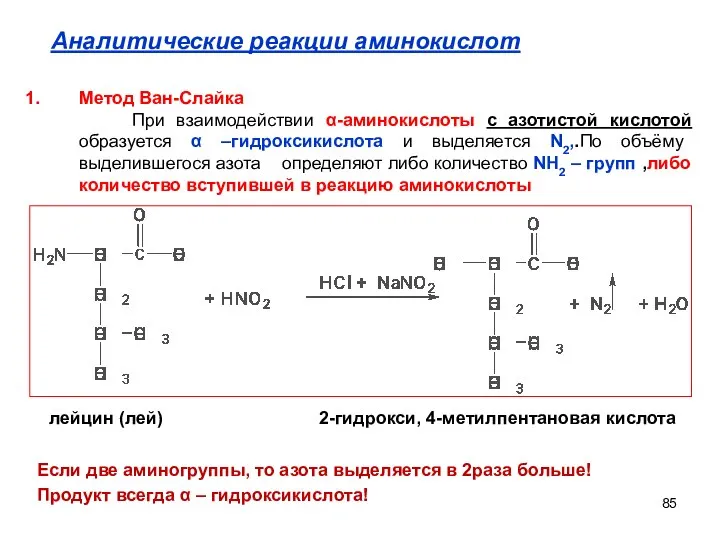
- 85. Аналитические реакции аминокислот лейцин (лей) 2-гидрокси, 4-метилпентановая кислота Если две аминогруппы, то азота выделяется в 2раза
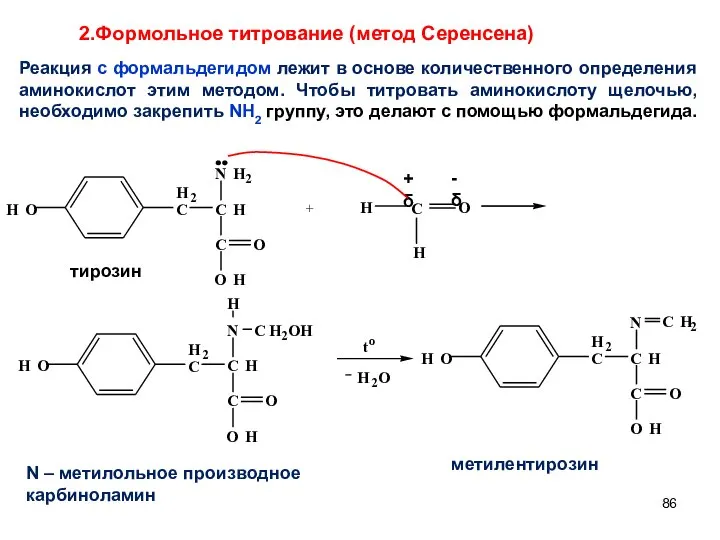
- 86. + 2.Формольное титрование (метод Серенсена) Реакция с формальдегидом лежит в основе количественного определения аминокислот этим методом.
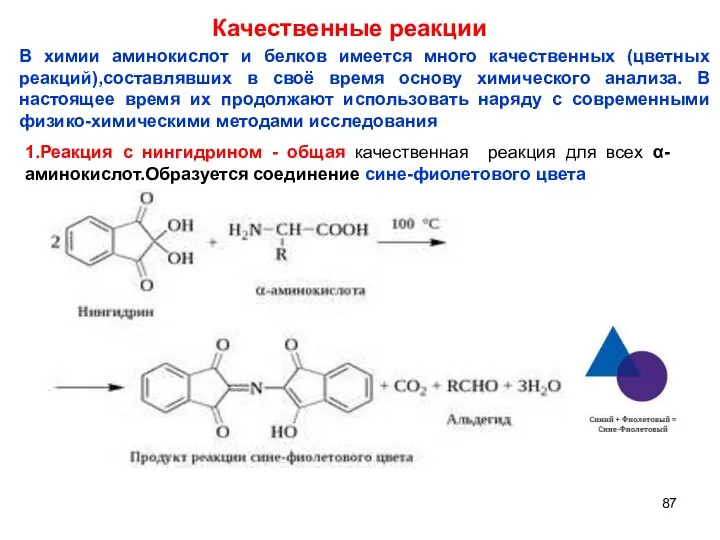
- 87. Качественные реакции В химии аминокислот и белков имеется много качественных (цветных реакций),составлявших в своё время основу
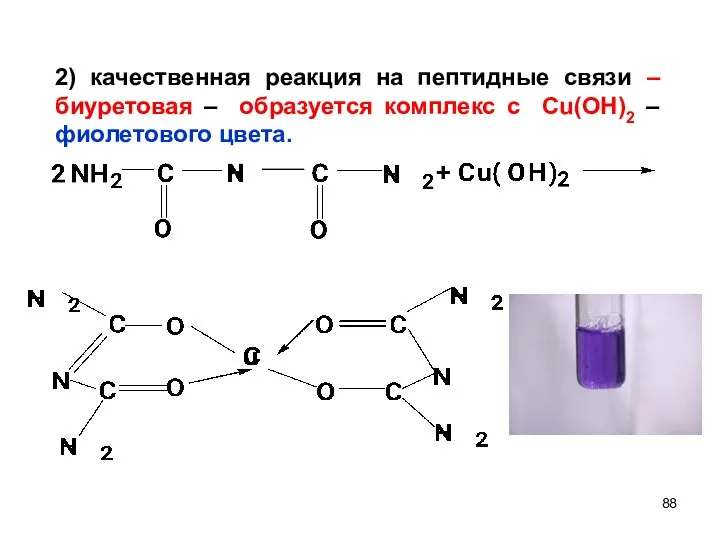
- 88. 2) качественная реакция на пептидные связи – биуретовая – образуется комплекс с Сu(OH)2 – фиолетового цвета.
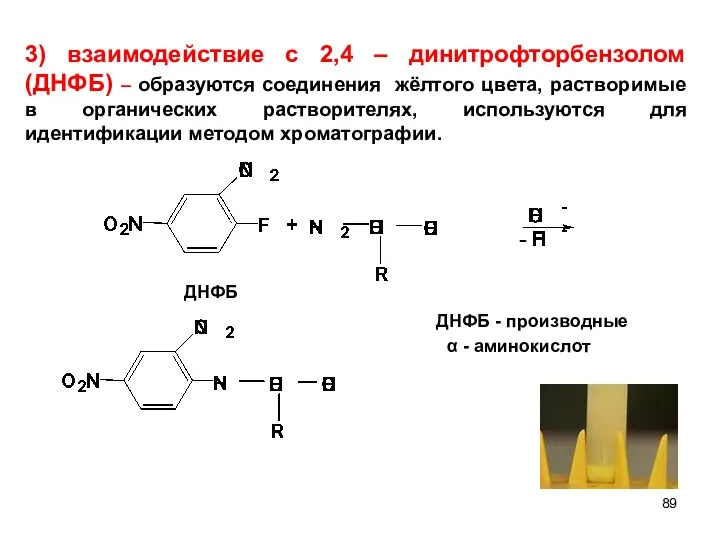
- 89. ДНФБ - 3) взаимодействие с 2,4 – динитрофторбензолом (ДНФБ) – образуются соединения жёлтого цвета, растворимые в
- 90. чёрн цвет 4.Реакция обнаружения цистеина При нагревании раствора белка с ацетатом свинца в щелочной среде образуется
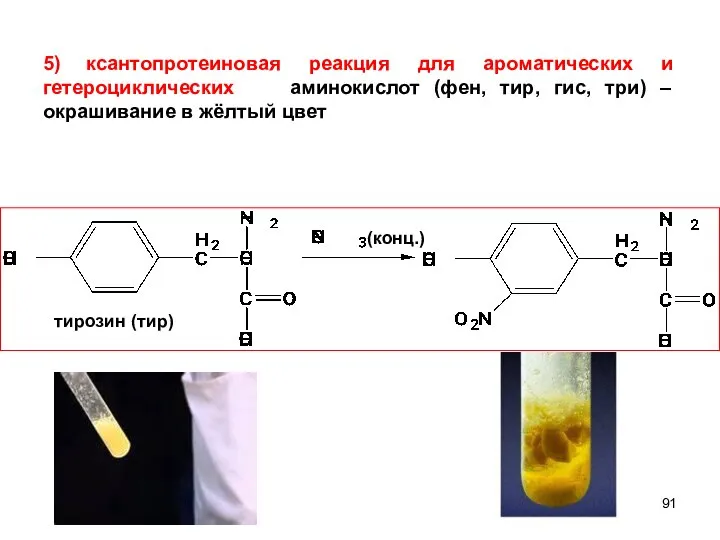
- 91. тирозин (тир) (конц.) 5) ксантопротеиновая реакция для ароматических и гетероциклических аминокислот (фен, тир, гис, три) –
- 92. Физико-химические методы исследования и анализа аминокислот. Хроматография.Электрофорез Хроматография — один из современных методов разделения очистки, выделения
- 93. Разделение и анализ аминокислот и их производных используются при определении аминокислотного состава белков, пептидов, а также
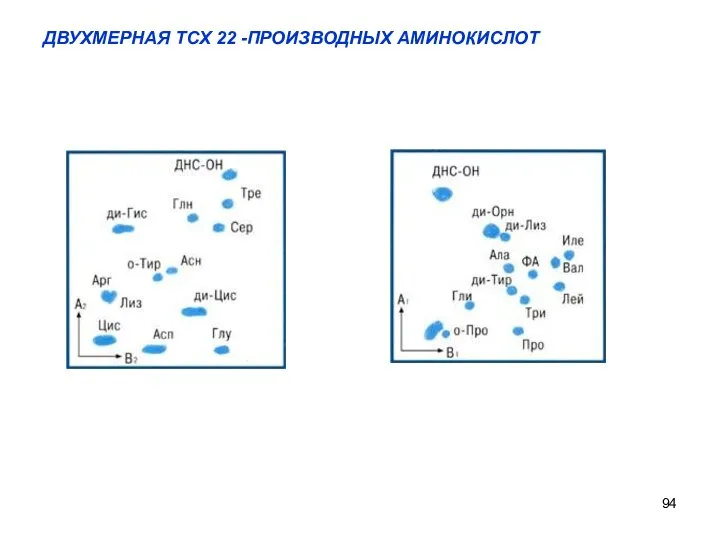
- 94. ДВУХМЕРНАЯ ТСХ 22 -ПРОИЗВОДНЫХ АМИНОКИСЛОТ
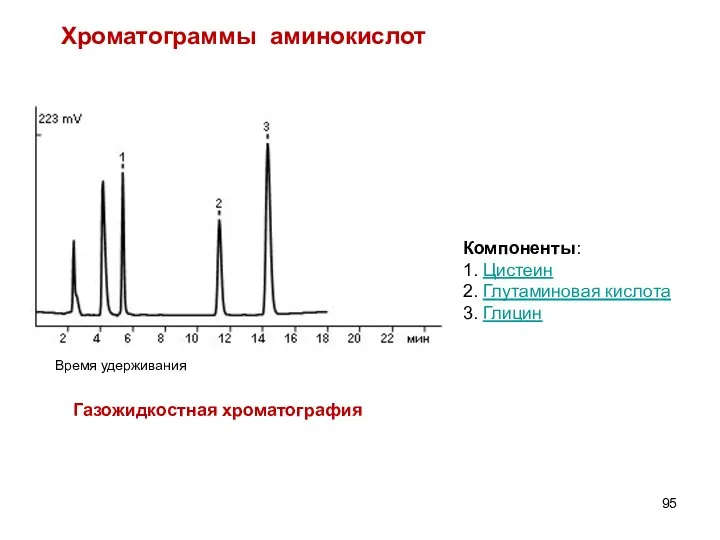
- 95. Компоненты: 1. Цистеин 2. Глутаминовая кислота 3. Глицин Хроматограммы аминокислот Газожидкостная хроматография Время удерживания
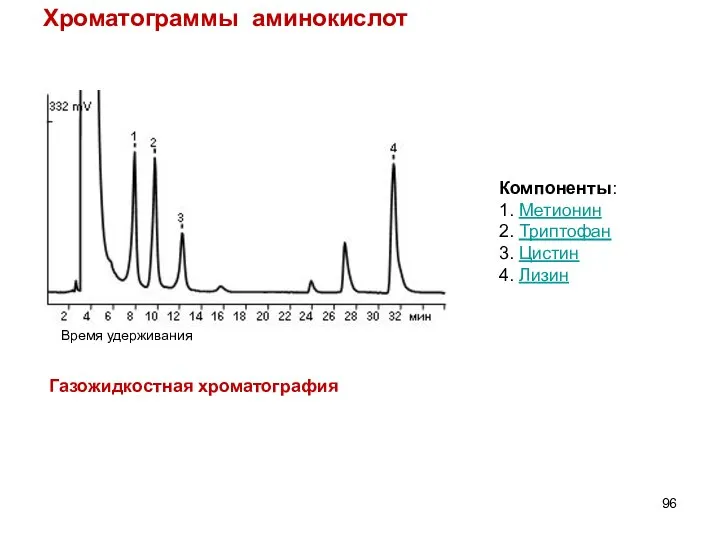
- 96. Хроматограммы аминокислот Компоненты: 1. Метионин 2. Триптофан 3. Цистин 4. Лизин Газожидкостная хроматография Время удерживания
- 97. Электрофорез Электрофорез служит для анализа, разделения и очистки биополимеров (главным образом белков), бактериальных клеток, вирусов, а
- 98. + in vitro, при t°C - H2O 1 а/к 2 а/к N конец С конец пептидная
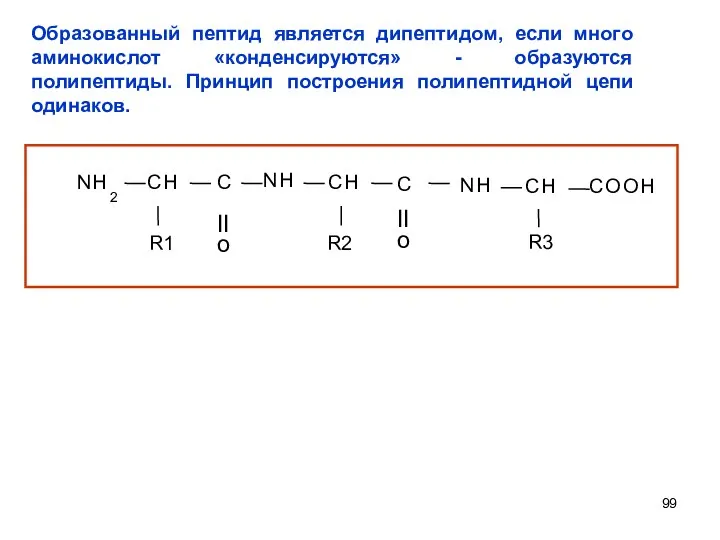
- 99. Образованный пептид является дипептидом, если много аминокислот «конденсируются» - образуются полипептиды. Принцип построения полипептидной цепи одинаков.
- 100. Каскадный синтез пептидов. (ала-гли) Все операции - в определенной, запрограммированной последовательности . Защита NH2 группы I
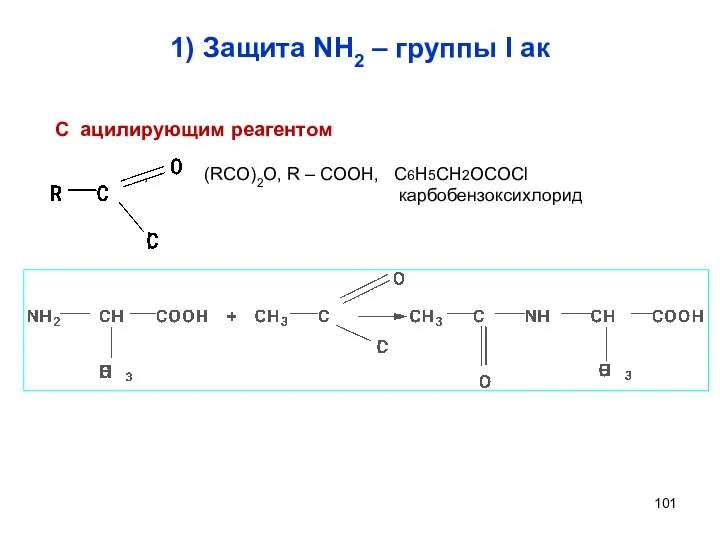
- 101. 1) Защита NH2 – группы I ак С ацилирующим реагентом , (RCO)2O, R – COOH, C6H5CH2OCOCl
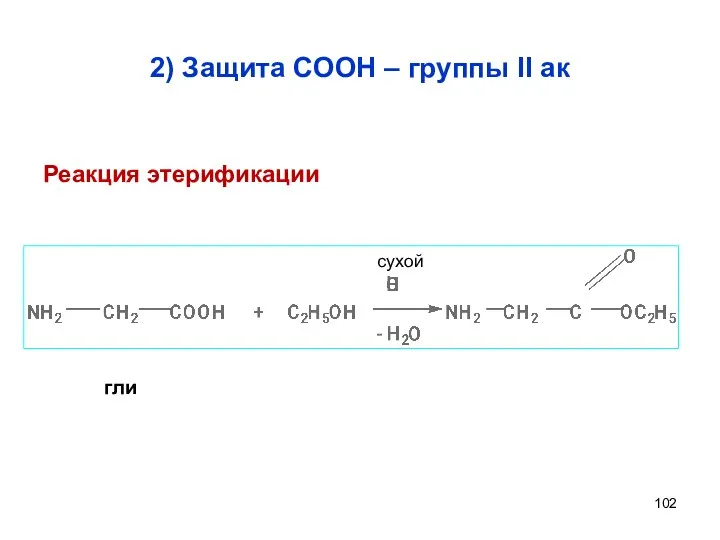
- 102. 2) Защита СООН – группы II ак сухой гли Реакция этерификации
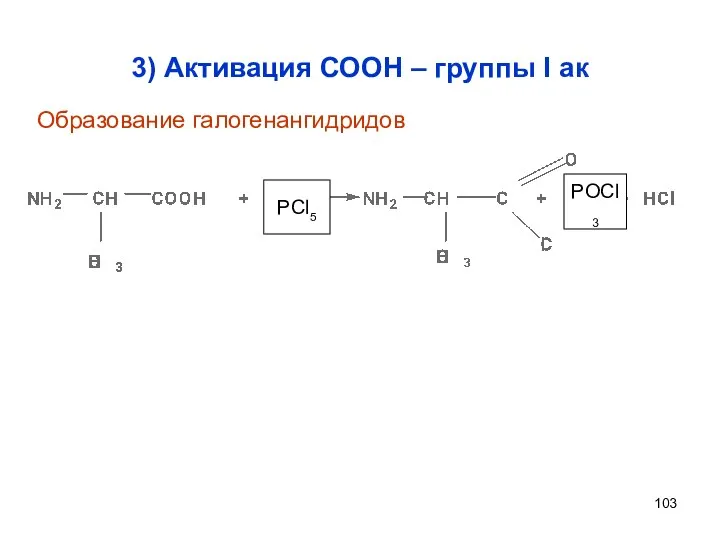
- 103. 3) Активация СООН – группы I ак PCl5 POCl3 Образование галогенангидридов
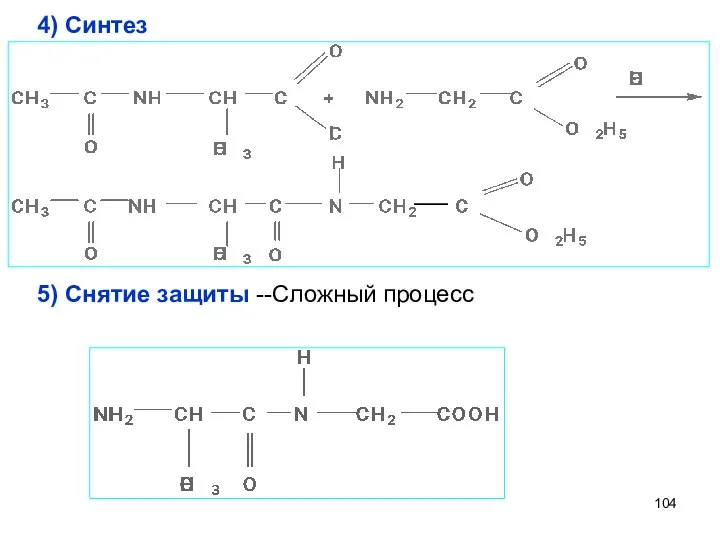
- 104. 4) Синтез 5) Снятие защиты --Сложный процесс
- 106. Скачать презентацию






























 Сульфур Негативній вплив сульфуровмісних сполук
Сульфур Негативній вплив сульфуровмісних сполук  Beryllium
Beryllium Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Спирты. Строение. Физические и химические свойства. Спиртами (или алканолами ) называются органические вещества , молекулы кото
Спирты. Строение. Физические и химические свойства. Спиртами (или алканолами ) называются органические вещества , молекулы кото Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4)
Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4) Комплексиметрическое титрование. (Лекция 12)
Комплексиметрическое титрование. (Лекция 12) Золото
Золото Конкурс проектов-презентаций «История химии»
Конкурс проектов-презентаций «История химии» Типы химических реакций в органической химии
Типы химических реакций в органической химии Штучні і синтетичні волокна
Штучні і синтетичні волокна  Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности
Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности ВИТАМИН C (аскорбиновая кислота) Подготовили: Клевакина Наталья-8-б, Белый Алексей – 8-б Руководитель: Новикова Т.Ю.
ВИТАМИН C (аскорбиновая кислота) Подготовили: Клевакина Наталья-8-б, Белый Алексей – 8-б Руководитель: Новикова Т.Ю. Теория растворов (лекция 2)
Теория растворов (лекция 2) Важнейшие классы неорганических соединений Школа № 279 г. Санкт-Петербург Е. В Переверзева
Важнейшие классы неорганических соединений Школа № 279 г. Санкт-Петербург Е. В Переверзева  Все о витамине С и его определение в лекарственных растениях и продуктах питания
Все о витамине С и его определение в лекарственных растениях и продуктах питания Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Катализдің организмнің тіршілігіндегі рөлі
Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Катализдің организмнің тіршілігіндегі рөлі Гидроксид железа
Гидроксид железа Кольорові метали
Кольорові метали  Алканы. Строение алканов
Алканы. Строение алканов Ниобий. Физиологическое действие
Ниобий. Физиологическое действие Период становления химии
Период становления химии Глицерин
Глицерин Углерод и 4 группа
Углерод и 4 группа Антигистаминные препараты
Антигистаминные препараты К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Карбонильные соединения
Карбонильные соединения Качественные реакции (часть 5)
Качественные реакции (часть 5)