Содержание
- 2. Азотсодержащие соединения
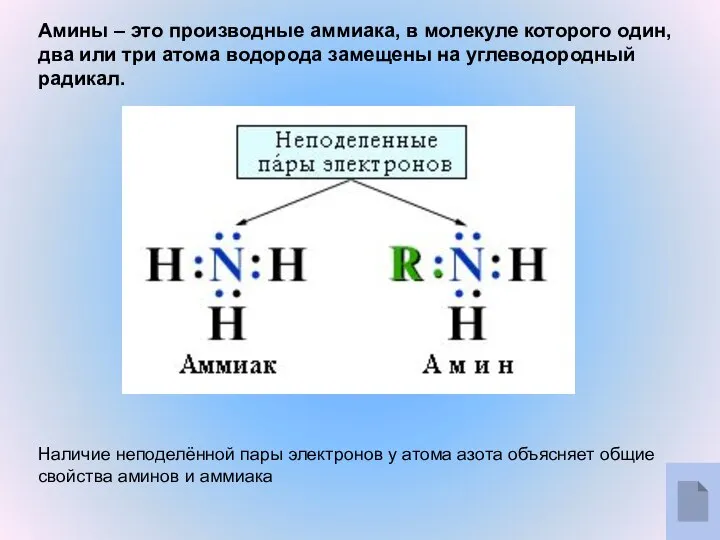
- 3. Амины – это производные аммиака, в молекуле которого один, два или три атома водорода замещены на
- 4. Модель молекулы метиламина
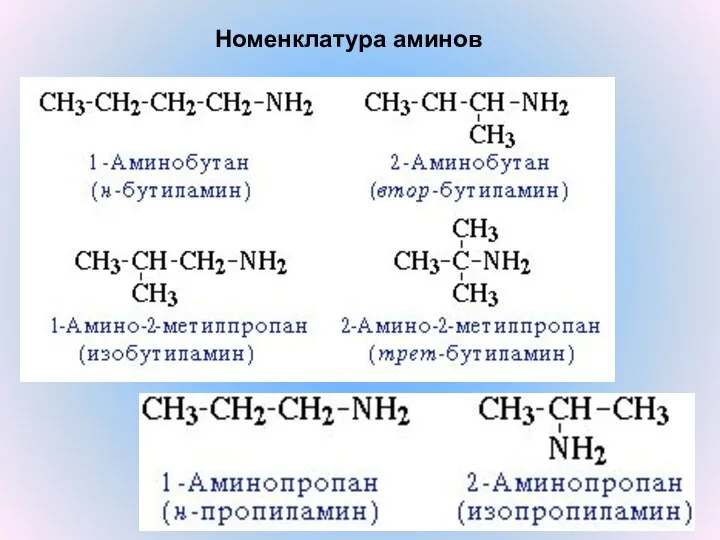
- 6. Номенклатура аминов
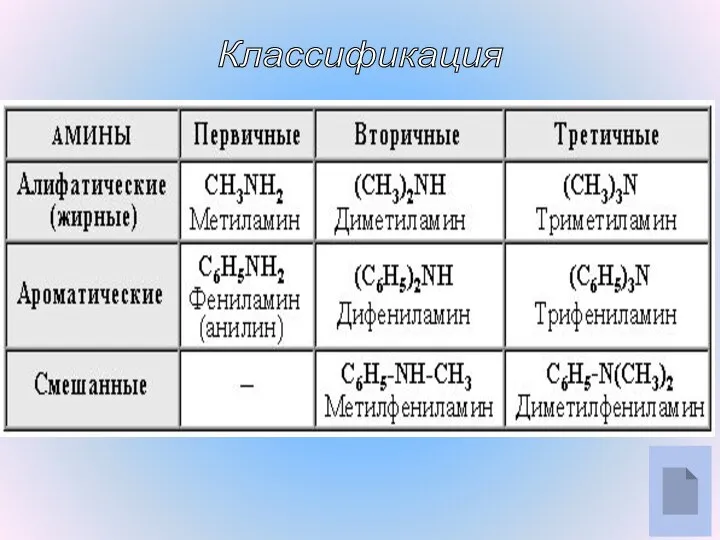
- 7. Классификация
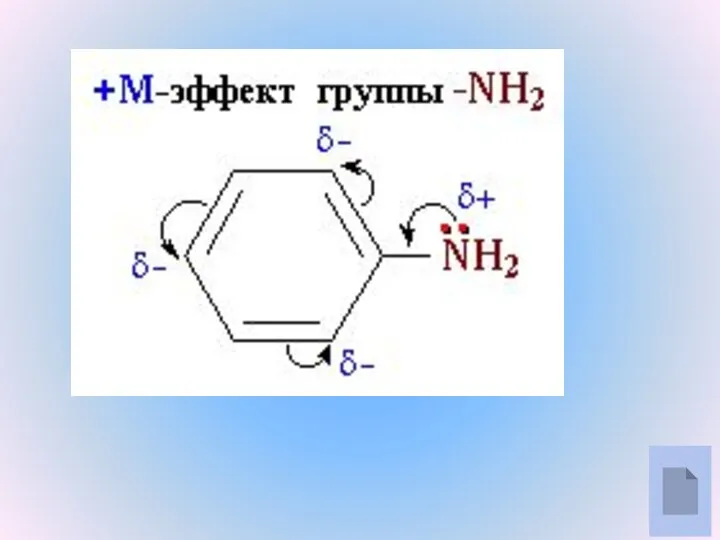
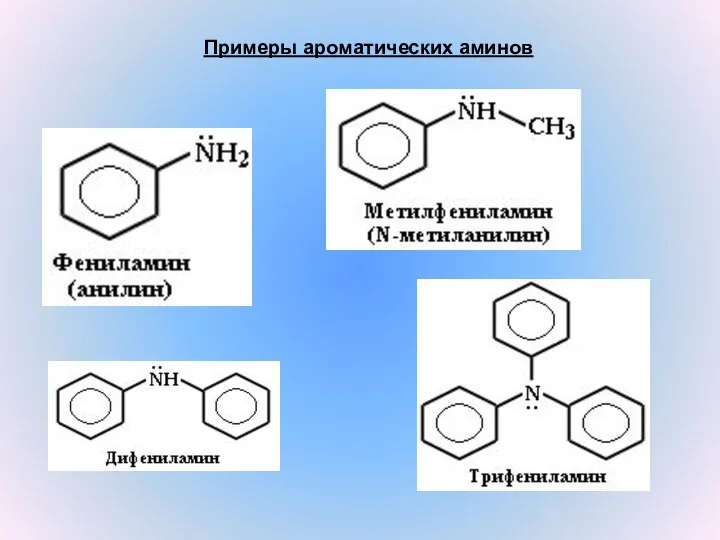
- 8. Примеры ароматических аминов
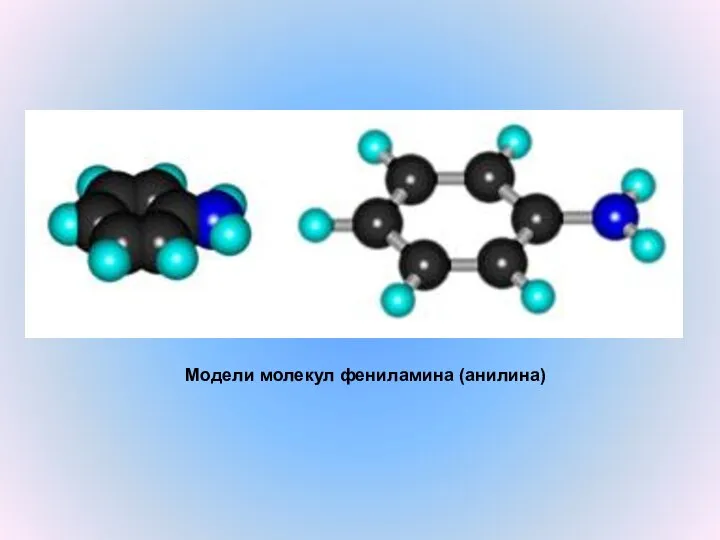
- 9. Модели молекул фениламина (анилина)
- 10. Структурная изомерия - углеродного скелета, начиная с С4H9NH2 - положения аминогруппы, начиная с С3H7NH2 - изомерия
- 11. Физические свойства аминов При обычной температуре только низшие жирные амины CH3NH2, (CH3)2NH, (CH3)3N – газы (с
- 12. Химические свойства аминов: Взаимодействие с кислотами Взаимодействие с водой Реакции окисления
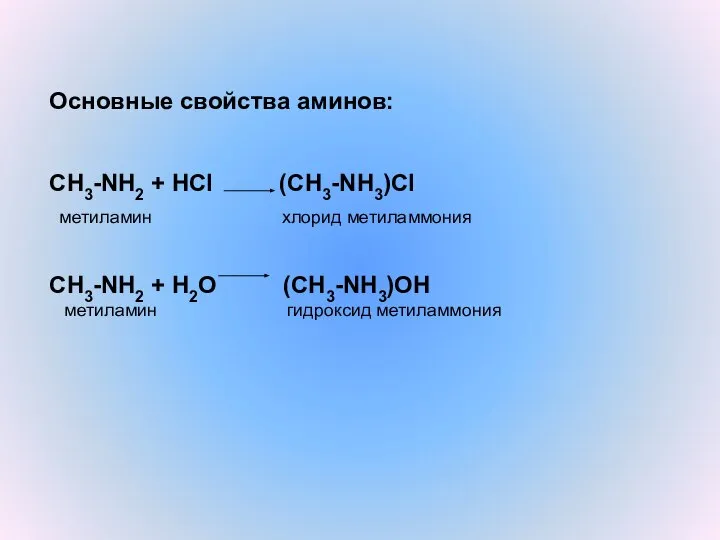
- 13. Основные свойства аминов: CH3-NH2 + HCl (CH3-NH3)Cl метиламин хлорид метиламмония CH3-NH2 + H2O (CH3-NH3)OH метиламин гидроксид
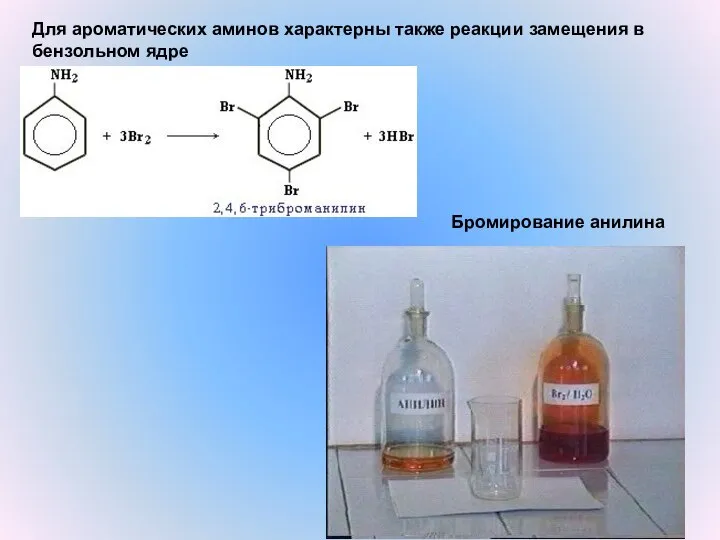
- 14. Бромирование анилина Для ароматических аминов характерны также реакции замещения в бензольном ядре
- 15. Амины способны окисляться с образованием различных продуктов, строение которых зависит от типа амина и условий реакции.
- 16. Получение аминов Амины получают из галогеноалканов и аммиака. Анилин в промышленности получают по реакции Зинина: C6H5NO2
- 18. Скачать презентацию







 Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Шкала рН
Шкала рН Тотығутотықсыздану титрлеу әдістері. Дәріс № 7
Тотығутотықсыздану титрлеу әдістері. Дәріс № 7 Мас-спектр кластерів вуглецю
Мас-спектр кластерів вуглецю Предельные углеводороды
Предельные углеводороды Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени
Обобщающий урок по теме: «Основные классы неорганических соединений. Генетическая связь между классами неорганических соединени Металлы и сплавы -материал для древних и современных олимпийских наград.
Металлы и сплавы -материал для древних и современных олимпийских наград. Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Алюминий в природе
Алюминий в природе Моделирование (7 класс)
Моделирование (7 класс) Топливо и топливосжигающие устройства. Искусственные виды топлив. Газификация твердого топлива
Топливо и топливосжигающие устройства. Искусственные виды топлив. Газификация твердого топлива Региональная металлогения
Региональная металлогения Термический анализ
Термический анализ Расчет ректификационной колонны
Расчет ректификационной колонны Дисперсные
Дисперсные  Дисперсные системы
Дисперсные системы Органічні розчинники. Їх застосування
Органічні розчинники. Їх застосування Химическая энергия
Химическая энергия Управління якістю лікарських засобів у фармацевтичній галузі
Управління якістю лікарських засобів у фармацевтичній галузі Биохимия почек и мочи. (Лекция 10)
Биохимия почек и мочи. (Лекция 10) Промышленные типы месторождений железа
Промышленные типы месторождений железа Дисперсные системы
Дисперсные системы Соли. Названия и классификация солей
Соли. Названия и классификация солей Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ galogeny
galogeny Cоляная кислота и ее соли
Cоляная кислота и ее соли Производство азотной кислоты
Производство азотной кислоты МОУ Квитокская средняя общеобразовательная школа. УРОК ХИМИИ. 11 КЛАСС. Химия и производство. Учитель: Левицкая Лариса Виктор
МОУ Квитокская средняя общеобразовательная школа. УРОК ХИМИИ. 11 КЛАСС. Химия и производство. Учитель: Левицкая Лариса Виктор