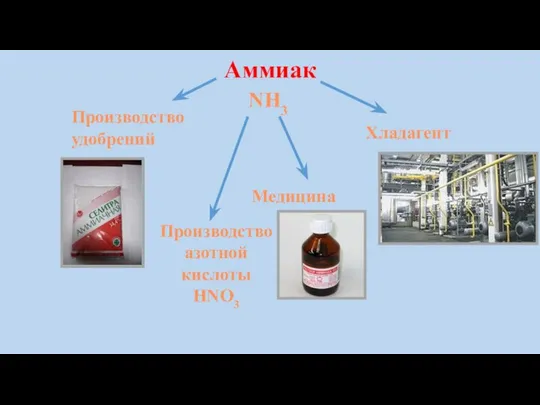
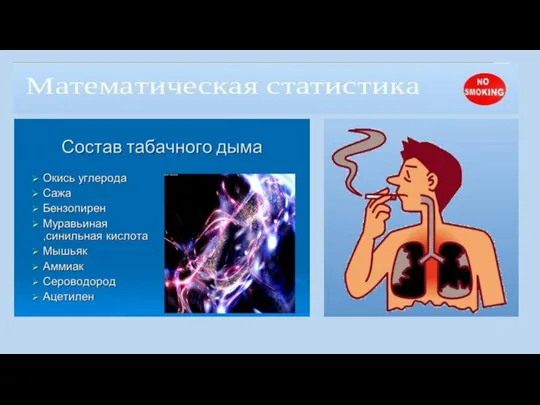
Аммиак опасен при вдыхании. При остром отравлении аммиак поражает глаза
и дыхательные пути, при высоких концентрациях возможен смертельный исход. Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред. При контакте с кожей — жгучая боль, отек, ожег с пузырями.
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
При попадании аммиака в желудок надо выпить несколько стаканов теплой воды с добавлением одной чайной ложки столового уксуса на стакан воды и вызвать рвоту.











 Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Полиэтилен - термопластичный полимер этилена
Полиэтилен - термопластичный полимер этилена Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение A quantum computer
A quantum computer Презентация по Химии "Определение геометрических размеров молекул изомеров октана" - скачать смотреть
Презентация по Химии "Определение геометрических размеров молекул изомеров октана" - скачать смотреть  Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть
Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть  Идеальный газ. Основное уравнение молекулярно-кинетической теории газов
Идеальный газ. Основное уравнение молекулярно-кинетической теории газов Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия
Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия Дать характеристику новому классу органических веществ
Дать характеристику новому классу органических веществ Химия и физика полимеров. Молекулярная структура полимера. Надмолекулярная структура полимеров
Химия и физика полимеров. Молекулярная структура полимера. Надмолекулярная структура полимеров МОУ «Масловская средняя общеобразовател
МОУ «Масловская средняя общеобразовател Презентация по химии Количество вещества
Презентация по химии Количество вещества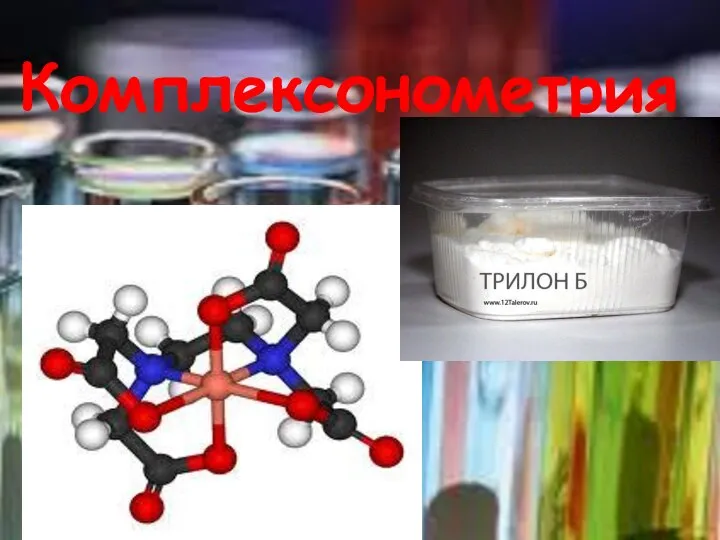 Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Тренажер - Валентность. 8 класс
Тренажер - Валентность. 8 класс Презентация по Химии "Родословная Д. И. Менделеева." - скачать смотреть бесплатно
Презентация по Химии "Родословная Д. И. Менделеева." - скачать смотреть бесплатно Когда его называли гением, он морщился: "Какой там гений. Трудился всю жизнь, вот и стал гением". Когда в 26 лет писал курс "
Когда его называли гением, он морщился: "Какой там гений. Трудился всю жизнь, вот и стал гением". Когда в 26 лет писал курс " Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Коррозия металлов. (Лекция 7)
Коррозия металлов. (Лекция 7) Определение содержания солей в нефти
Определение содержания солей в нефти Нуклеиновые кислоты
Нуклеиновые кислоты Фосфор. Философский камень
Фосфор. Философский камень Күйдіргіш натрий
Күйдіргіш натрий Кислоты. Состав кислот
Кислоты. Состав кислот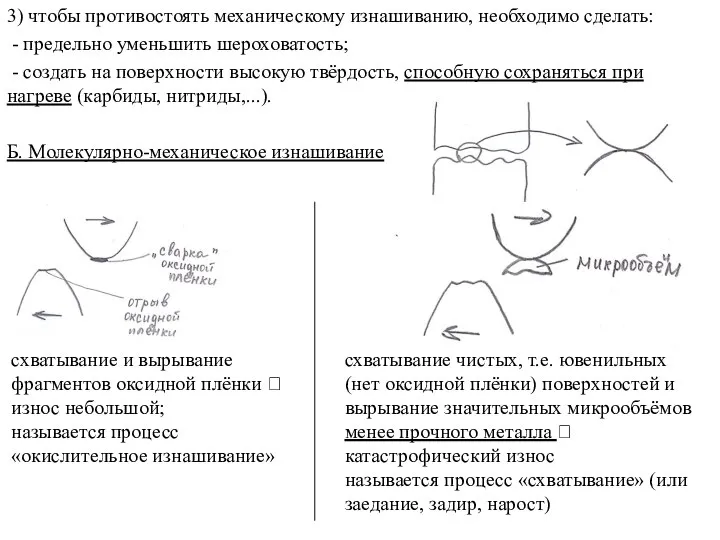 Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме