Содержание
- 2. Строение молекулы аммиака Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине; Атом азота
- 3. Химические свойства аммиака УХР взаимодействия аммиака с водой, газообразного аммиака с газообразным хлороводородом, а также раствора
- 4. Аммиак − слабое основание Аммиак − это слабое основание, водные растворы аммиака имеют слабощелочную среду и
- 5. Взаимодействие аммиака с хлороводородом и раствором соляной кислоты 2. При взаимодействии: а) газообразного аммиака с газообразным
- 6. Взаимодействие раствора аммиака с растворами кислот 3. Аммиак взаимодействует с кислотами, образуя соли аммония: а) с
- 7. Взаимодействие раствора аммиака с растворами солей 4. Аммиака или гидроксид аммония реагирует с растворами солей, образуя
- 8. Взаимодействие аммиака с соединениями меди (II) и другими солями 5. Комлексообразование – молекулы NH3 могут входить
- 9. Аммиак – сильный восстановитель Так как в аммиаке атом N−3 находится в низшей степени окисления, то
- 10. Свойства аммиака как восстановителя 1. Взаимодействие с галогенами: а) Фтор мгновенно окисляет аммиак до трифторида: N–3H3
- 11. Методы получения аммиака Промышленные методы получения аммиака; Лабораторные методы получения аммиака и фосфина
- 12. Промышленный метод получения аммиака Прямое взаимодействие водорода и азота (процесс Габера): р=200 атм N2(г) + 3H2(г)
- 13. Лабораторные методы получения Аммиака Фосфина 1. Взаимодействие солей аммония со щелочами при нагревании: Ca(OH)2 + 2NH4Cl
- 14. Получение и термолиз солей аммония Все соли аммония при нагревании разлагаются; При этом возможны: 1) Не
- 15. Получение и термолиз солей аммония (не ОВР) Получение Термолиз 1.1. Карбонат аммония 2NН3+ СО2 + Н2О
- 16. Получение и термолиз солей аммония (не ОВР) Получение Термолиз 1.6. Сульфат аммония 2NH3 + H2SO4 →
- 17. Получение и термолиз солей аммония (ОВР) Получение Термолиз 2.1. Нитрит аммония Поглощение смеси газообразных окислов NO
- 18. Свойства солей аммония 1. Все соли аммония при нагревании взаимодействуют со щелочами: Ca(OH)2 + 2NH4Cl →
- 19. 1. Гидролиз солей аммония, образованных сильными кислотами 1.1. Галогениды аммония (хлориды, бромиды, йодиды) NH4Cl → NH41+
- 20. 2. Гидролиз солей аммония, образованных слабыми кислотами 2.1. Фторид аммония NH4F → NH41+ + F1− NH41+
- 21. 2. Гидролиз солей аммония, образованных слабыми кислотами 2.3. Сульфид аммония (NH4)2S → 2NH41+ + S2− NH41+
- 23. Скачать презентацию




















 Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Полиэтилен - термопластичный полимер этилена
Полиэтилен - термопластичный полимер этилена Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение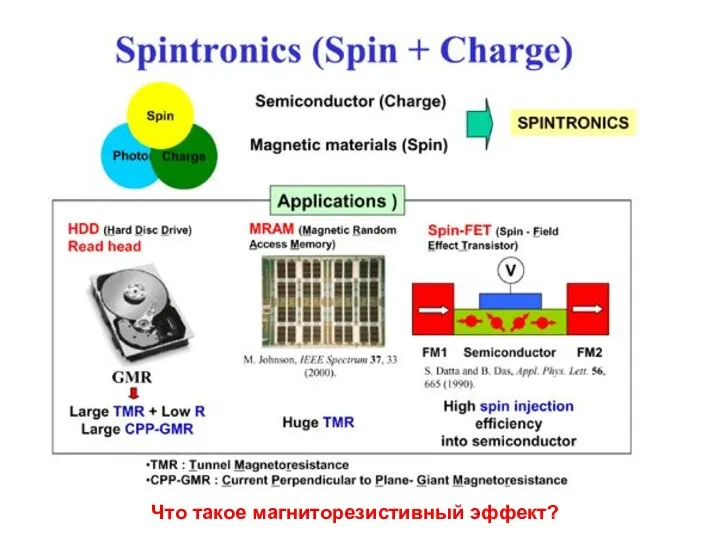 A quantum computer
A quantum computer Презентация по Химии "Определение геометрических размеров молекул изомеров октана" - скачать смотреть
Презентация по Химии "Определение геометрических размеров молекул изомеров октана" - скачать смотреть  Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть
Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть  Идеальный газ. Основное уравнение молекулярно-кинетической теории газов
Идеальный газ. Основное уравнение молекулярно-кинетической теории газов Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия
Металлы и сплавы, Металлы и сплавы, их свойства и применение в радиоэлектронной аппаратуре Подготовил: учащийся гр.7/8 профессия Дать характеристику новому классу органических веществ
Дать характеристику новому классу органических веществ Химия и физика полимеров. Молекулярная структура полимера. Надмолекулярная структура полимеров
Химия и физика полимеров. Молекулярная структура полимера. Надмолекулярная структура полимеров МОУ «Масловская средняя общеобразовател
МОУ «Масловская средняя общеобразовател Презентация по химии Количество вещества
Презентация по химии Количество вещества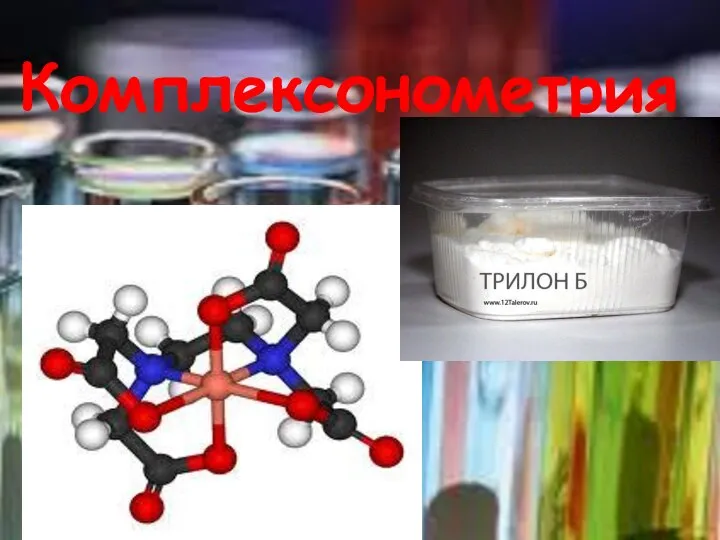 Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Тренажер - Валентность. 8 класс
Тренажер - Валентность. 8 класс Презентация по Химии "Родословная Д. И. Менделеева." - скачать смотреть бесплатно
Презентация по Химии "Родословная Д. И. Менделеева." - скачать смотреть бесплатно Когда его называли гением, он морщился: "Какой там гений. Трудился всю жизнь, вот и стал гением". Когда в 26 лет писал курс "
Когда его называли гением, он морщился: "Какой там гений. Трудился всю жизнь, вот и стал гением". Когда в 26 лет писал курс " Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Коррозия металлов. (Лекция 7)
Коррозия металлов. (Лекция 7) Определение содержания солей в нефти
Определение содержания солей в нефти Нуклеиновые кислоты
Нуклеиновые кислоты Фосфор. Философский камень
Фосфор. Философский камень Күйдіргіш натрий
Күйдіргіш натрий Кислоты. Состав кислот
Кислоты. Состав кислот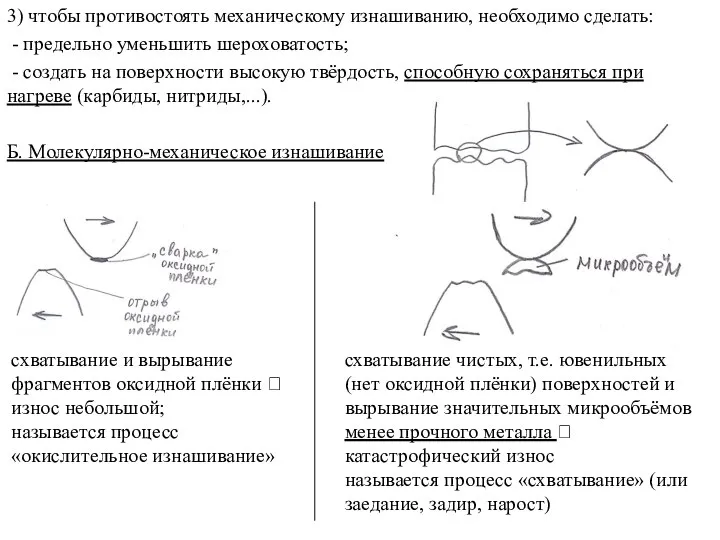 Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме