Содержание
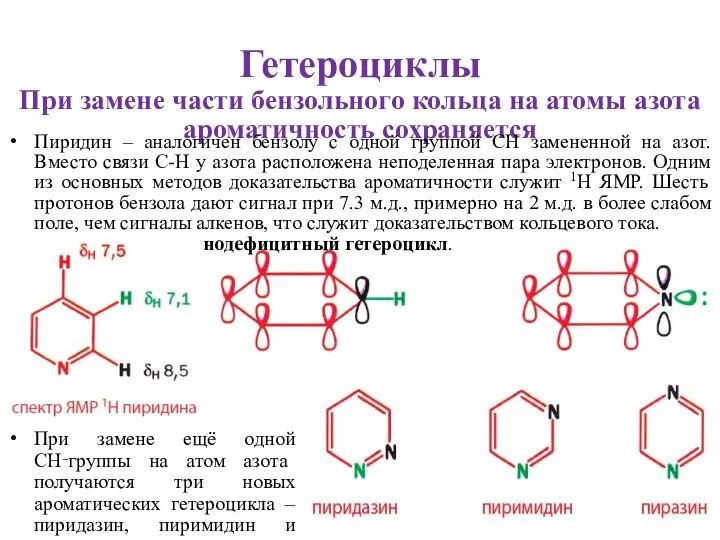
- 2. Гетероциклы При замене части бензольного кольца на атомы азота ароматичность сохраняется Пиридин – аналогичен бензолу с
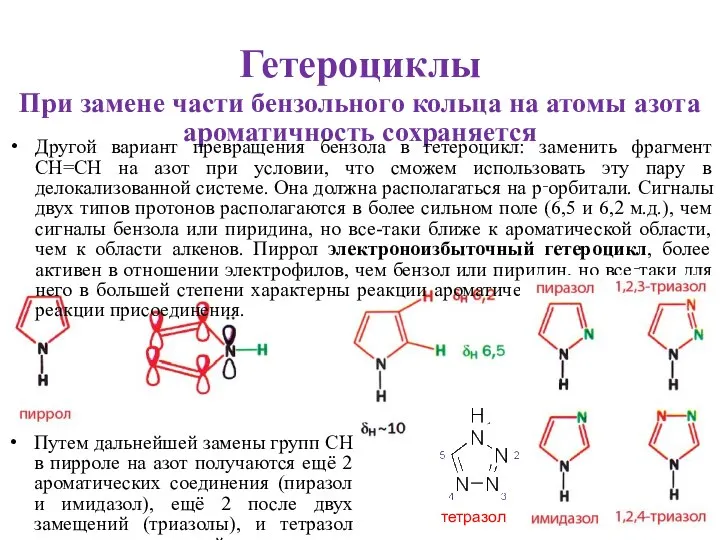
- 3. Гетероциклы При замене части бензольного кольца на атомы азота ароматичность сохраняется Другой вариант превращения бензола в
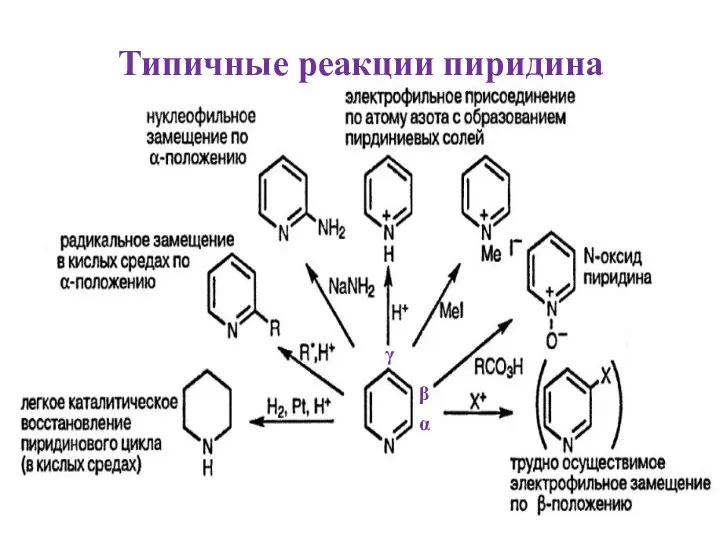
- 4. Типичные реакции пиридина γ β α
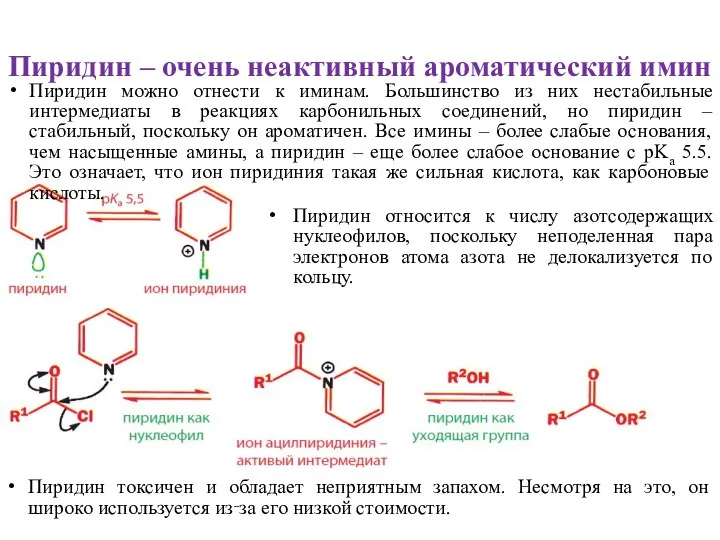
- 5. Пиридин – очень неактивный ароматический имин Пиридин можно отнести к иминам. Большинство из них нестабильные интермедиаты
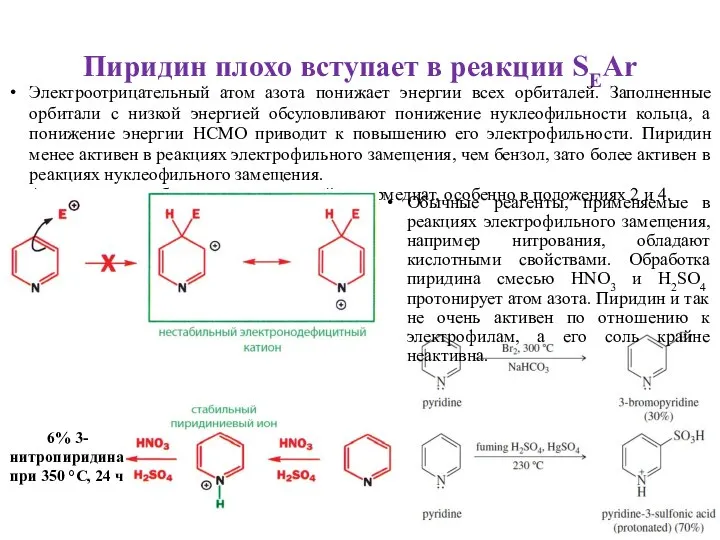
- 6. Пиридин плохо вступает в реакции SEAr Электроотрицательный атом азота понижает энергии всех орбиталей. Заполненные орбитали с
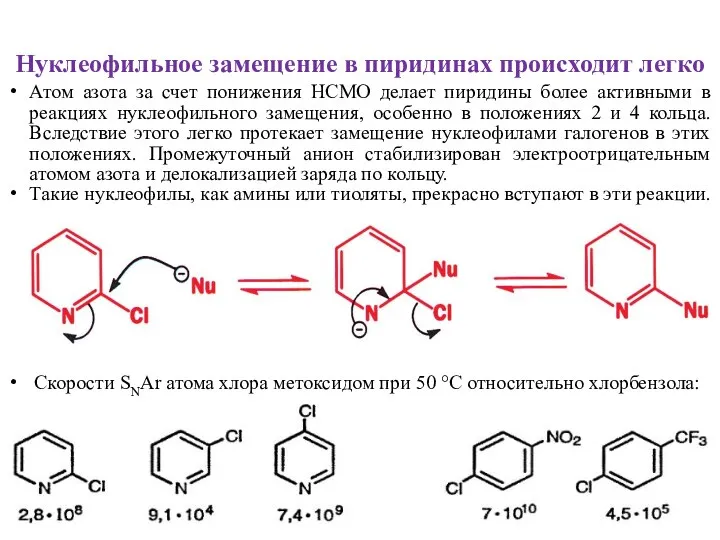
- 7. Нуклеофильное замещение в пиридинах происходит легко Атом азота за счет понижения НСМО делает пиридины более активными
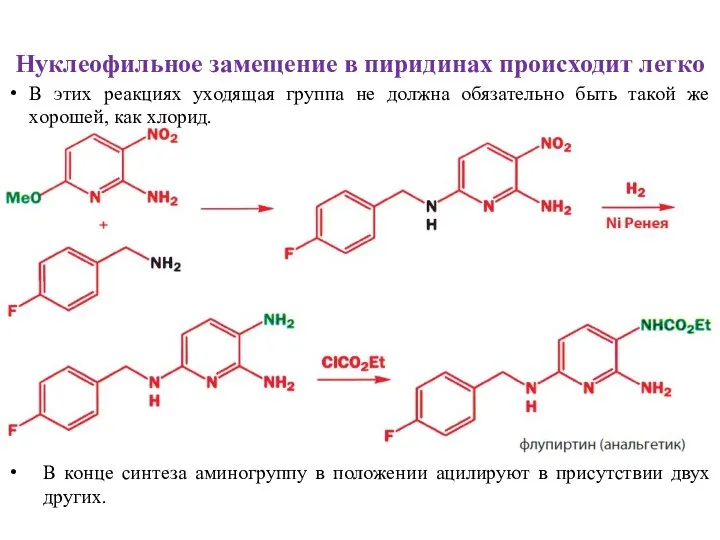
- 8. Нуклеофильное замещение в пиридинах происходит легко В этих реакциях уходящая группа не должна обязательно быть такой
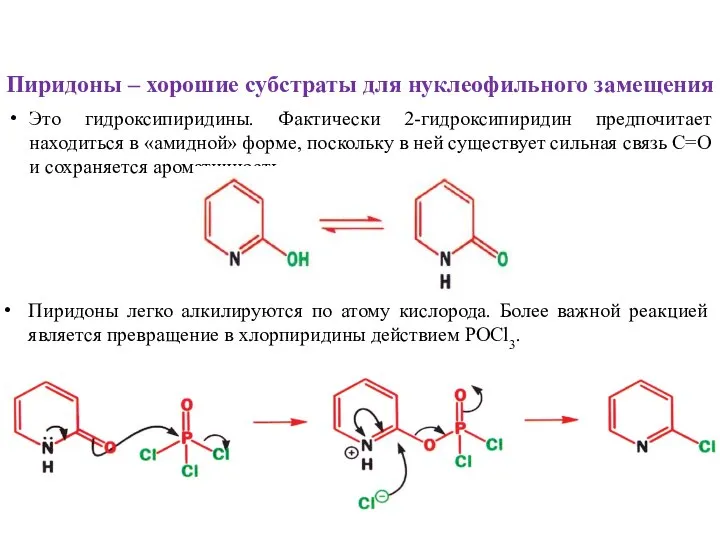
- 9. Пиридоны – хорошие субстраты для нуклеофильного замещения Это гидроксипиридины. Фактически 2-гидроксипиридин предпочитает находиться в «амидной» форме,
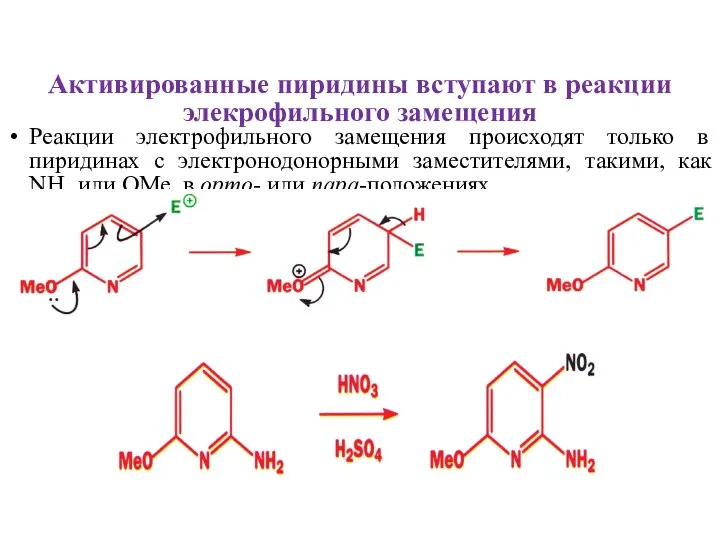
- 10. Активированные пиридины вступают в реакции элекрофильного замещения Реакции электрофильного замещения происходят только в пиридинах с электронодонорными
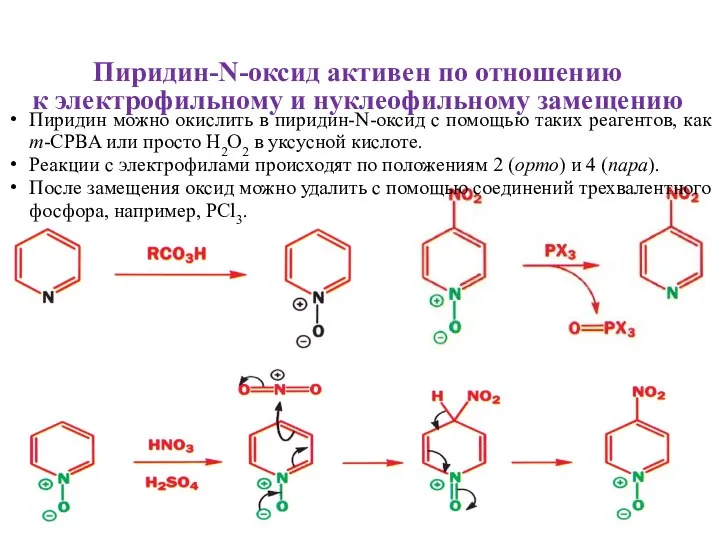
- 11. Пиридин-N-оксид активен по отношению к электрофильному и нуклеофильному замещению Пиридин можно окислить в пиридин-N-оксид с помощью
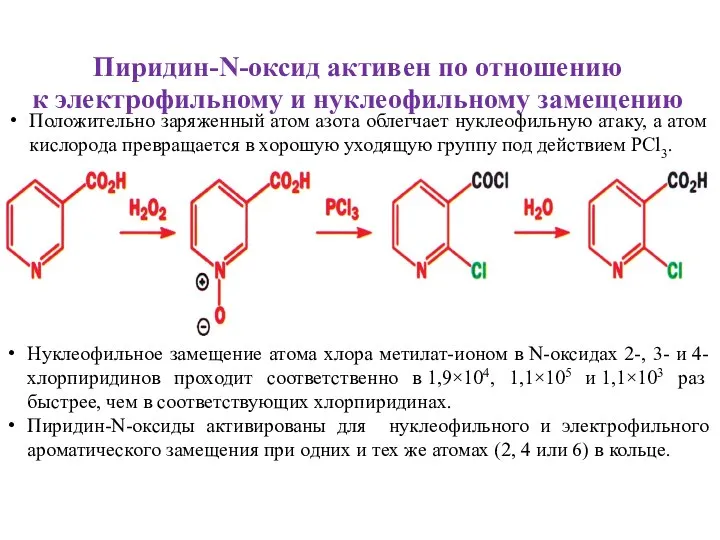
- 12. Пиридин-N-оксид активен по отношению к электрофильному и нуклеофильному замещению Положительно заряженный атом азота облегчает нуклеофильную атаку,
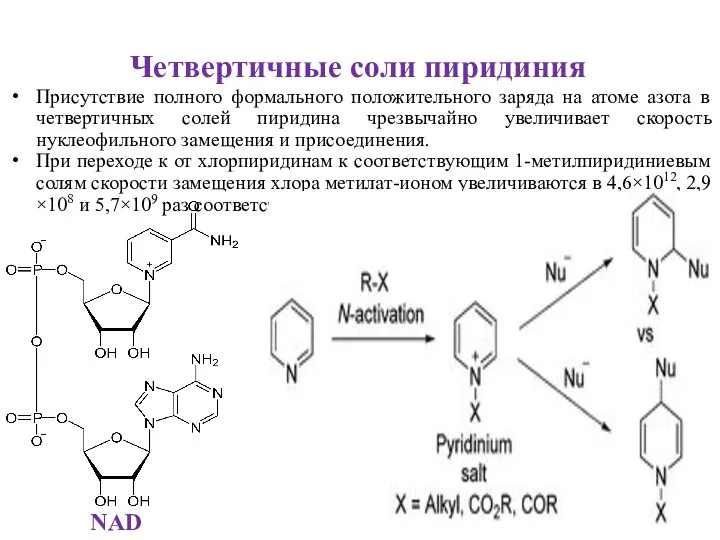
- 13. Четвертичные соли пиридиния Присутствие полного формального положительного заряда на атоме азота в четвертичных солей пиридина чрезвычайно
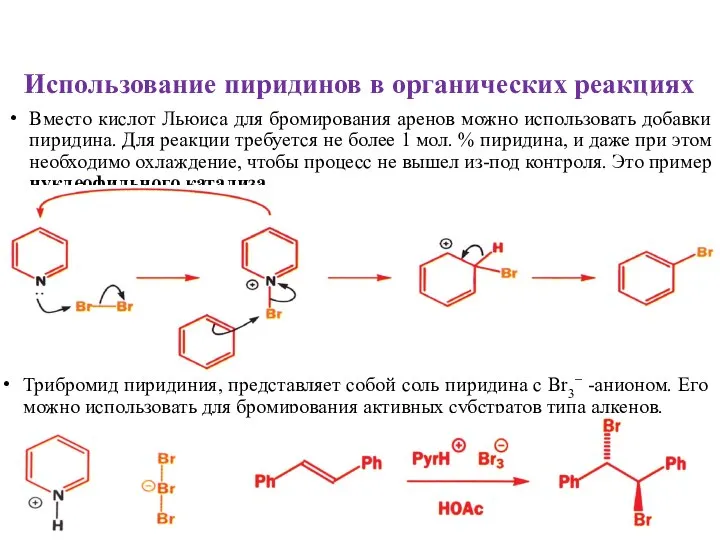
- 14. Использование пиридинов в органических реакциях Вместо кислот Льюиса для бромирования аренов можно использовать добавки пиридина. Для
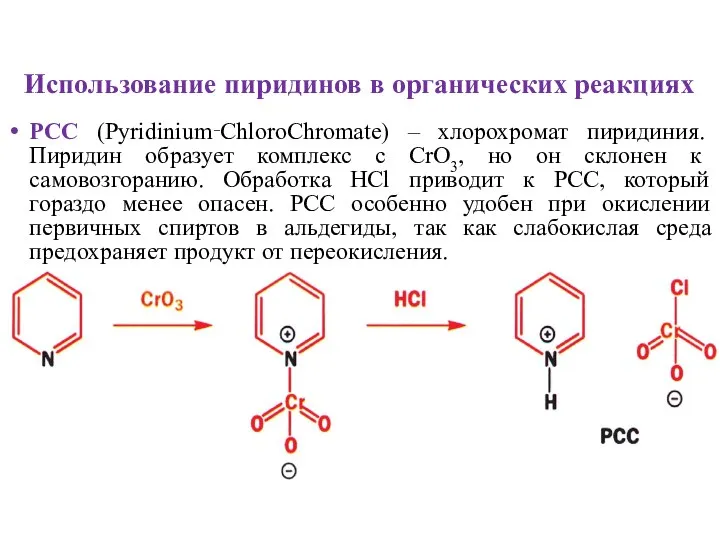
- 15. Использование пиридинов в органических реакциях PCC (Pyridinium‑ChloroChromate) – хлорохромат пиридиния. Пиридин образует комплекс с CrO3, но
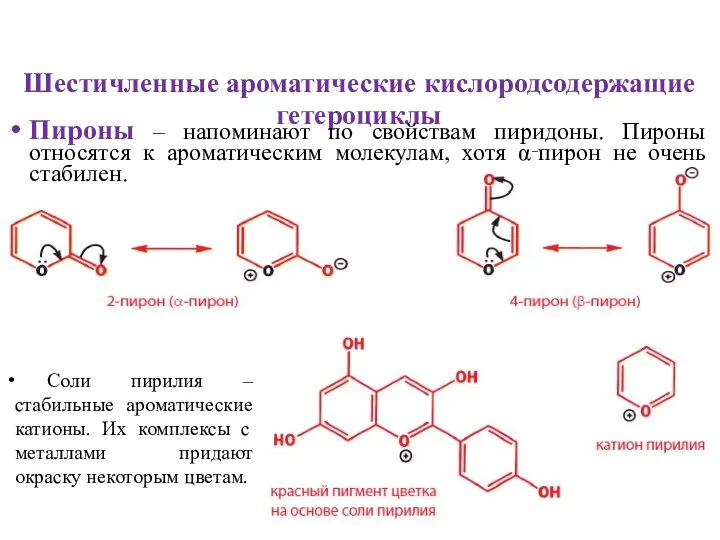
- 16. Шестичленные ароматические кислородсодержащие гетероциклы Пироны – напоминают по свойствам пиридоны. Пироны относятся к ароматическим молекулам, хотя
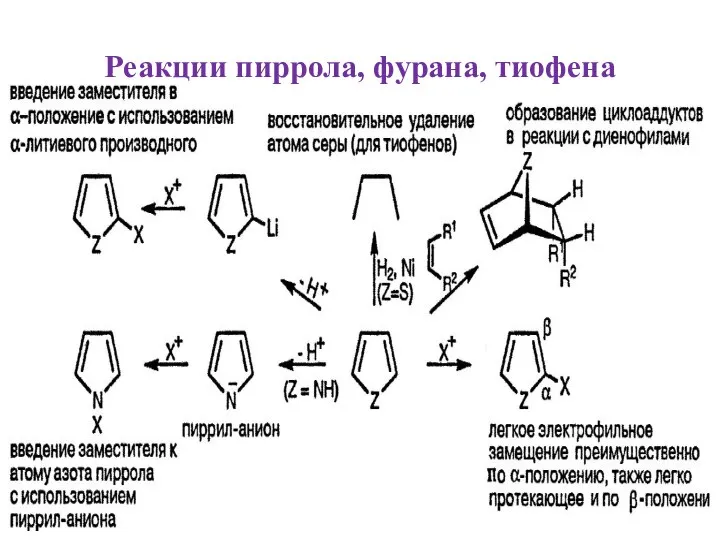
- 17. Реакции пиррола, фурана, тиофена
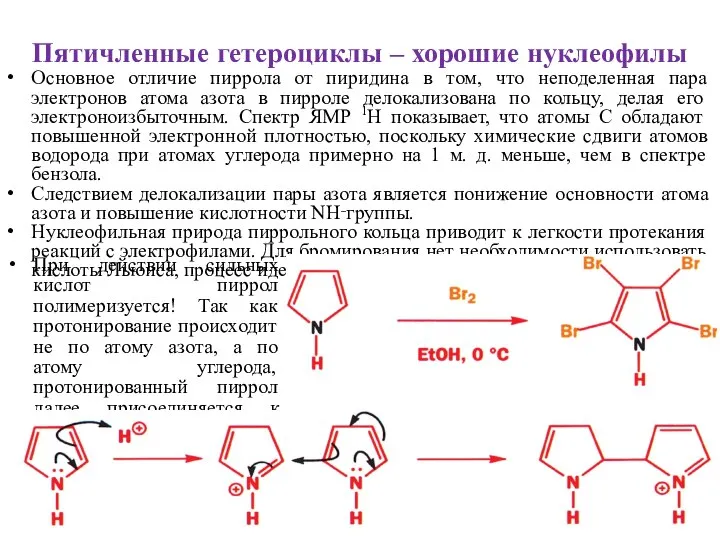
- 18. Пятичленные гетероциклы – хорошие нуклеофилы Основное отличие пиррола от пиридина в том, что неподеленная пара электронов
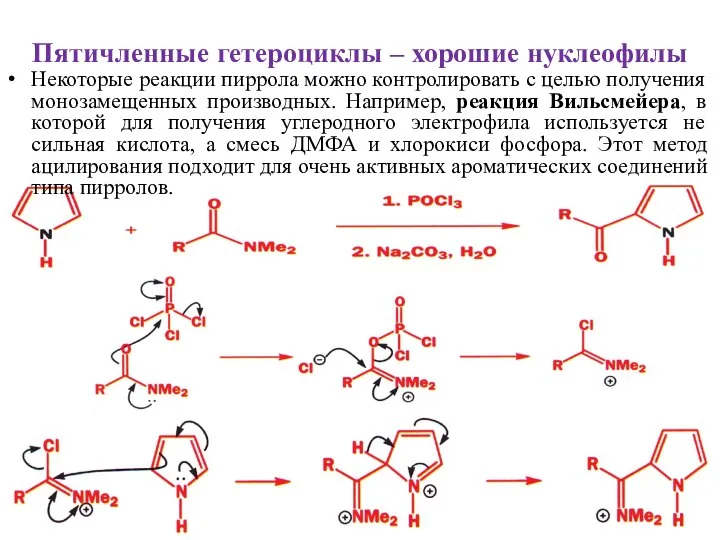
- 19. Пятичленные гетероциклы – хорошие нуклеофилы Некоторые реакции пиррола можно контролировать с целью получения монозамещенных производных. Например,
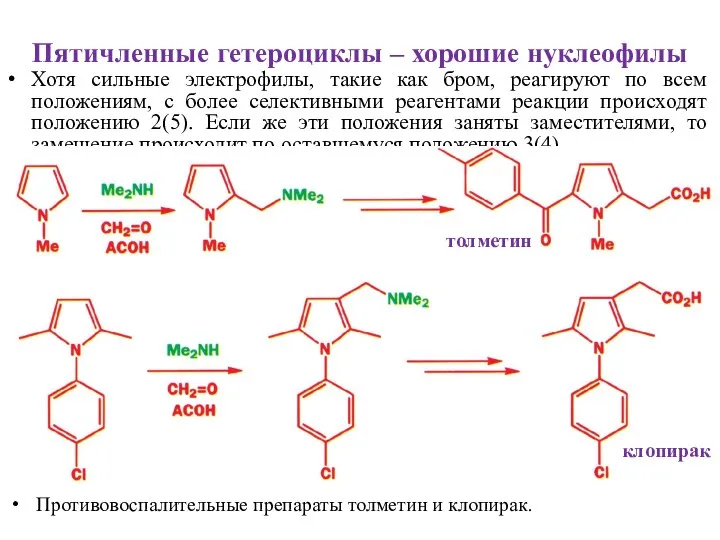
- 20. Пятичленные гетероциклы – хорошие нуклеофилы Хотя сильные электрофилы, такие как бром, реагируют по всем положениям, с
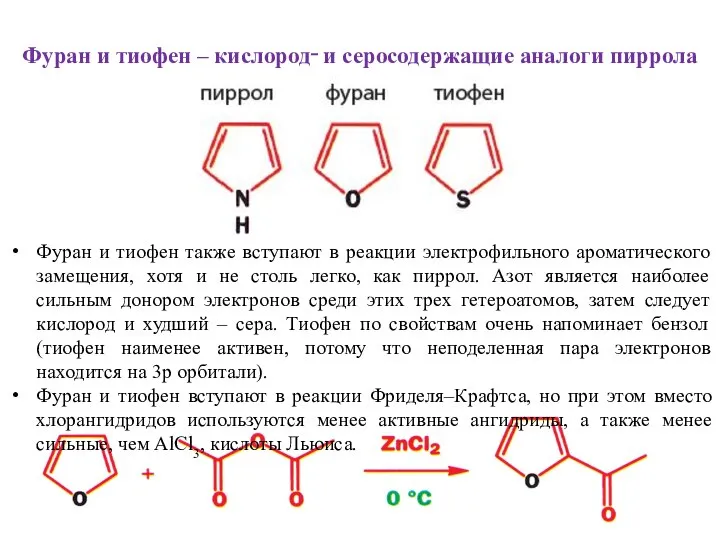
- 21. Фуран и тиофен – кислород‑ и серосодержащие аналоги пиррола Фуран и тиофен также вступают в реакции
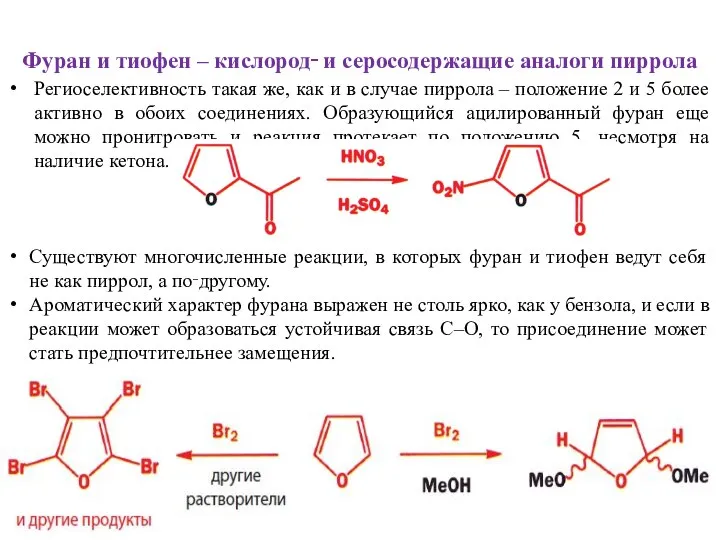
- 22. Фуран и тиофен – кислород‑ и серосодержащие аналоги пиррола Региоселективность такая же, как и в случае
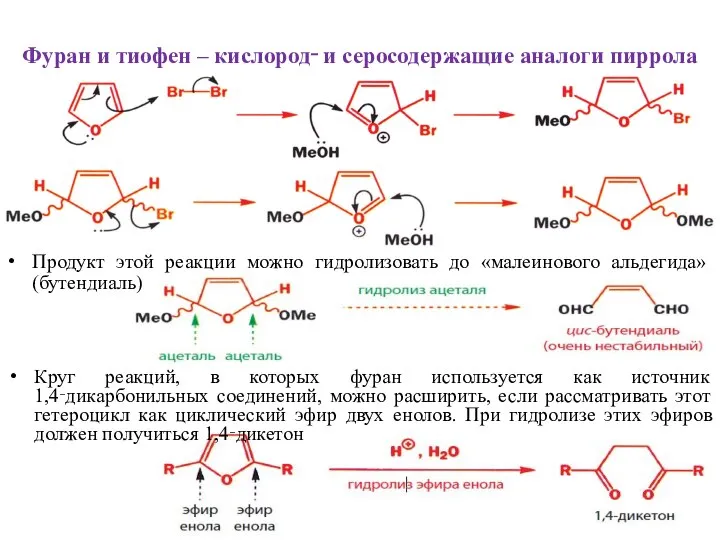
- 23. Фуран и тиофен – кислород‑ и серосодержащие аналоги пиррола Продукт этой реакции можно гидролизовать до «малеинового
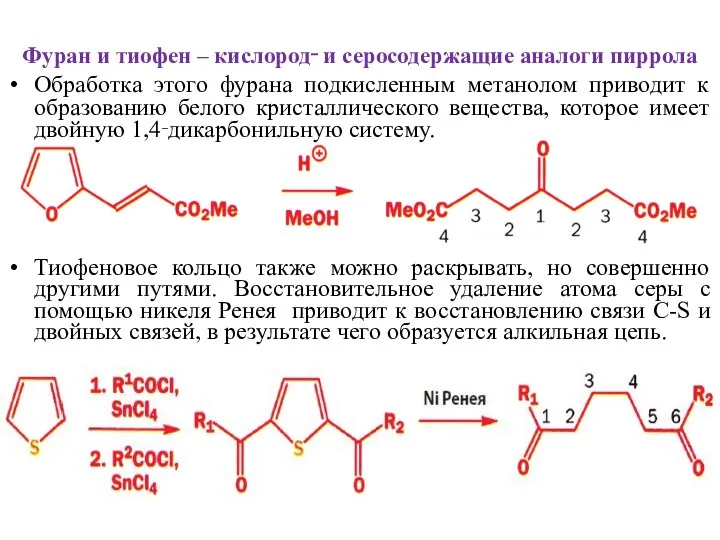
- 24. Фуран и тиофен – кислород‑ и серосодержащие аналоги пиррола Обработка этого фурана подкисленным метанолом приводит к
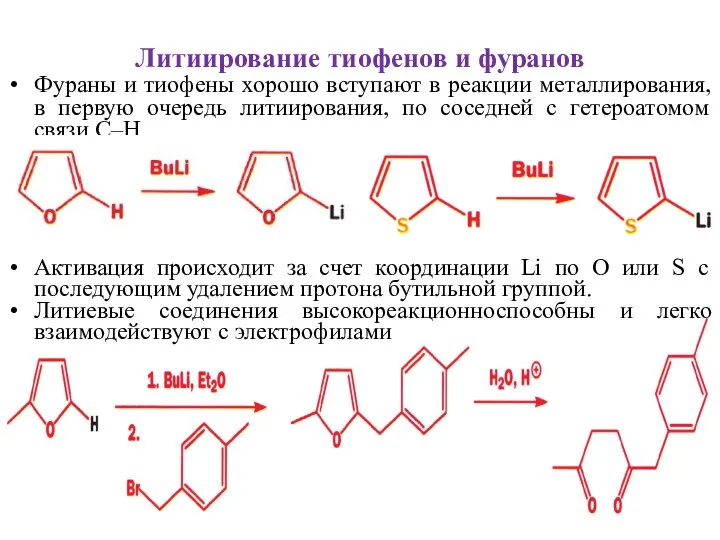
- 25. Литиирование тиофенов и фуранов Фураны и тиофены хорошо вступают в реакции металлирования, в первую очередь литиирования,
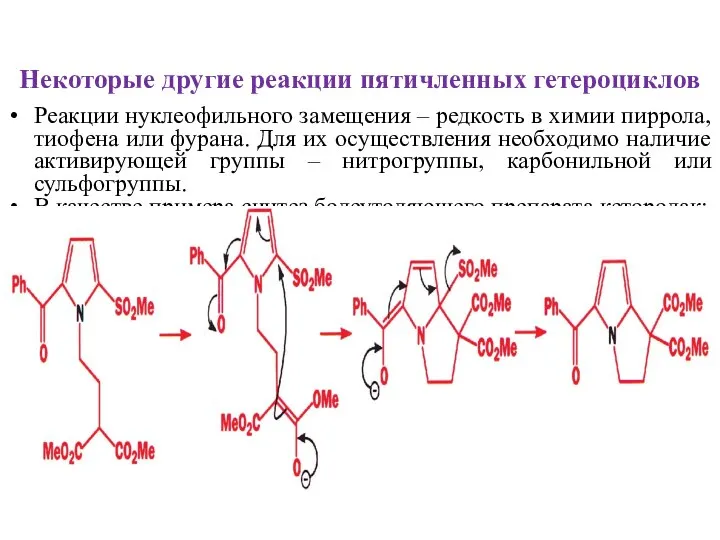
- 26. Некоторые другие реакции пятичленных гетероциклов Реакции нуклеофильного замещения – редкость в химии пиррола, тиофена или фурана.
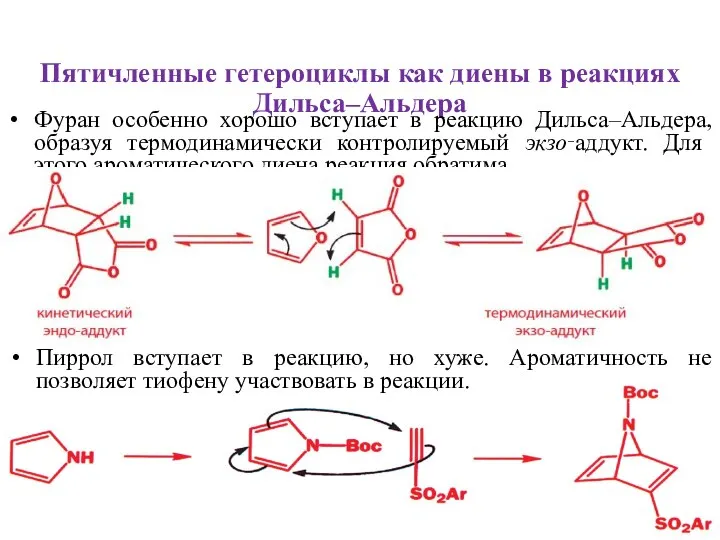
- 27. Пятичленные гетероциклы как диены в реакциях Дильса–Альдера Фуран особенно хорошо вступает в реакцию Дильса–Альдера, образуя термодинамически
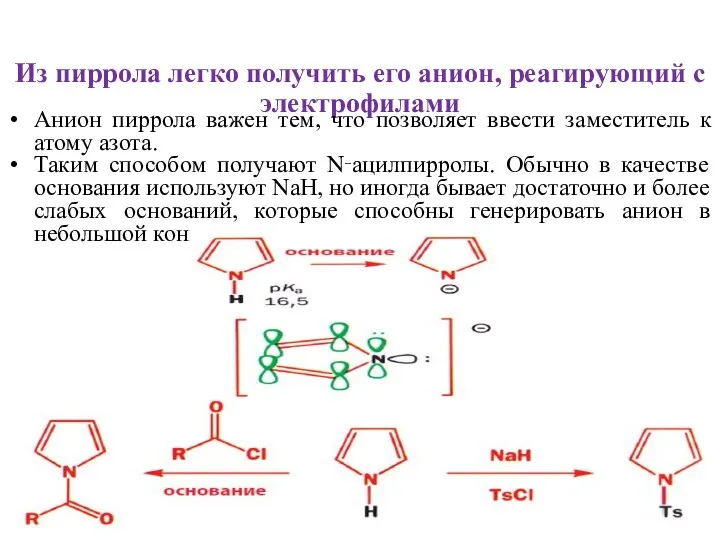
- 28. Из пиррола легко получить его анион, реагирующий с электрофилами Анион пиррола важен тем, что позволяет ввести
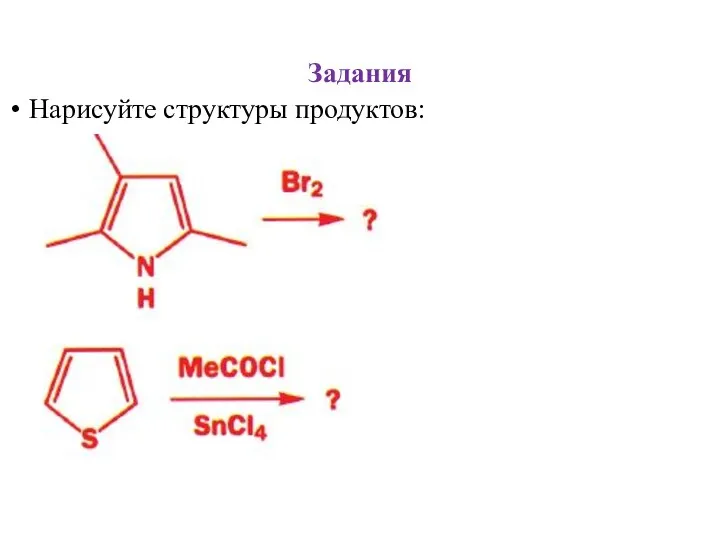
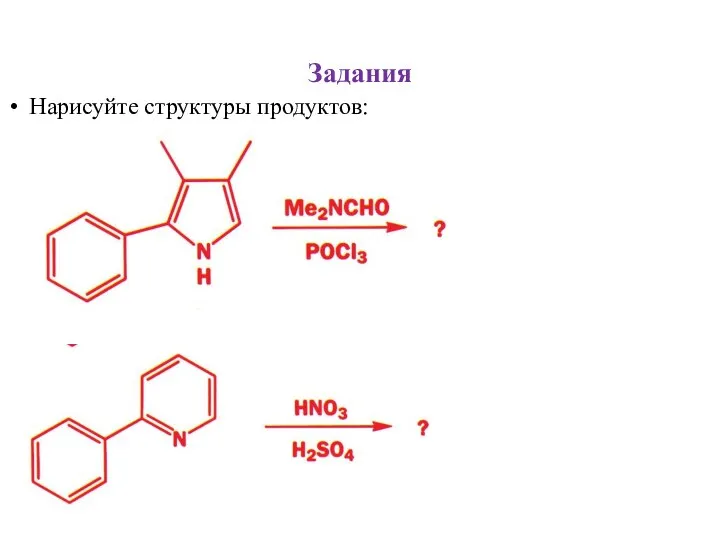
- 29. Задания Нарисуйте структуры продуктов:
- 30. Задания Нарисуйте структуры продуктов:
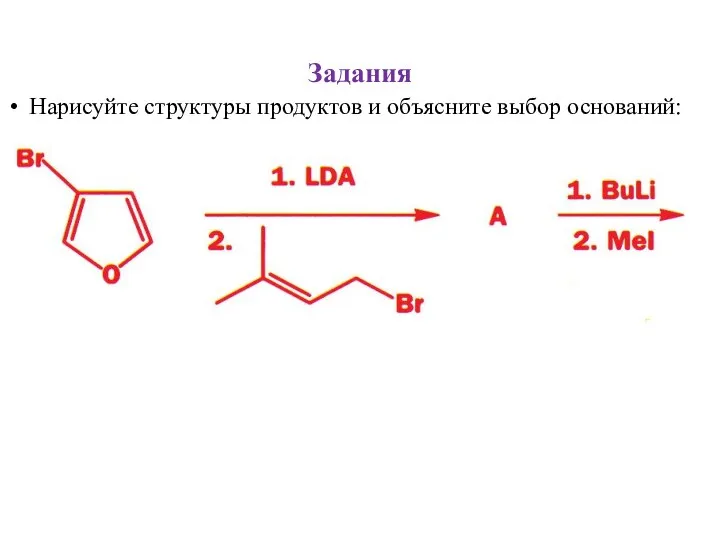
- 31. Задания Нарисуйте структуры продуктов и объясните выбор оснований:
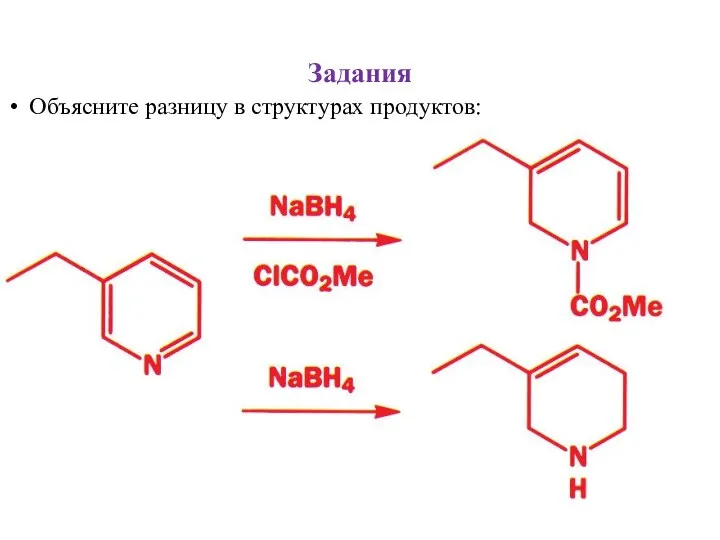
- 32. Задания Объясните разницу в структурах продуктов:
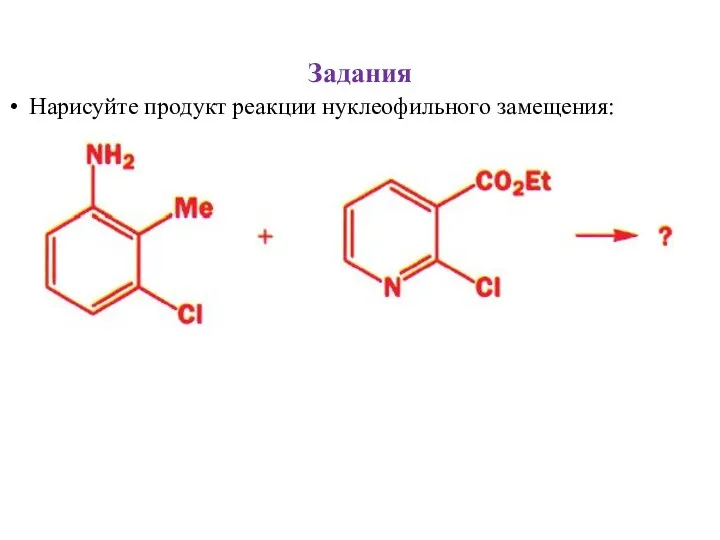
- 33. Задания Нарисуйте продукт реакции нуклеофильного замещения:
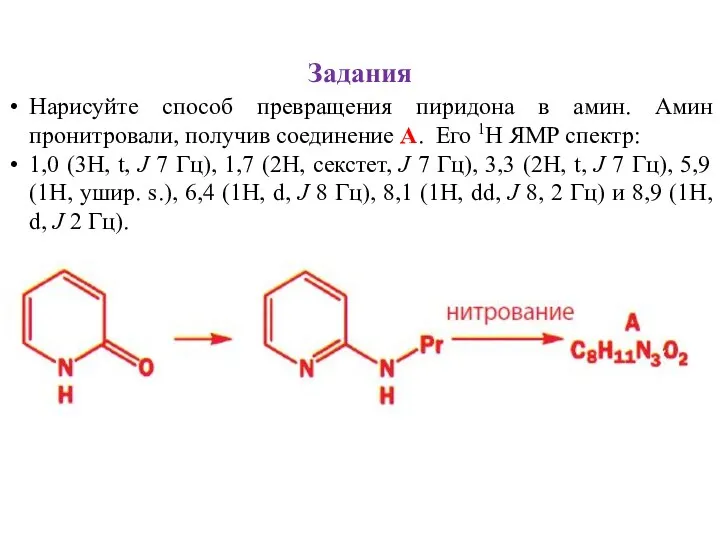
- 34. Задания Нарисуйте способ превращения пиридона в амин. Амин пронитровали, получив соединение А. Его 1Н ЯМР спектр:
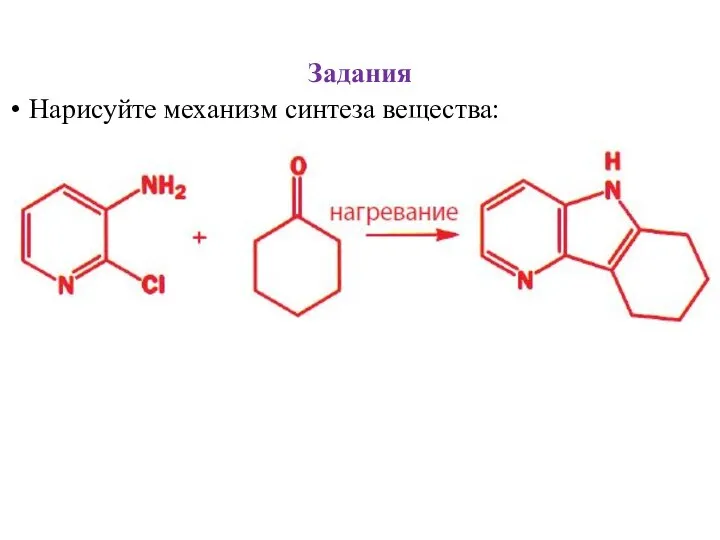
- 35. Задания Нарисуйте механизм синтеза вещества:
- 37. Скачать презентацию
 Каталитикалық крекинг
Каталитикалық крекинг Силіцій Стеценко Данило Котенко Роман Богдан Олександр Копич Вадим
Силіцій Стеценко Данило Котенко Роман Богдан Олександр Копич Вадим  Дендример, или арборол
Дендример, или арборол Ферменты и гормоны. (10-11 класс)
Ферменты и гормоны. (10-11 класс) Фосфор. Получение. Химические свойства
Фосфор. Получение. Химические свойства Презентация по Химии "Опорно-двигательная система. Скелет и мышцы птиц" - скачать смотреть
Презентация по Химии "Опорно-двигательная система. Скелет и мышцы птиц" - скачать смотреть  Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Способы перегонки
Способы перегонки «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Познаваемость мира. Сведения о клетке. Подготовила ученица 11 класса Шапаренко Екатерина
Познаваемость мира. Сведения о клетке. Подготовила ученица 11 класса Шапаренко Екатерина Теория строения химических соединений А. М. Бутлерова
Теория строения химических соединений А. М. Бутлерова  Металлы в продуктах питания
Металлы в продуктах питания Презентация по Химии "Угольная кислота" - скачать смотреть
Презентация по Химии "Угольная кислота" - скачать смотреть  Полупроводниковая магнитная керамика - ферриты
Полупроводниковая магнитная керамика - ферриты ПОЖАРОВЗРЫВОБЕЗОПАСНОСТЬ Учебные вопросы: 1. Процессы горения. Опасности пожара. 2. Виды горения. 3. Опасные факторы пожара. 4.
ПОЖАРОВЗРЫВОБЕЗОПАСНОСТЬ Учебные вопросы: 1. Процессы горения. Опасности пожара. 2. Виды горения. 3. Опасные факторы пожара. 4.  Сополимеризация. Основные количественные характеристики процесса сополимеризации
Сополимеризация. Основные количественные характеристики процесса сополимеризации Поливинилхлорид. Физические и химические свойства
Поливинилхлорид. Физические и химические свойства Ферментативные методы анализа
Ферментативные методы анализа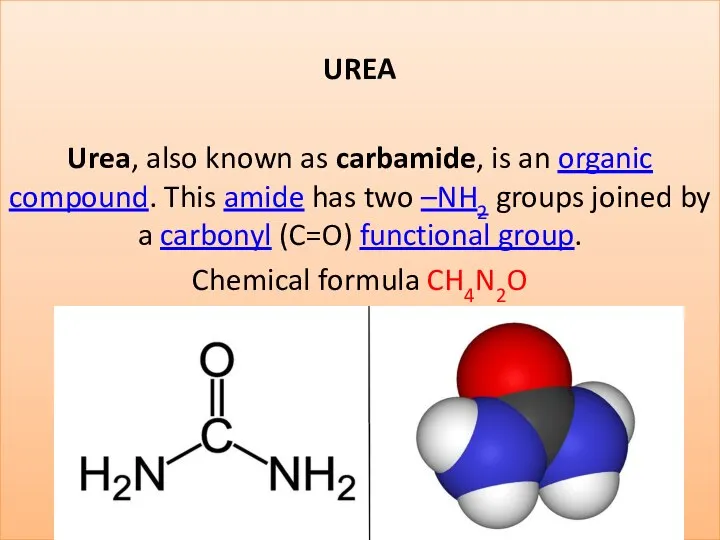 Urea (carbamide)
Urea (carbamide) Отбор проб товаров для анализа. Химико-аналитический контроль
Отбор проб товаров для анализа. Химико-аналитический контроль Кристаллическая структура
Кристаллическая структура Щелочные металлы
Щелочные металлы Углеводороды. (Лекция 5)
Углеводороды. (Лекция 5) Растворы. Часть 2
Растворы. Часть 2 Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) Применение нитратов
Применение нитратов  Презентация Теллур
Презентация Теллур 9 класс Урок №9. Углеводы. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс Урок №9. Углеводы. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.