Содержание
- 2. Цель урока: Дать общую характеристику щелочным металлам. Рассмотреть их электронное строение, сравнить физические и химические свойства.
- 4. Эти металлы получили название щелочных, потому что большинство их соединений растворимы в воде. По-славянски «выщелачивать» означает
- 5. История открытия металлов В 1807 г. в Англии Г. Деви открыл натрий и калий. «Натрун» -
- 6. Нахождение в природе Как очень активные металлы, они встречаются в природе только в виде соединений Натрий
- 7. Биологическая роль Na и К Na+- внутриклеточный ион, содержится в крови и лимфе, создает в клетках
- 8. Физические свойства
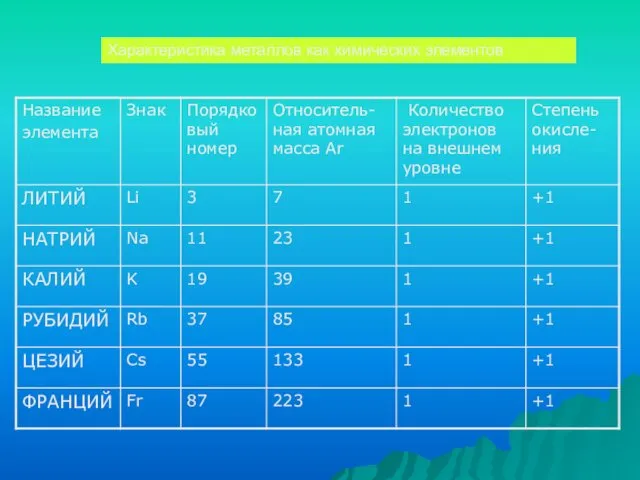
- 10. Характеристика металлов как химических элементов
- 11. Изменение свойств в группе В ряду щелочных металлов: Радиус атома увеличивается Увеличиваются восстановительные свойства (способность отдавать
- 12. Химические свойства Щелочные металлы активно взаимодействуют почти со всеми неметаллами: 2Ме0 + Н20 = 2Ме+1Н-1 (гидрид)
- 14. Химические свойства Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода:
- 16. Окраска пламени ионами щелочных металлов Li+ Na+ K+ Cs+
- 18. Самые распространенные соединения металлов и их применение NaOH – едкий натр, каустическая сода. KOH - едкое
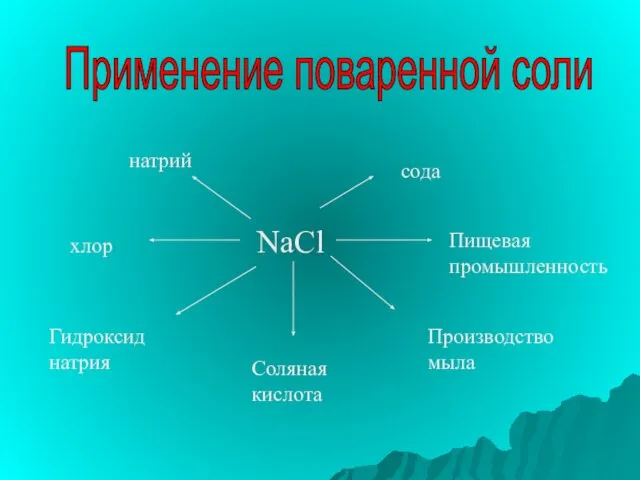
- 19. Применение поваренной соли NaCl натрий хлор Гидроксид натрия Соляная кислота Производство мыла Пищевая промышленность сода
- 20. Контрольный тест 1.К группе щелочных металлов относятся: а) Li, Na, K, Cu, Pb, Ag б) Li,Na,K,
- 21. КЛЮЧ к проверке тестов: 1б 2а 3г 4в 5а
- 23. Скачать презентацию


















 Современные проблемы химической технологии керамики
Современные проблемы химической технологии керамики Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Биологически активные вещества. Витамины. Ферменты. Гормоны
Биологически активные вещества. Витамины. Ферменты. Гормоны Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Что изучает химия
Что изучает химия Презентация по Химии "Полезные ископаемые." - скачать смотреть бесплатно_
Презентация по Химии "Полезные ископаемые." - скачать смотреть бесплатно_ Микроорганизмы и важнейшие химические факторы среды обитания
Микроорганизмы и важнейшие химические факторы среды обитания Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Голубое золото
Голубое золото Валентность химических элементов
Валентность химических элементов Релаксационные свойства полимеров
Релаксационные свойства полимеров Происхождение жизни на Земле
Происхождение жизни на Земле Подготовка учащихся к практическим турам олимпиад по химии
Подготовка учащихся к практическим турам олимпиад по химии Химические свойства солей. Генетическая связь неорганических соединений
Химические свойства солей. Генетическая связь неорганических соединений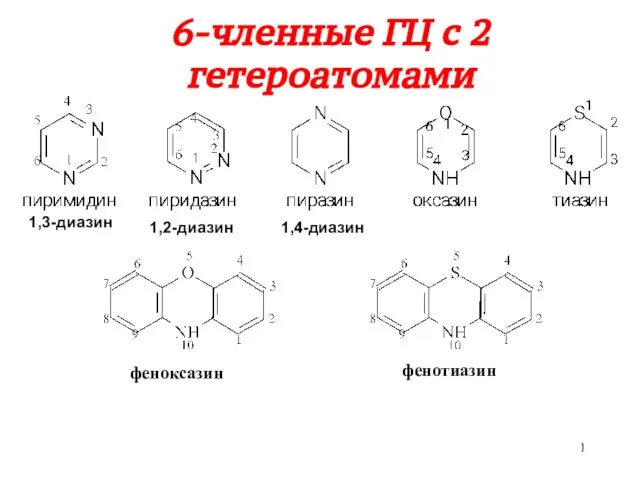 6-членные ГЦ с 2 гетероатомами
6-членные ГЦ с 2 гетероатомами Презентация по Химии "«Белки»" - скачать смотреть
Презентация по Химии "«Белки»" - скачать смотреть  Презентация по Химии "Промышленное получение аминокислот и их применение в медицыне и диетологии" - скачать смотреть бесплат
Презентация по Химии "Промышленное получение аминокислот и их применение в медицыне и диетологии" - скачать смотреть бесплат Урок химии на дне океана. Задача 13
Урок химии на дне океана. Задача 13 Презентация по Химии "Предмет органической химии. Органические вещества" - скачать смотреть
Презентация по Химии "Предмет органической химии. Органические вещества" - скачать смотреть  Углеводороды
Углеводороды Строение атома азота
Строение атома азота Полимеры и их использование
Полимеры и их использование Химическое равновесие. Термодинамика химического равновесия
Химическое равновесие. Термодинамика химического равновесия Характеристика элементов VIIA-группы (галогены)
Характеристика элементов VIIA-группы (галогены) Альдегиды и кетоны
Альдегиды и кетоны Электролиз. Задание № 20
Электролиз. Задание № 20 Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы
Аттестационная работа. Выращивание кристаллов. Выявить условия, позволяющие из раствора медного купороса выращивать кристаллы