Содержание
- 2. NO в тропосфере окисляется до NO2 по реакциям NO + HO2 → NO2 + OH NO
- 3. Атмосферный цикл соединений азота Цифрами указаны соответствующие потоки (─ - природные; --- - антропогенные поступления; ↓↓-
- 4. Сероводород окисляется до диоксида серы: H2S + OH → H2O + HS HS + O2 →
- 5. Жидкофазное окисление диоксида серы происходит после абсорбции SO2 частицами атмосферной влаги: SO2 + H2O = H2SO3
- 6. Скорости процессов трансформации и стока диоксида серы, серной кислоты и сульфатов могут быть представлены уравнениям первого
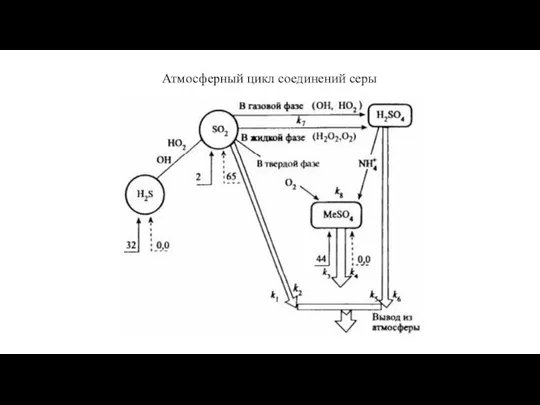
- 7. Атмосферный цикл соединений серы
- 8. Распределение концентраций соединений серы после выброса SO2: 1 – [SO2]; 2 – [H2SO4];3 – [MeSO4]
- 9. Химические реакции, протекающие в ходе образования фотохимического смога:
- 10. Важная роль в процессах образования озона принадлежит оксидам азота, причем скорость будет возрастать при увеличении скорости
- 11. Механизмы образования кислотных дождей Процессы, приводящие к образованию Н2SO4 в газовой фазе: НО• + SO2 =
- 12. Альтернативным этому является «ночной» механизм получения азотной кислоты. В его основе лежит взаимодействие NO2 с озоном
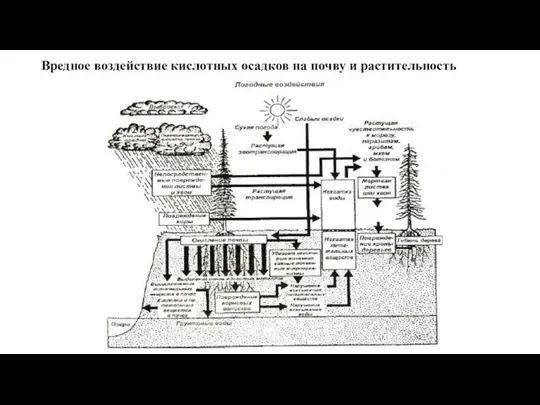
- 13. Вредное воздействие кислотных осадков на почву и растительность
- 14. Кислотные осадки вымывают биогены из почвы А - Частички гумуса и глины обычно заряжены отрицательно и
- 16. Скачать презентацию





![Распределение концентраций соединений серы после выброса SO2: 1 – [SO2]; 2 – [H2SO4];3 – [MeSO4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1392720/slide-7.jpg)





 Презентация по Химии "Презентация Неметаллы" - скачать смотреть
Презентация по Химии "Презентация Неметаллы" - скачать смотреть  Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қыщқылының антипирендік қасиеттерін зерттеу Рідкі кристали
Рідкі кристали Угольная кислота и ее производные. Сульфокислоты. (Лекция 12)
Угольная кислота и ее производные. Сульфокислоты. (Лекция 12) Электролиз Работу выполнила учитель химии МОУ «Парбигская СОШ» Дьяченко
Электролиз Работу выполнила учитель химии МОУ «Парбигская СОШ» Дьяченко  Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Презентация по Химии "Портфоліо" - скачать смотреть
Презентация по Химии "Портфоліо" - скачать смотреть  Теобромин
Теобромин Влияние этанола на организм человека
Влияние этанола на организм человека Химическая связь. Типы кристаллических решеток. Урок №6,7
Химическая связь. Типы кристаллических решеток. Урок №6,7 Сероводород. Сульфиды
Сероводород. Сульфиды Химические свойства оксидов
Химические свойства оксидов  Алкадиены
Алкадиены Кобаламины(витамин В12) антианемический
Кобаламины(витамин В12) антианемический Металлы
Металлы Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Важнейшие классы бинарных соединений – оксиды и водородные соединения
Важнейшие классы бинарных соединений – оксиды и водородные соединения Наглядное пособие «Динамические модели». Кристаллы. Немолекулярные вещества. Простые вещества
Наглядное пособие «Динамические модели». Кристаллы. Немолекулярные вещества. Простые вещества Chemistry of life
Chemistry of life Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Верхівцевький НВК. Верхівцевький НВК. Учитель хімії Кукса Наталія Миколаївна
Верхівцевький НВК. Верхівцевький НВК. Учитель хімії Кукса Наталія Миколаївна  Что такое оксиды?
Что такое оксиды? Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Тема: “Обобщение сведений об основных классах неорганических соединений”.
Тема: “Обобщение сведений об основных классах неорганических соединений”. Презентация по Химии "Неорганические кислоты" - скачать смотреть
Презентация по Химии "Неорганические кислоты" - скачать смотреть  Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы Презентация по Химии "Поширення солей у природі да їх практичне значення" - скачать смотреть
Презентация по Химии "Поширення солей у природі да їх практичне значення" - скачать смотреть  Йодированные производные арилалифатических и ароматических аминокислот
Йодированные производные арилалифатических и ароматических аминокислот