Содержание
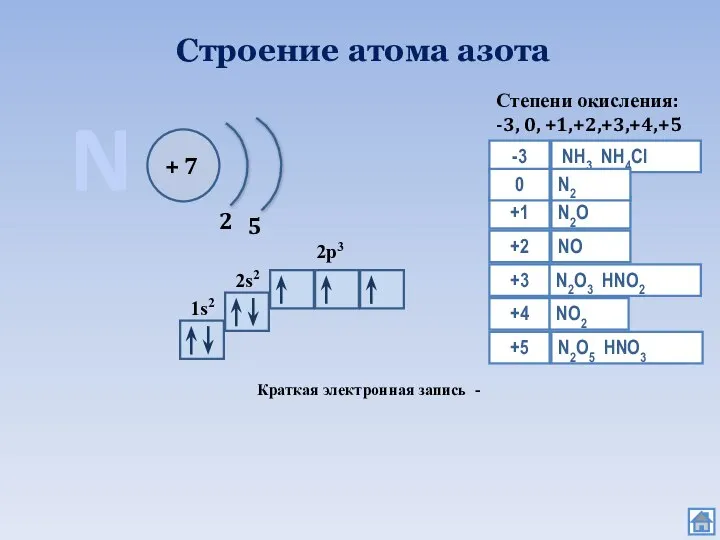
- 2. Строение атома азота N + 7 2 5 1s2 2s2 2p3 Краткая электронная запись - Степени
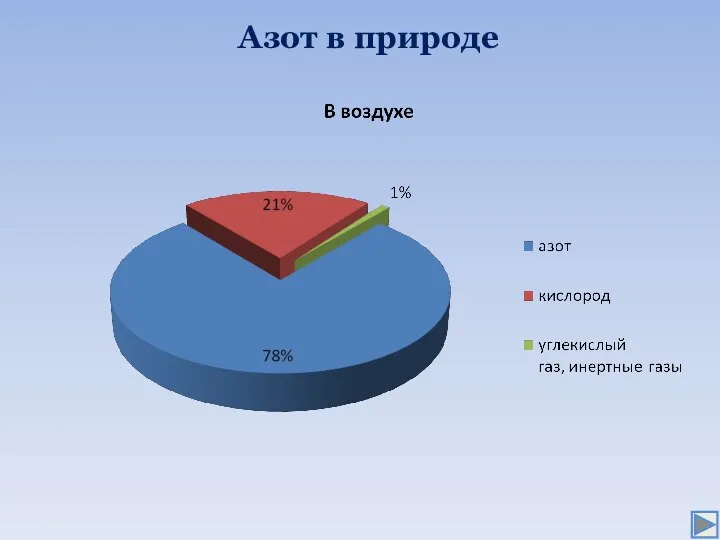
- 3. Азот в природе
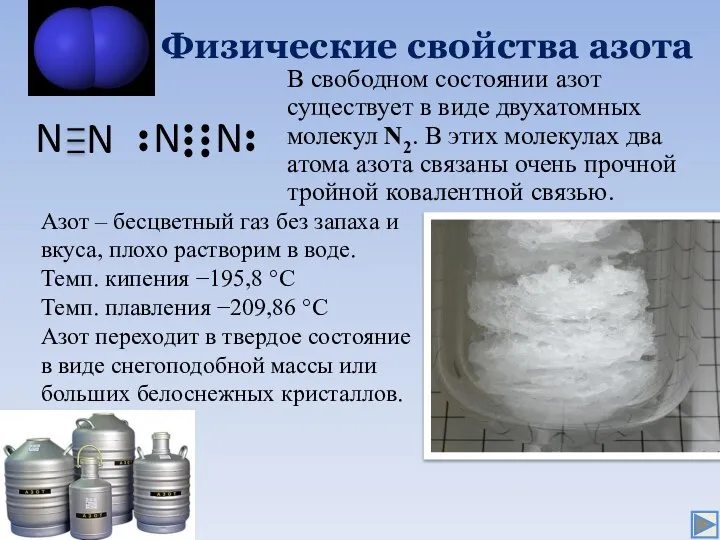
- 4. Физические свойства азота В свободном состоянии азот существует в виде двухатомных молекул N2. В этих молекулах
- 5. 1. При обычных условиях азот взаимодействует только с литием, образуя нитрид лития: 6Li+ N2 = 2Li3N
- 6. ПРИМЕНЕНИЕ Получение аммиака Создание инертной среды Создание низких температур В охладительных системах
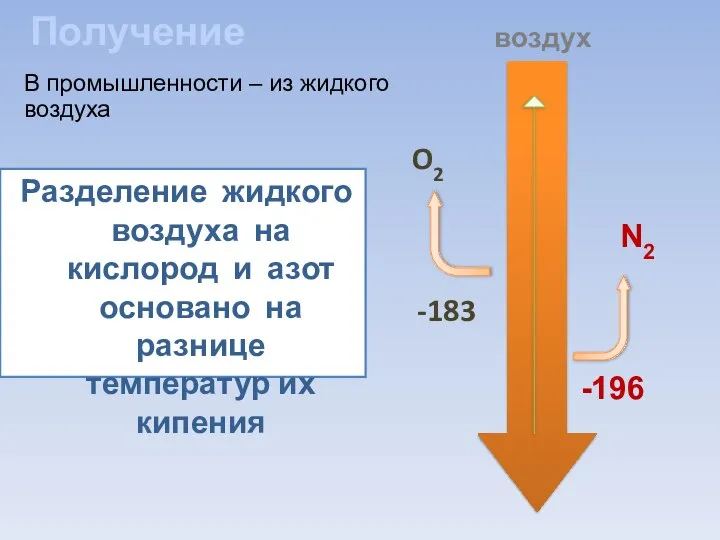
- 7. Получение Разделение жидкого воздуха на кислород и азот основано на разнице температур их кипения O2 N2
- 8. Получение в лаборатории 2. Разложение нитрита аммония NH4NO2 ⇒ N2 + 2H2O
- 9. Вопросы для самоконтроля Газ без цвета , вкуса и запаха Молекула двухатомна Содержание в воздухе 78
- 10. Вставьте пропущенные слова В периодической системе Д.И. Менделеева азот расположен в 2 периоде, V группе, главной
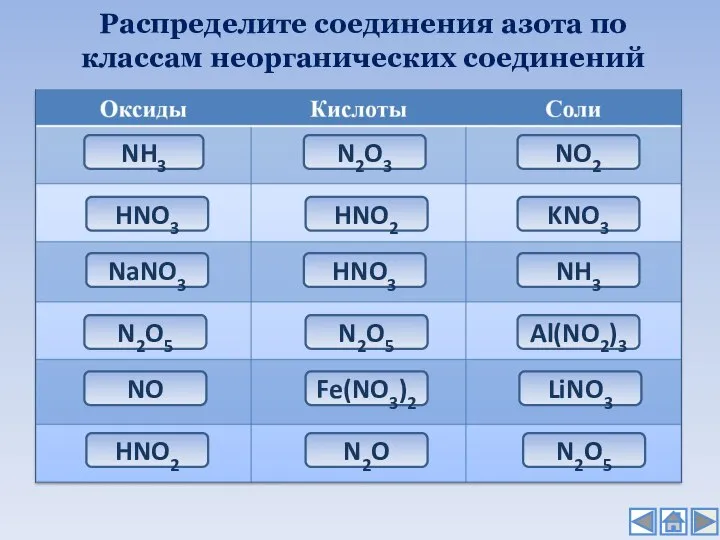
- 11. Распределите соединения азота по классам неорганических соединений NH3 HNO3 NaNO3 N2O5 NO HNO2 N2O3 HNO2 HNO3
- 13. Скачать презентацию





 Бензен
Бензен Минеральные удобрения: польза и вред
Минеральные удобрения: польза и вред Марки бензина
Марки бензина Химические свойства алкенов (10 класс) Автор: Воложанина Л. Е., учитель химии
Химические свойства алкенов (10 класс) Автор: Воложанина Л. Е., учитель химии Гидроочистка нефти и газа
Гидроочистка нефти и газа Көмірдің оптикалық қасиеттері
Көмірдің оптикалық қасиеттері Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Оксосоединения: альдегиды и кетоны
Оксосоединения: альдегиды и кетоны Кремний и его соединения
Кремний и его соединения Химические свойства алкенов
Химические свойства алкенов Презентация Вещества и их свойства
Презентация Вещества и их свойства Основы химической термодинамики
Основы химической термодинамики Место реакции Белоусова-Жаботинского в науке
Место реакции Белоусова-Жаботинского в науке Презентация по Химии "Химические элементы в организме чеовека" - скачать смотреть
Презентация по Химии "Химические элементы в организме чеовека" - скачать смотреть  Метанол, етанол, гліцерин
Метанол, етанол, гліцерин Пожар, как комплекс физических и химических процессов и явлений. Параметры развития пожара
Пожар, как комплекс физических и химических процессов и явлений. Параметры развития пожара Ничто так не утомляет, как выполненная на совесть чужая работа Макс Фрай
Ничто так не утомляет, как выполненная на совесть чужая работа Макс Фрай Пиримидин. Оның туындылары
Пиримидин. Оның туындылары Лабораторное оборудование, посуда и средства защиты
Лабораторное оборудование, посуда и средства защиты Химический элемент мышьяк
Химический элемент мышьяк Презентація узагальнюючого уроку з теми: «Початкові хімічні поняття» Підготувала: учитель хімії вищої категорії Христинівсько
Презентація узагальнюючого уроку з теми: «Початкові хімічні поняття» Підготувала: учитель хімії вищої категорії Христинівсько Анализ качества лекарственных средств, производных алифатических и ароматических аминов
Анализ качества лекарственных средств, производных алифатических и ароматических аминов Застосування засобів захисту органів дихання від небезпечних хімічних речовин
Застосування засобів захисту органів дихання від небезпечних хімічних речовин Ископаемые углеводороды
Ископаемые углеводороды Корунд. Разновидности корунда
Корунд. Разновидности корунда Радиоактивный распад. Чернобыль
Радиоактивный распад. Чернобыль «Дело или занятие, не содержащее трудностей, недостойно ума человека» У. Ченнинг Урок-исследование Учитель: И
«Дело или занятие, не содержащее трудностей, недостойно ума человека» У. Ченнинг Урок-исследование Учитель: И Биосенсорные системы
Биосенсорные системы