Содержание
- 2. Амины (органические производные аммиака)
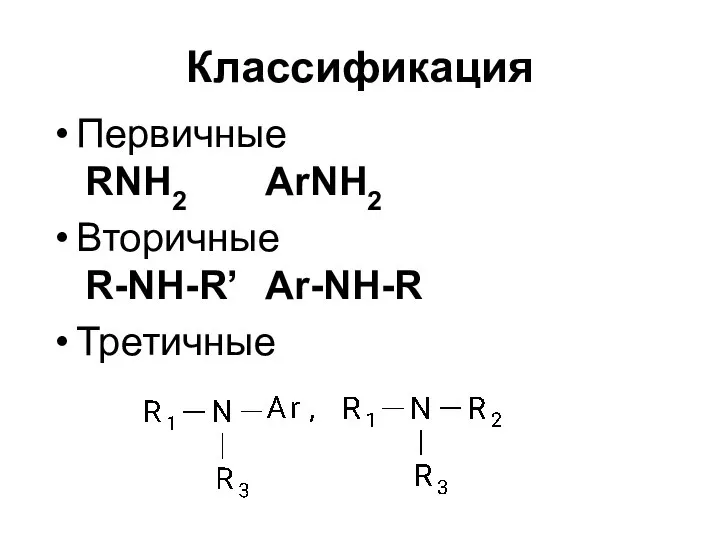
- 3. Классификация Первичные RNH2 ArNH2 Вторичные R-NH-R’ Ar-NH-R Третичные
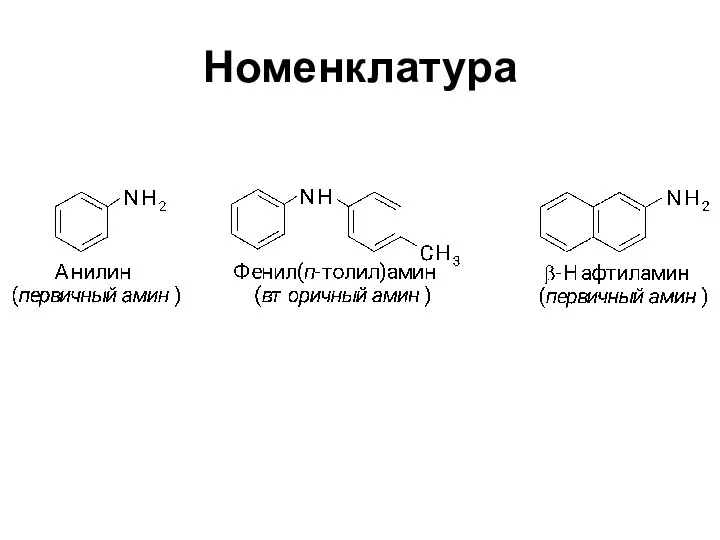
- 4. Номенклатура
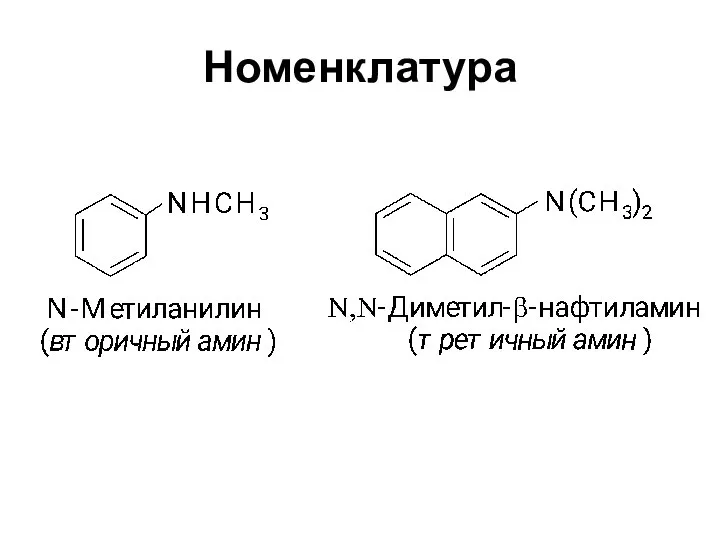
- 5. Номенклатура
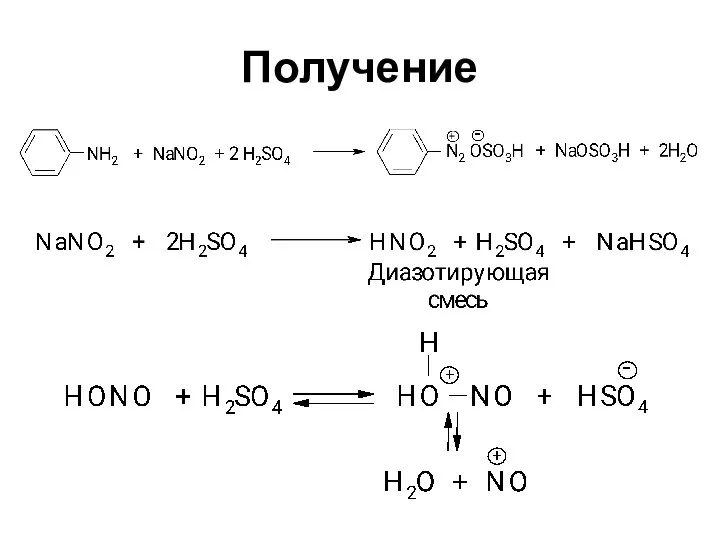
- 6. Получение
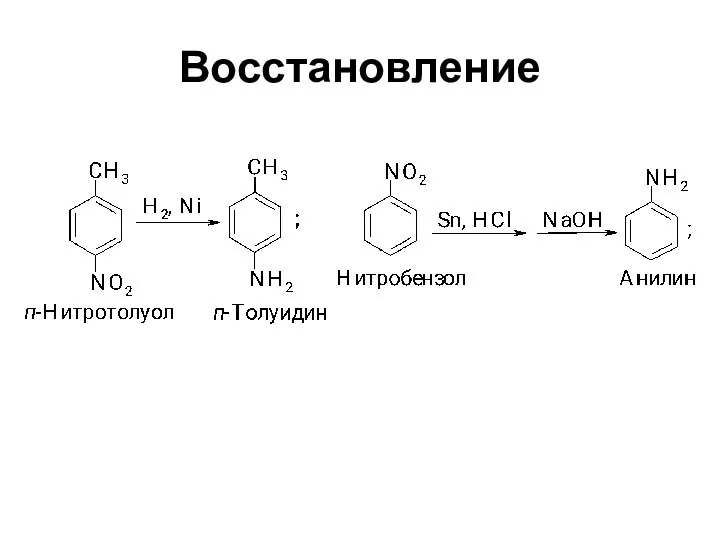
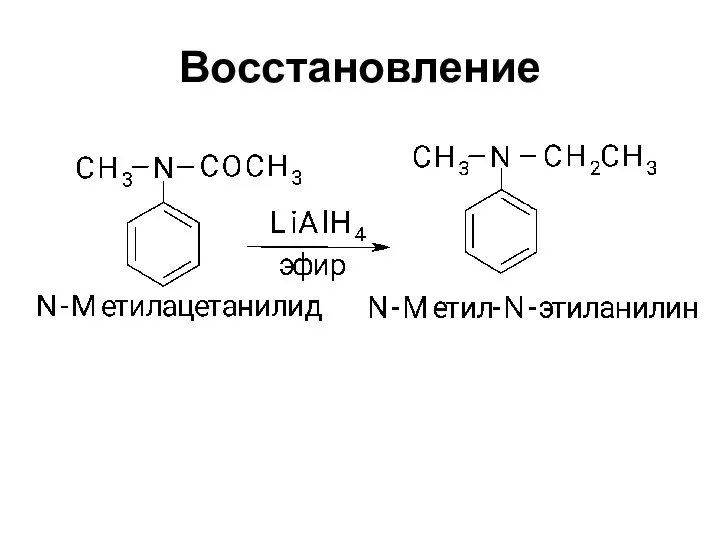
- 7. Восстановление
- 8. Восстановление
- 9. Восстановительное аминирование
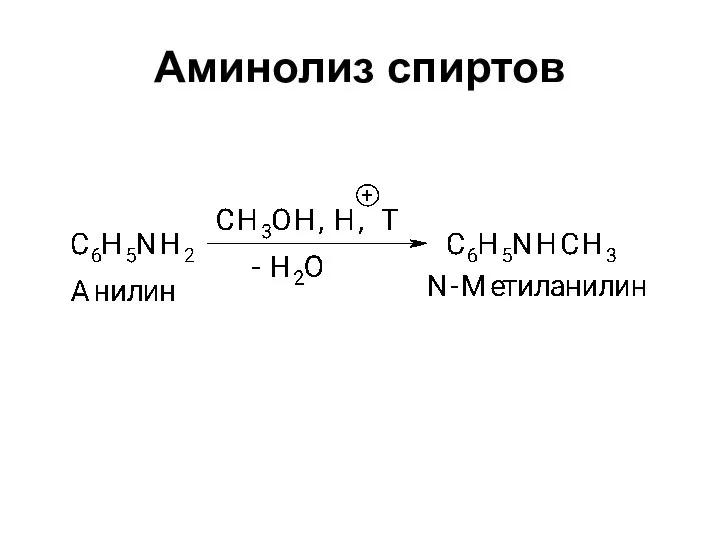
- 10. Аминолиз спиртов
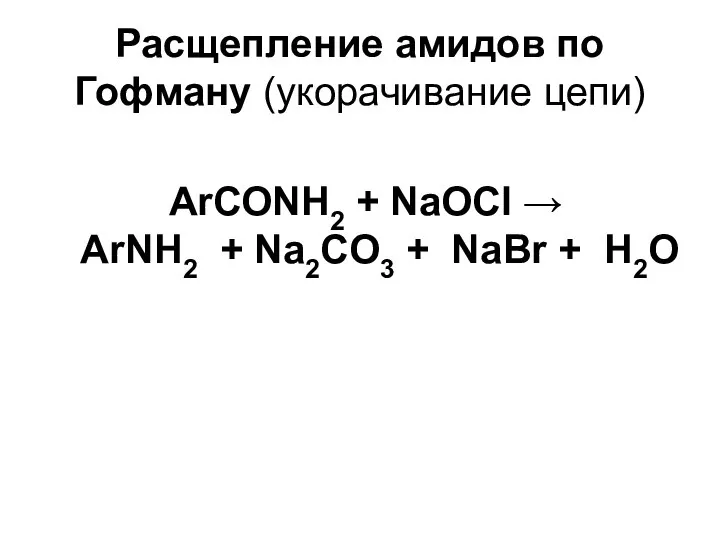
- 11. Расщепление амидов по Гофману (укорачивание цепи) ArСОNH2 + NaOCl → ArNH2 + Na2CO3 + NaBr +
- 12. Физические свойства Ароматические амины – жидкости или твердые тела с характерным неприятным запахом, сильно токсичны В
- 13. Химические свойства Амины являются основаниями Амины способны выступать в качестве нуклеофильных реагентов
- 14. Основность аминов ArNH2 + H2O → ArNH3+ + OH- раствор лакмуса окрашивают в синий цвет, фенолфталеина
- 15. Основность В + Н2О → НВ+ + НО- [OH-][HB+] Kb= ⎯⎯⎯⎯⎯⎯ [B]
- 16. Основность аминов Ароматические амины менее основны чем алифатические
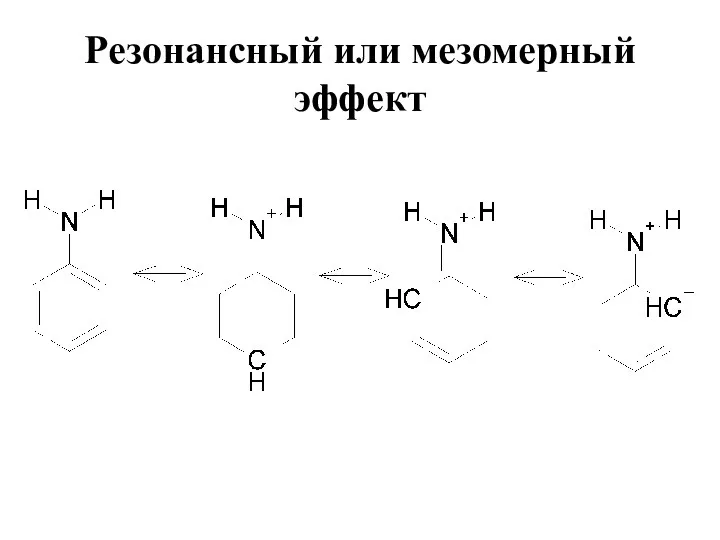
- 17. Резонансный или мезомерный эффект
- 18. Основность (pKBH+) NH3 9.21 CH3NH2 10.62 C2H5NH2 10.63 (CH3)2NH 10.71 (C2H5)2NH 10.98 (CH3)3N 9.76 (C2H5)3N 10.65
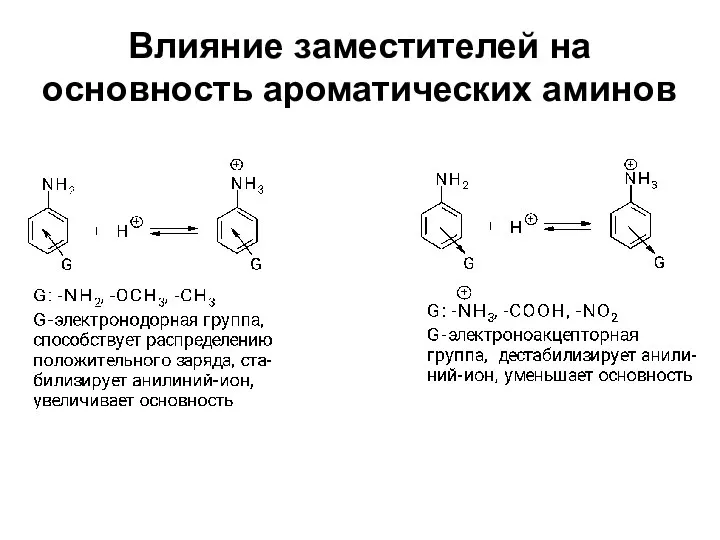
- 19. Влияние заместителей на основность ароматических аминов
- 20. RC6H4NH2 (pКBH+) R=H 4.58
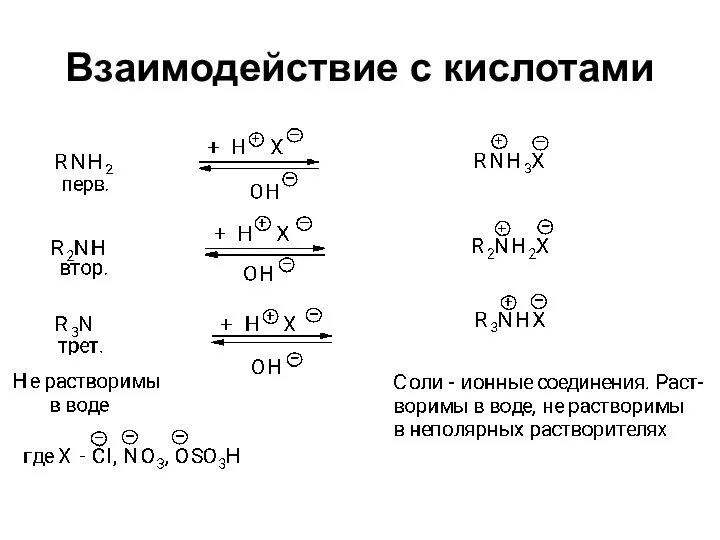
- 21. Взаимодействие с кислотами
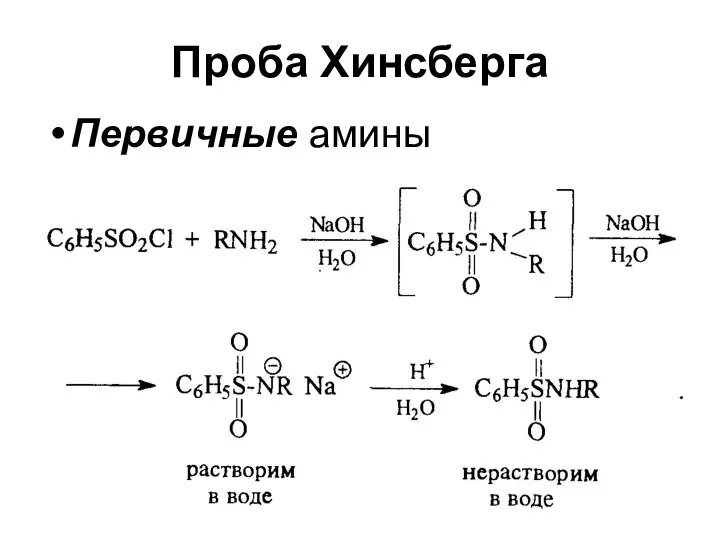
- 22. Проба Хинсберга Первичные амины
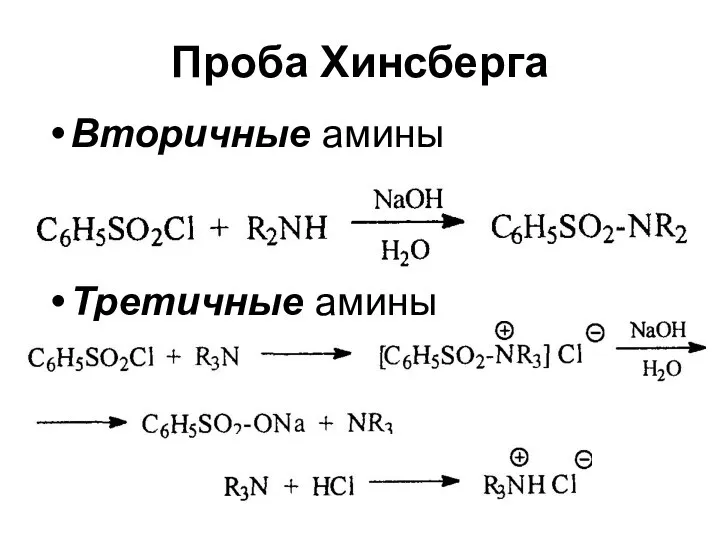
- 23. Проба Хинсберга Вторичные амины Третичные амины
- 24. Ароматические амины Первичные при взаимодействии с азотистой кислотой дают соли диазония: PhNH2∙HCl + НОNO → [Ph-N≡N]Cl
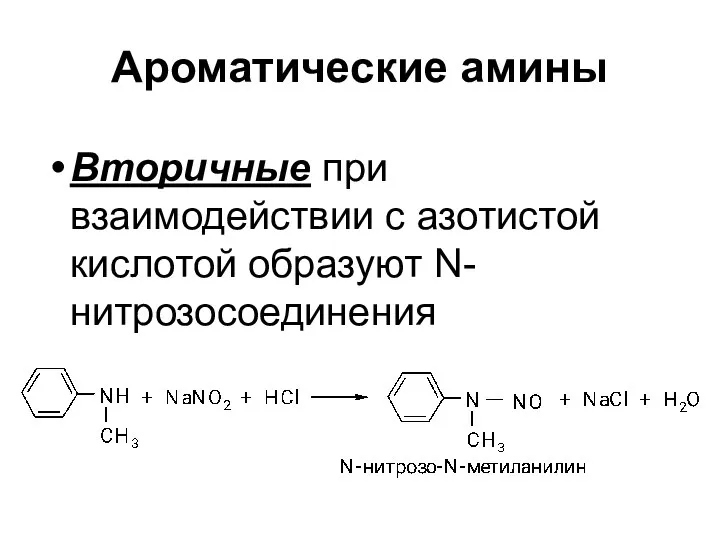
- 25. Ароматические амины Вторичные при взаимодействии с азотистой кислотой образуют N-нитрозосоединения
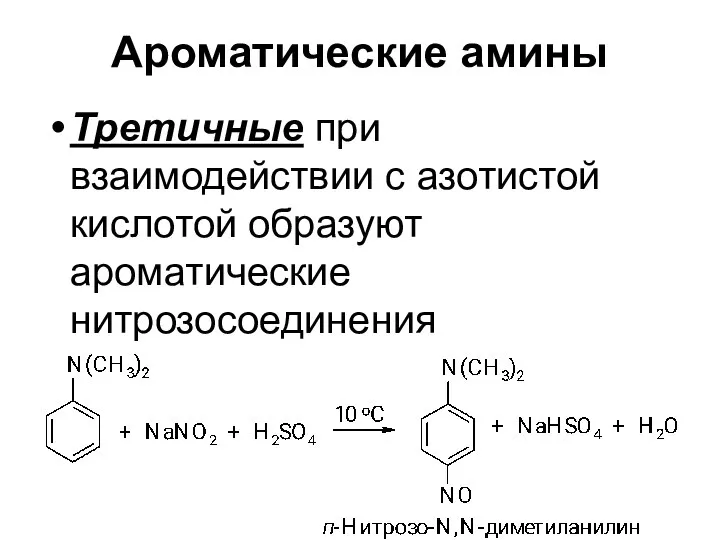
- 26. Ароматические амины Третичные при взаимодействии с азотистой кислотой образуют ароматические нитрозосоединения
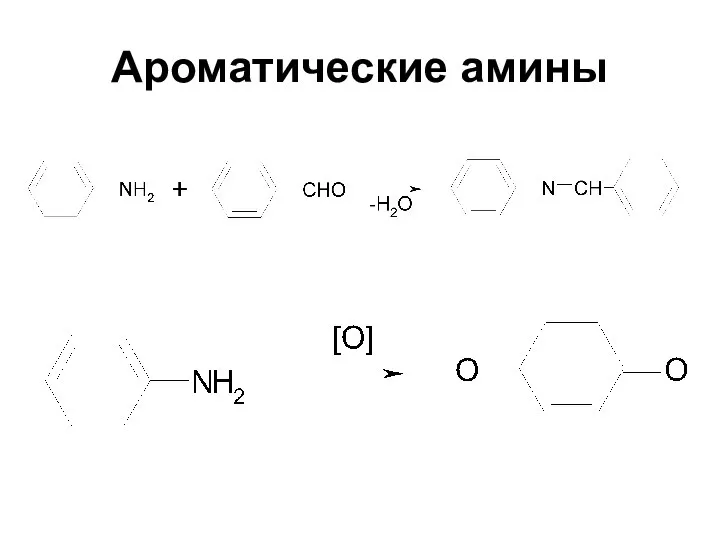
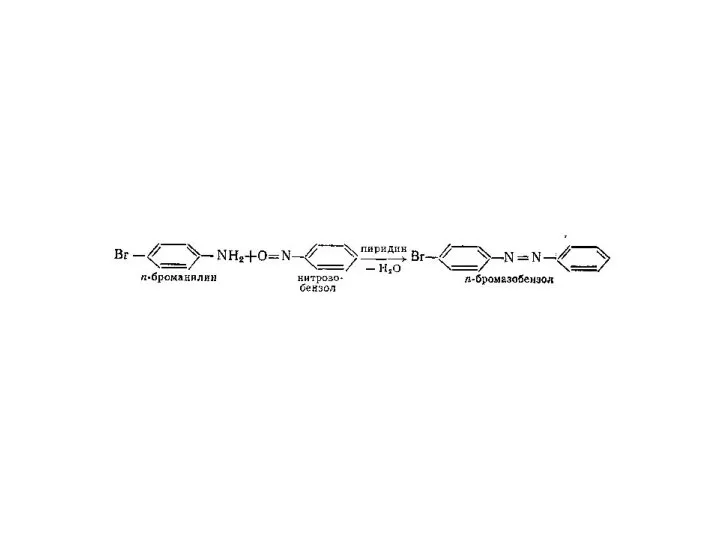
- 27. Ароматические амины
- 29. Замещение в кольце ароматических аминов
- 30. Ориентанты
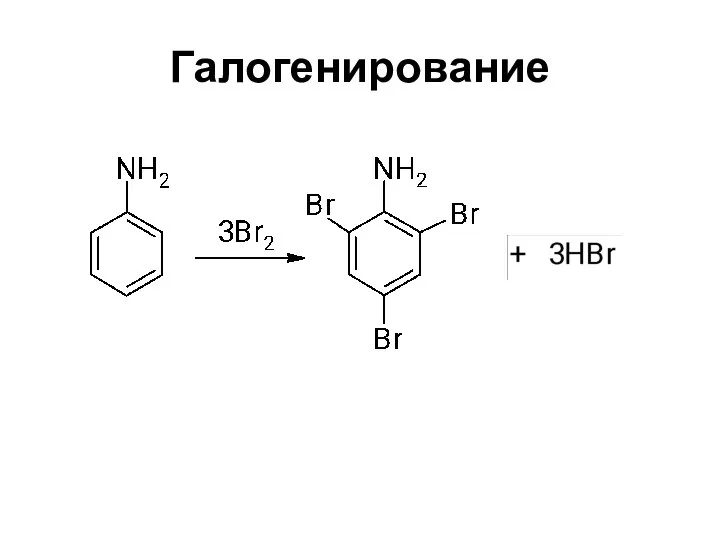
- 31. Галогенирование
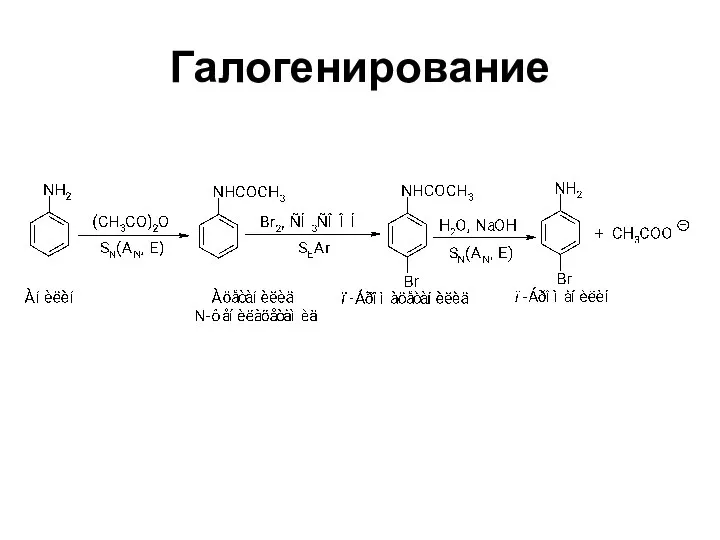
- 32. Галогенирование
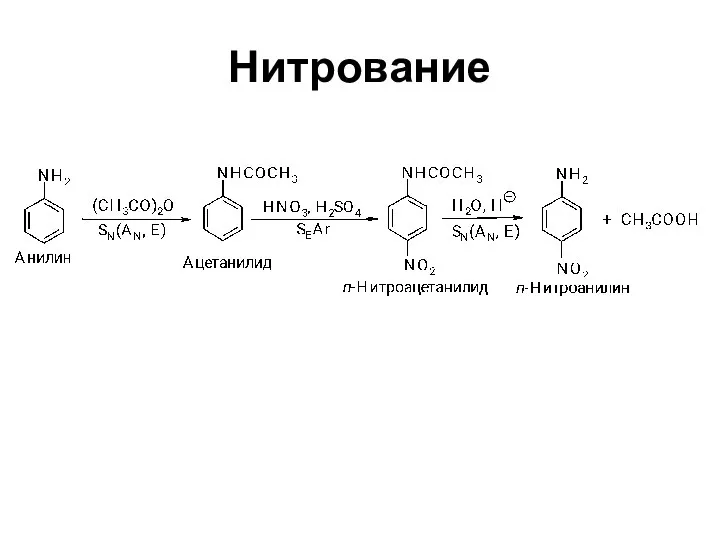
- 33. Нитрование
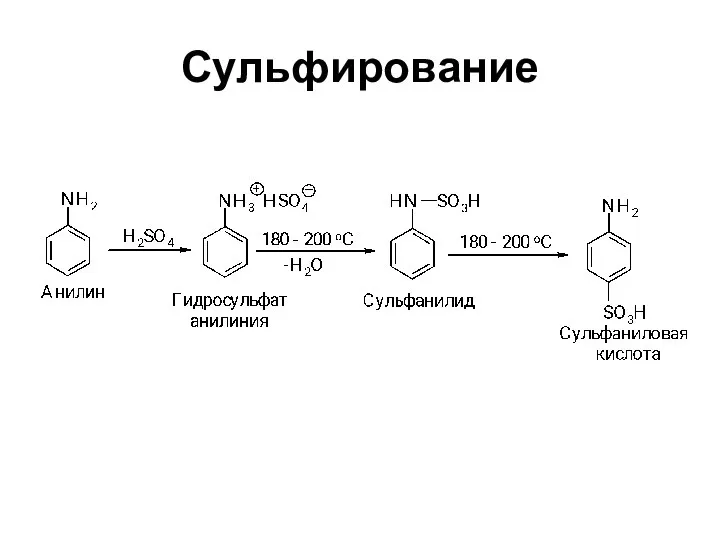
- 34. Сульфирование
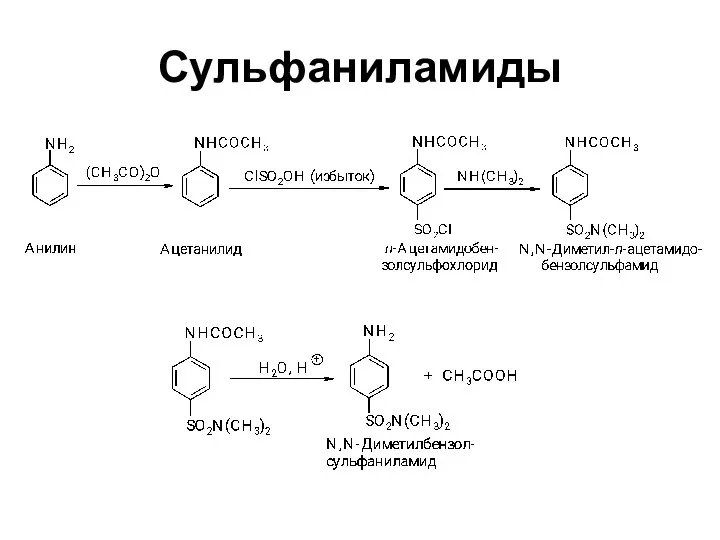
- 35. Сульфаниламиды
- 36. Диазосоединения Соли диазония
- 37. Диазосоединения В которых группа –N2– связана с углеводородным радикалом и неуглеводородным радикалом Х Ar–N2X, где X
- 38. Получение
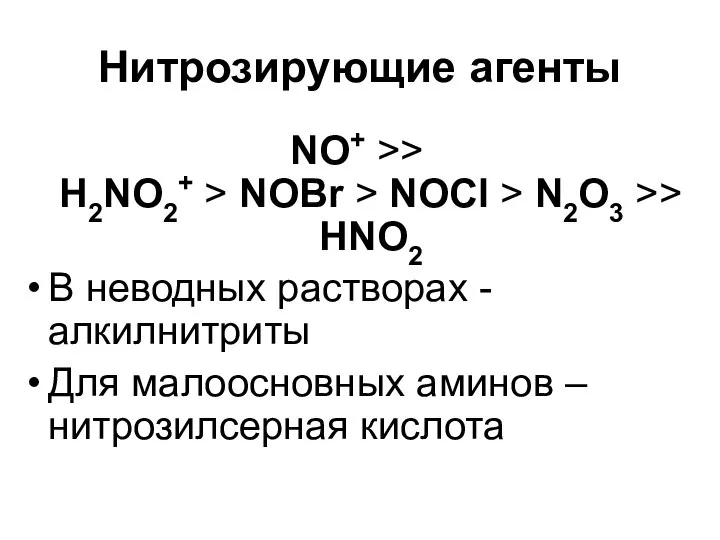
- 39. Нитрозирующие агенты NO+ >> H2NO2+ > NOBr > NOCl > N2O3 >> HNO2 В неводных растворах
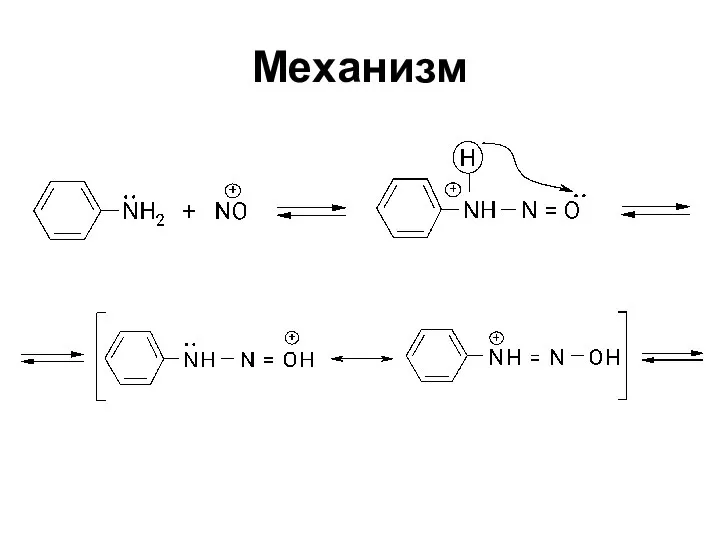
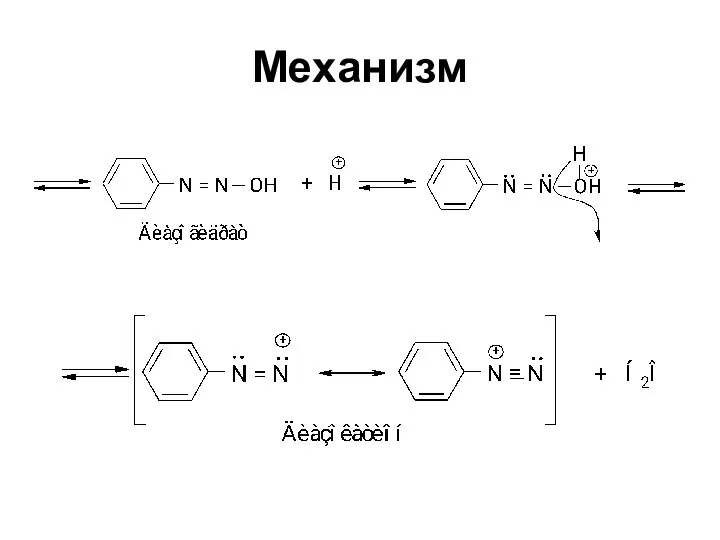
- 40. Механизм
- 41. Механизм
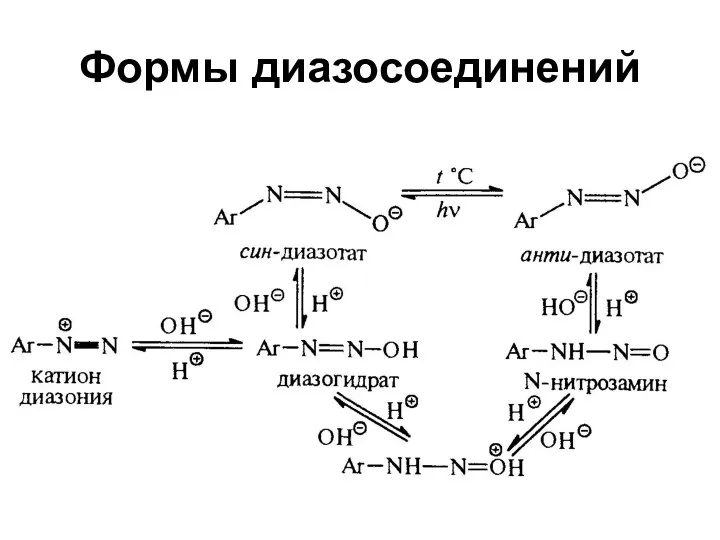
- 42. Формы диазосоединений
- 43. Свойства солей диазония
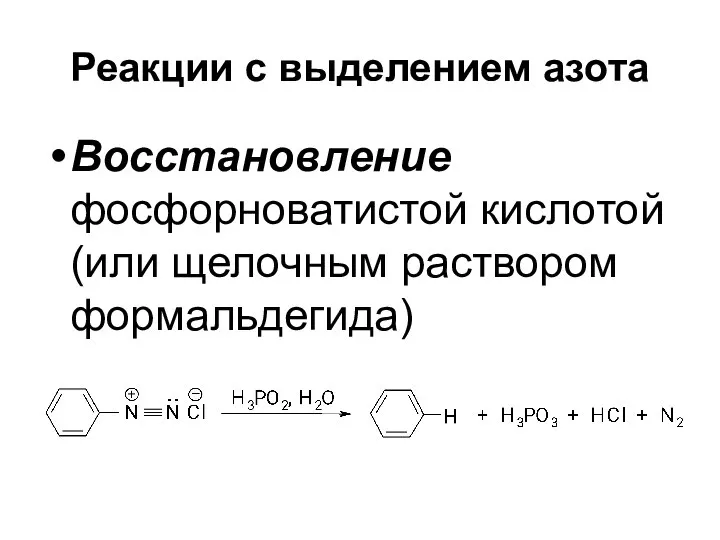
- 44. Реакции с выделением азота Восстановление фосфорноватистой кислотой (или щелочным раствором формальдегида)
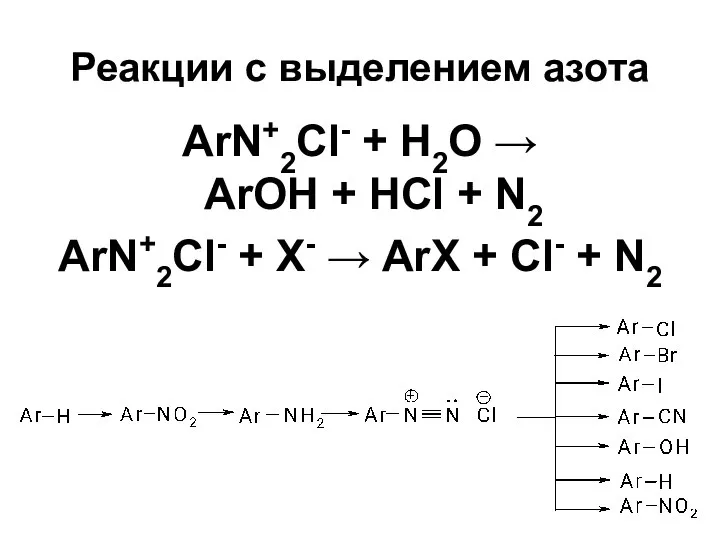
- 45. Реакции с выделением азота ArN+2Cl- + Н2О → ArOH + HCl + N2 ArN+2Cl- + X-
- 46. SN1Ar ArN2+ → N2 + Ar+ (медленно) Ar+ + Nu- → Ar-Nu Ph+ + H2O →
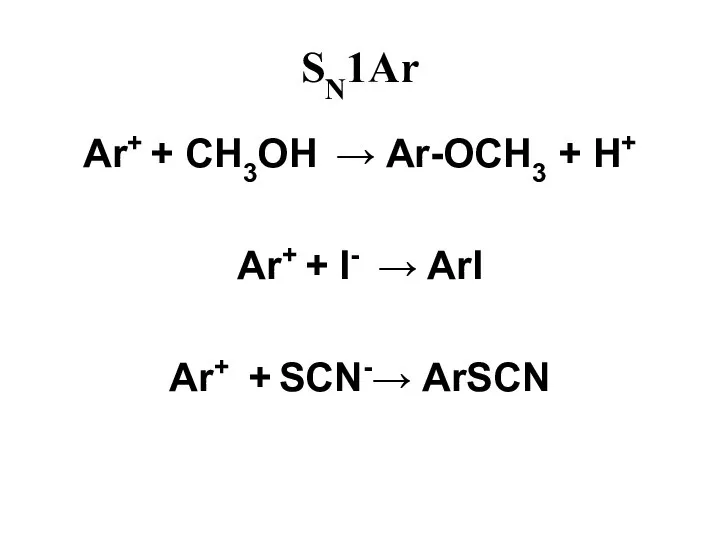
- 47. SN1Ar Ar+ + CH3OH → Ar-OCH3 + H+ Ar+ + I- → ArI Ar+ + SCN-→
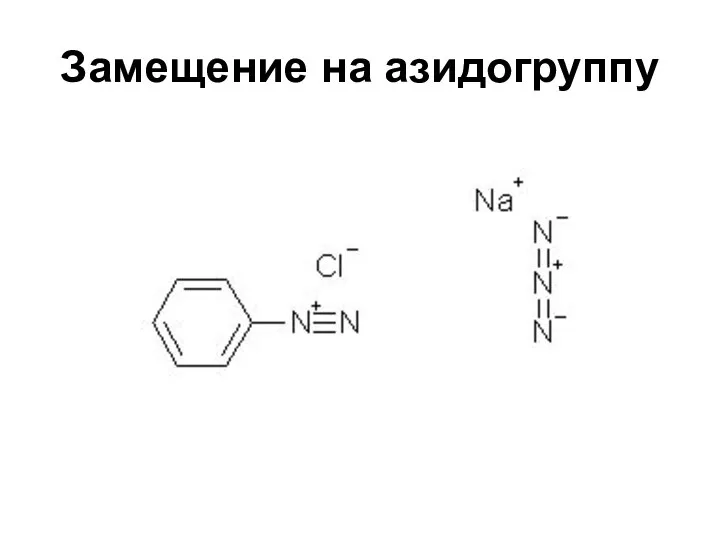
- 48. Замещение на азидогруппу
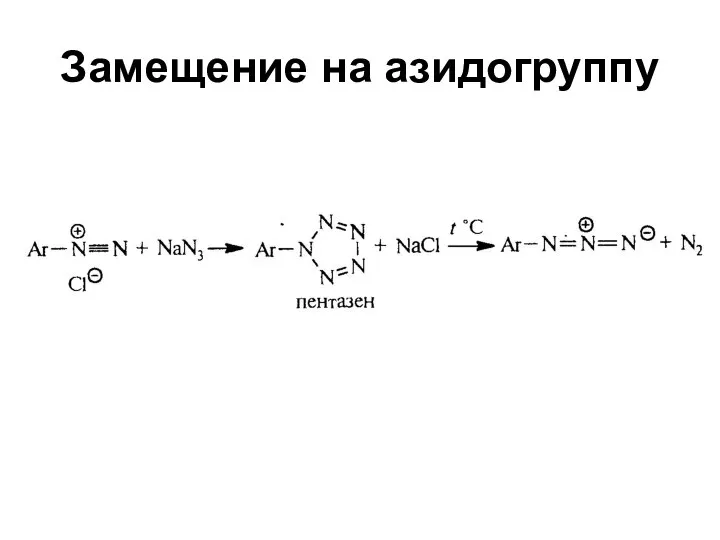
- 49. Замещение на азидогруппу
- 50. SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в ароматическом кольце 3) Ar15N+≡N ⇔
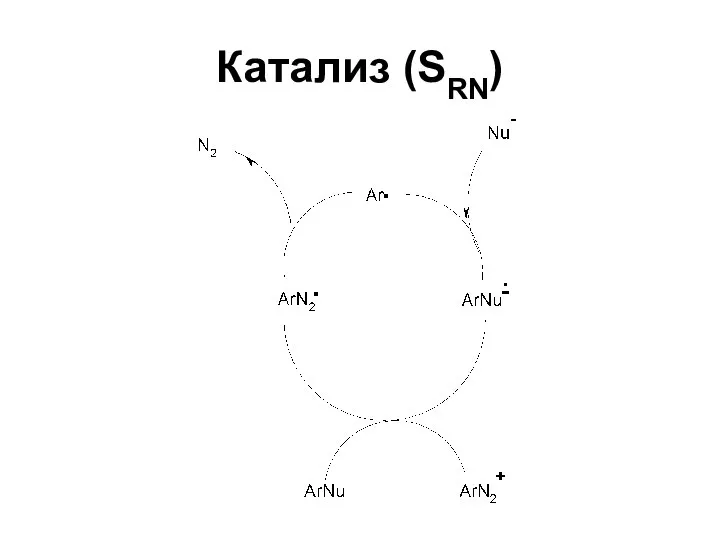
- 51. Катализ (SRN)
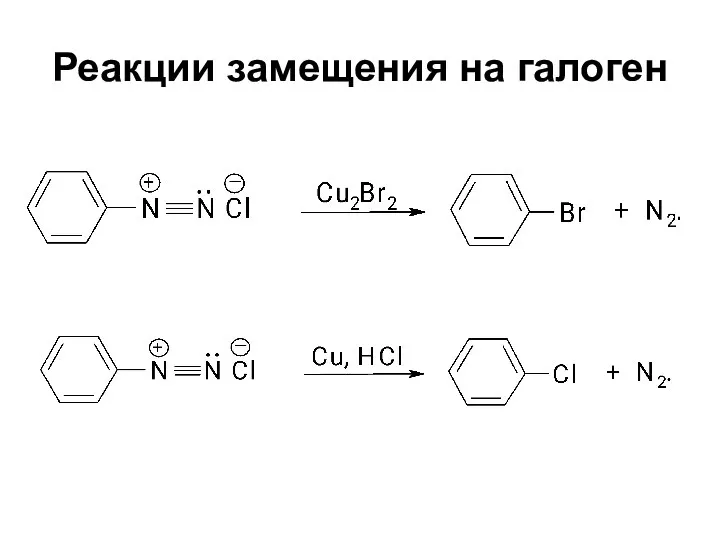
- 52. Реакции замещения на галоген Реакции с использованием галогенида меди (I) называются реакциями Зандмейера Реакции с использованием
- 53. Реакции замещения на галоген
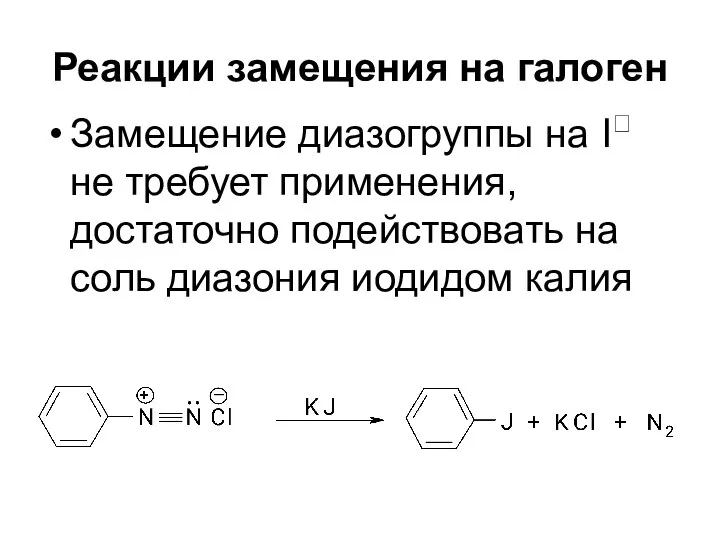
- 54. Реакции замещения на галоген Замещение диазогруппы на I не требует применения, достаточно подействовать на соль диазония
- 55. Реакции замещения на тиоционат
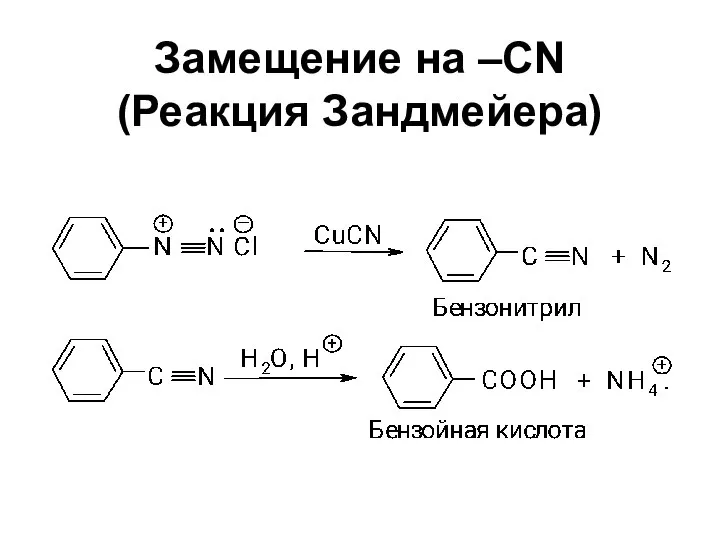
- 56. Замещение на –CN (Реакция Зандмейера)
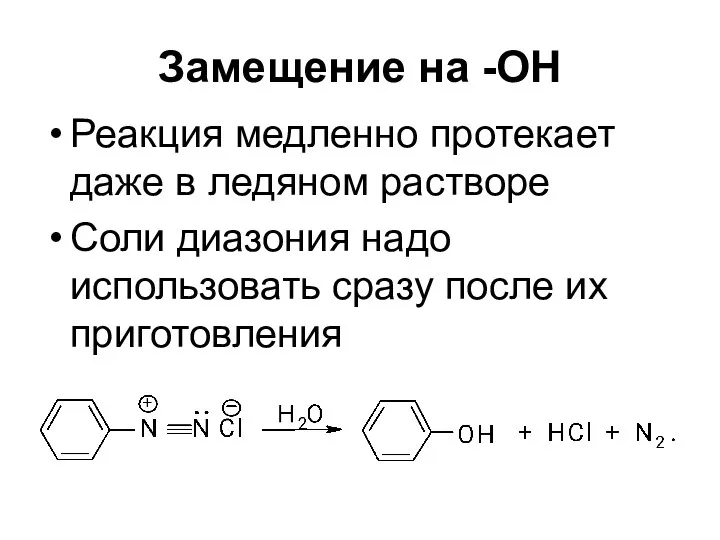
- 57. Замещение на -ОН Реакция медленно протекает даже в ледяном растворе Соли диазония надо использовать сразу после
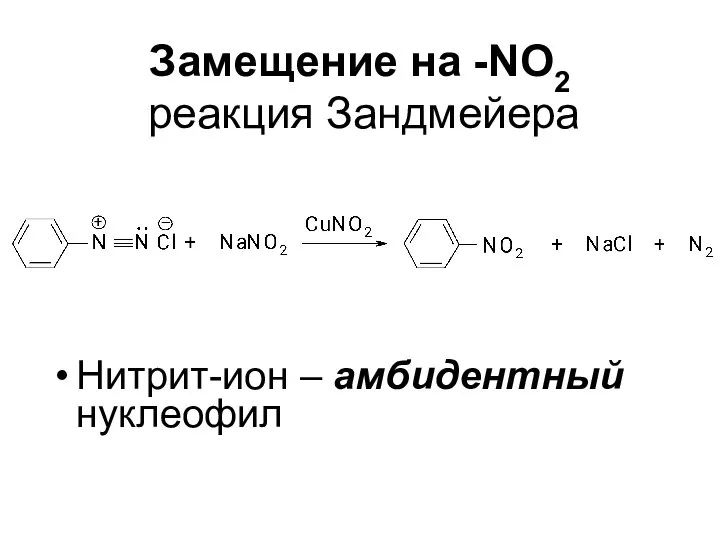
- 58. Замещение на -NО2 реакция Зандмейера Нитрит-ион – амбидентный нуклеофил
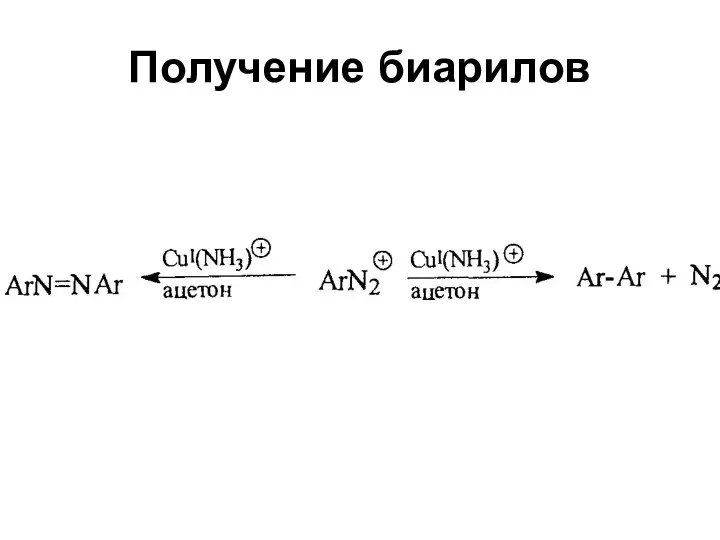
- 59. Получение биарилов
- 60. Реакции солей диазония без выделения азота
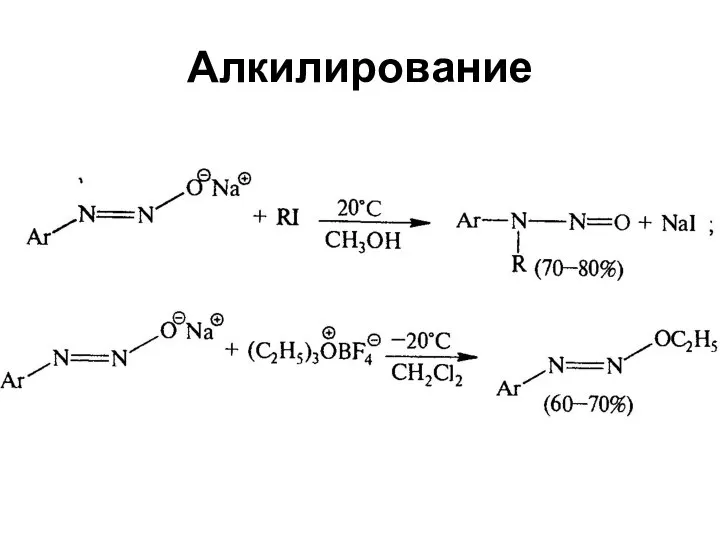
- 61. Алкилирование
- 62. Свойства диазосоединений ArN2+ + [Н] → ArNHNH2
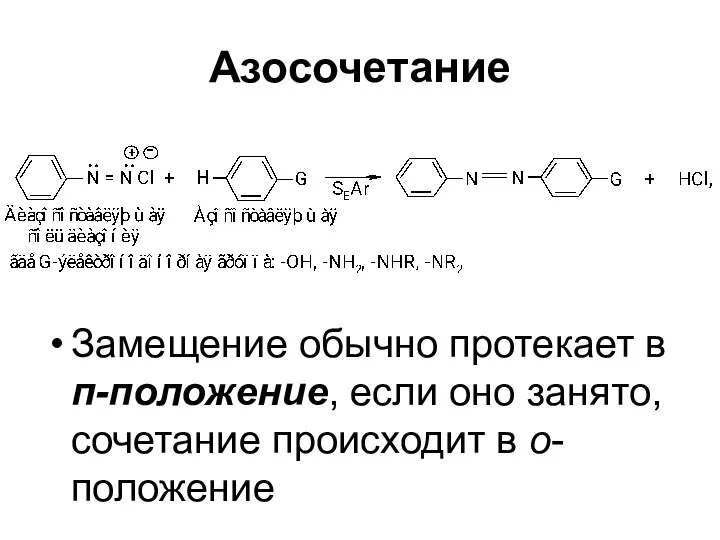
- 63. Азосочетание Соли диазония в определенных условиях реагируют с ароматическими соединениями с образованием азосоединений Ar–N=N–Ar’ Эти реакции
- 64. Азосочетание Замещение обычно протекает в п-положение, если оно занято, сочетание происходит в о-положение
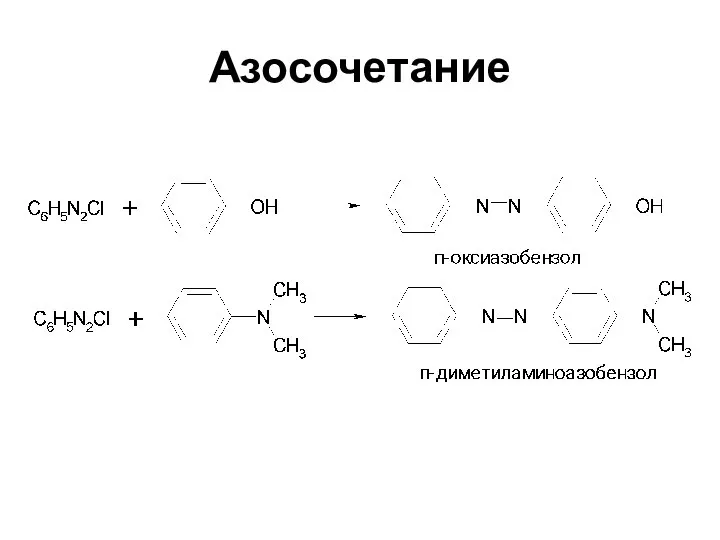
- 65. Азосочетание
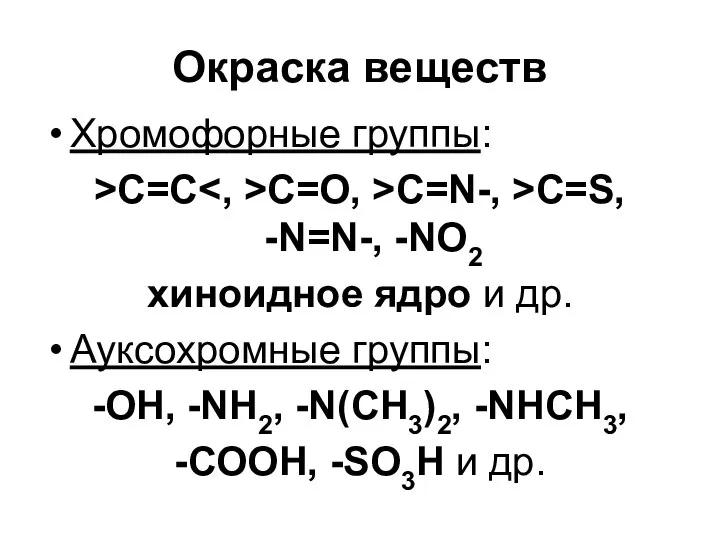
- 66. Окраска веществ Хромофорные группы: >C=C C=O, >C=N-, >C=S, -N=N-, -NO2 хиноидное ядро и др. Ауксохромные группы:
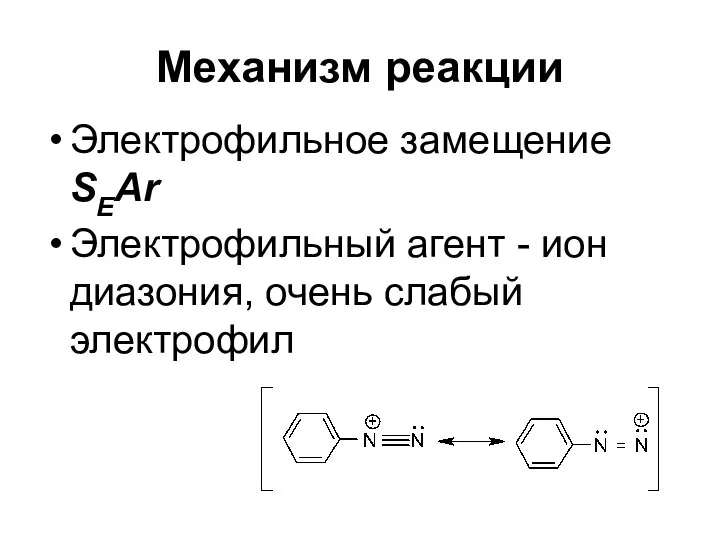
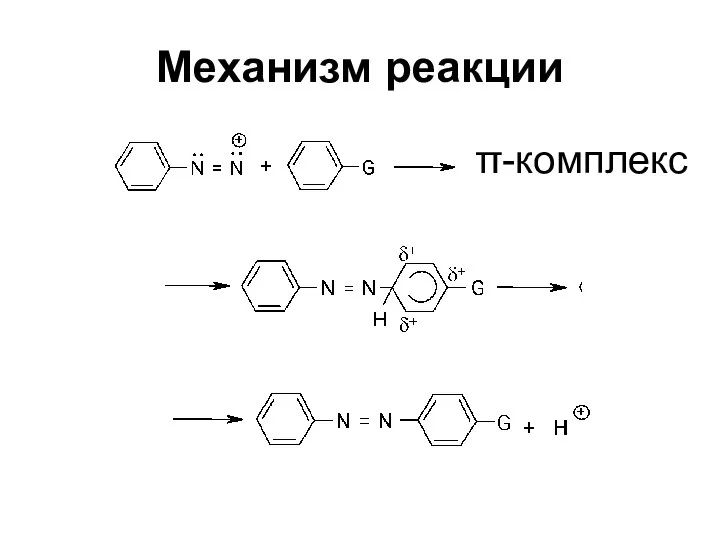
- 67. Механизм реакции Электрофильное замещение SEAr Электрофильный агент - ион диазония, очень слабый электрофил
- 68. Механизм реакции π-комплекс
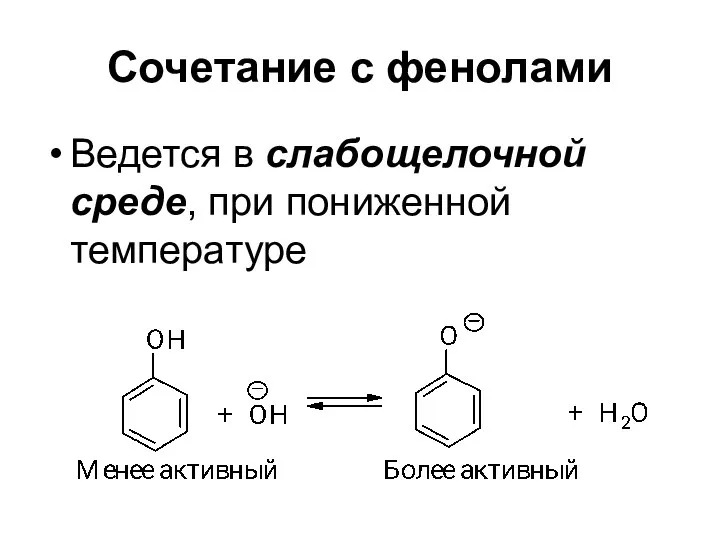
- 69. Сочетание с фенолами Ведется в слабощелочной среде, при пониженной температуре
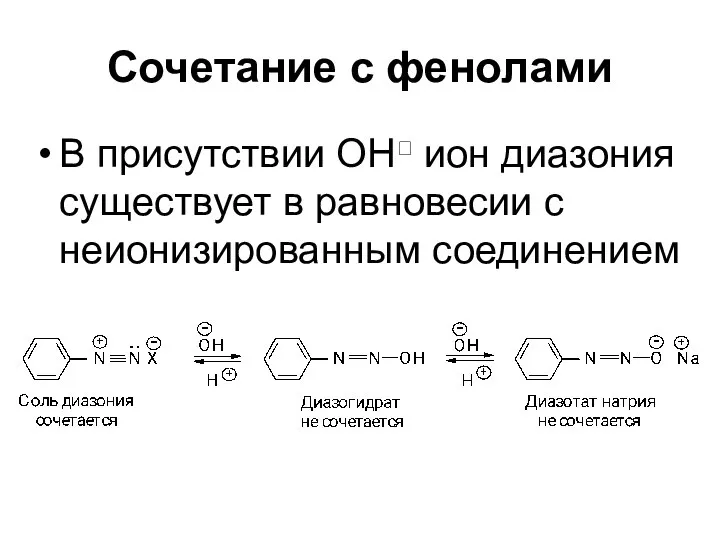
- 70. Сочетание с фенолами В присутствии ОН ион диазония существует в равновесии с неионизированным соединением
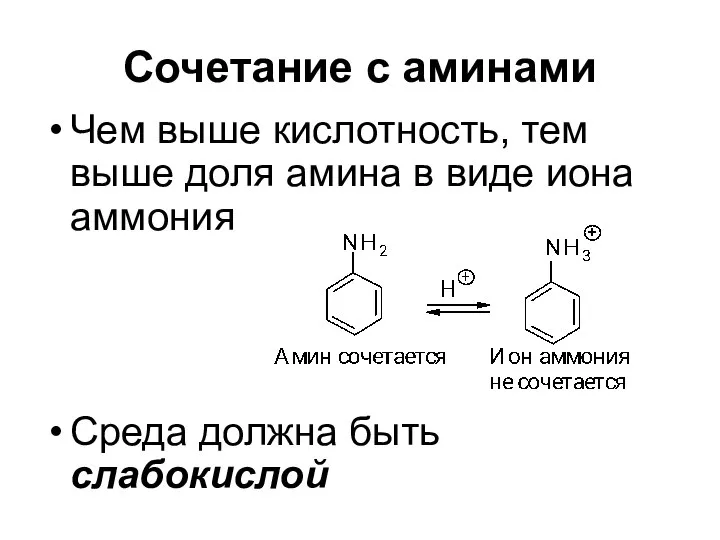
- 71. Сочетание с аминами Высокая кислотность среды способствует тому, что диазосоединение полностью находится в виде диазокатиона
- 72. Сочетание с аминами Чем выше кислотность, тем выше доля амина в виде иона аммония Среда должна
- 73. Синтез п-нитроанилинового красного
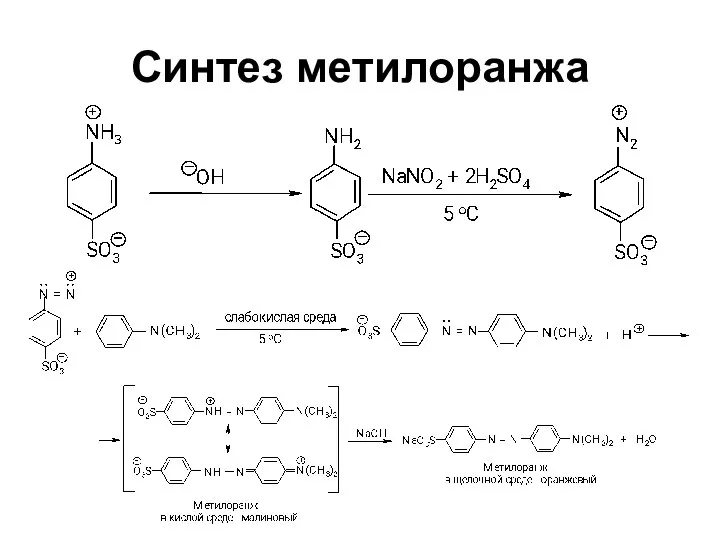
- 74. Синтез метилоранжа
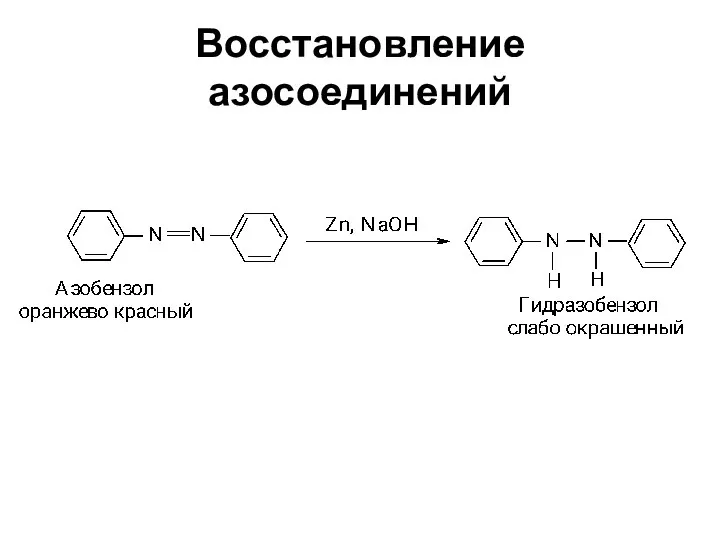
- 75. Восстановление азосоединений
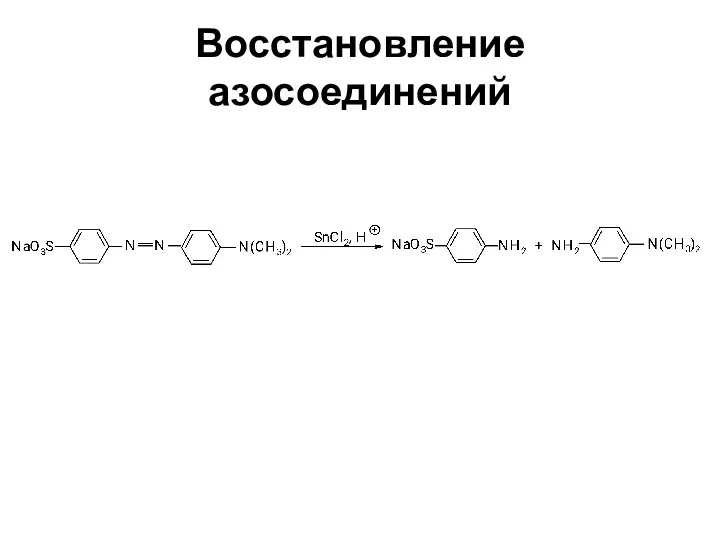
- 76. Восстановление азосоединений
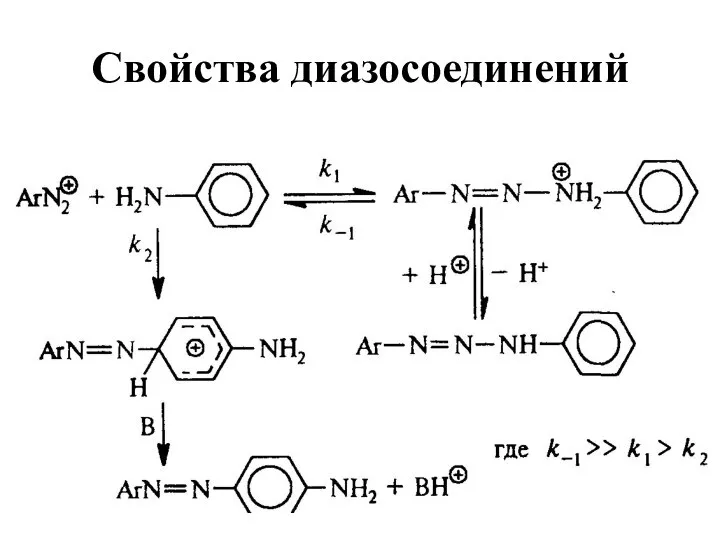
- 77. Свойства диазосоединений Для первичных и вторичных ароматических аминов азогруппа вступает не в ароматическое кольцо, а в
- 78. Свойства диазосоединений
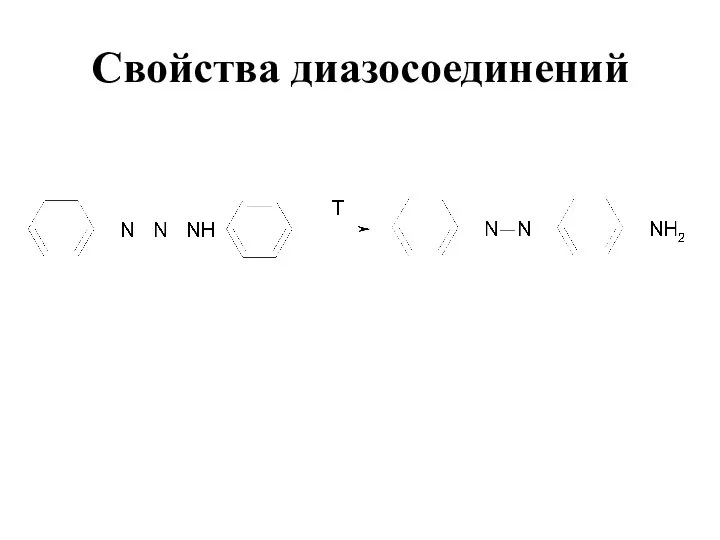
- 79. Свойства диазосоединений
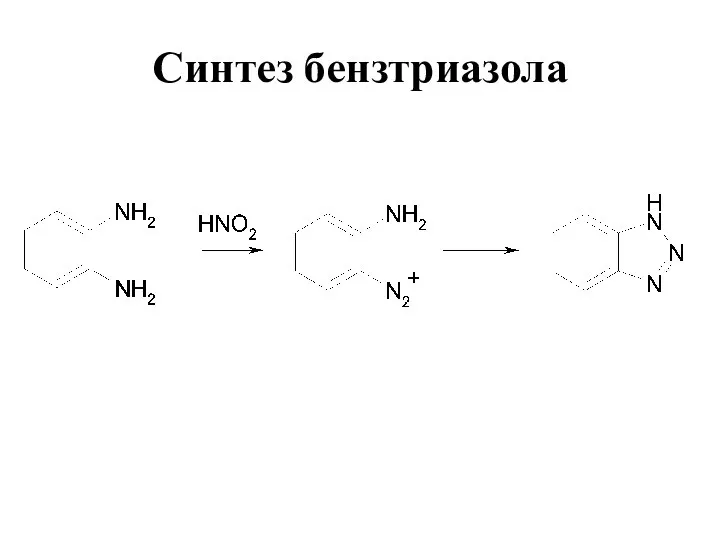
- 80. Синтез бензтриазола
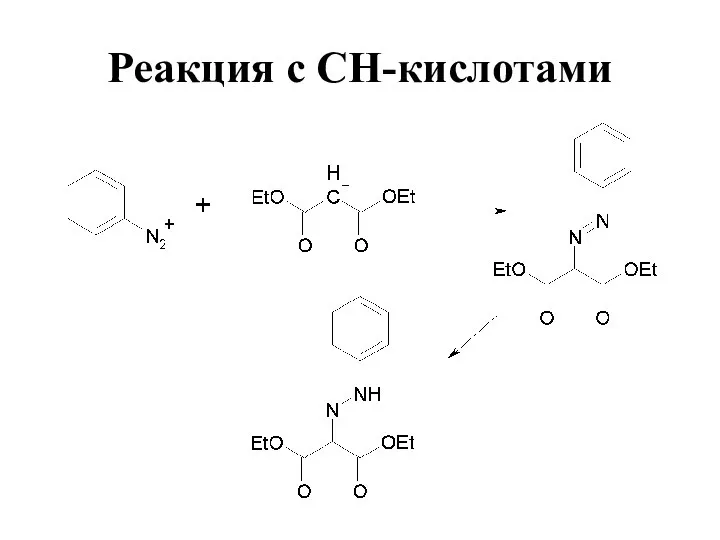
- 81. Реакция с СН-кислотами
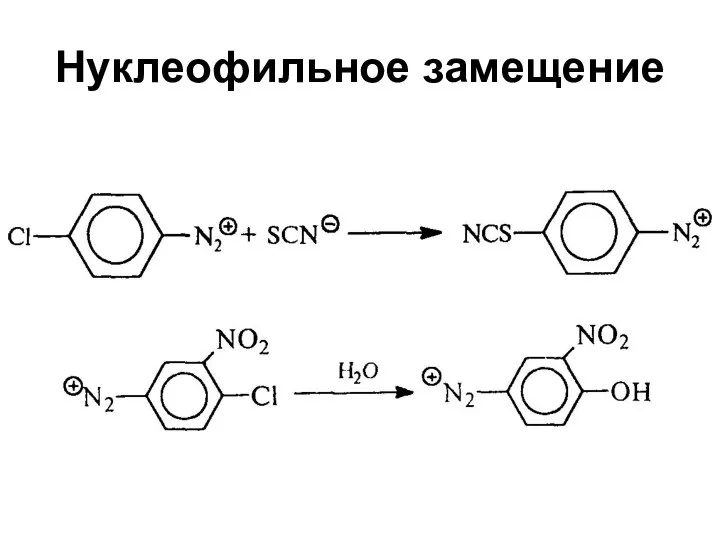
- 82. Нуклеофильное замещение
- 84. Скачать презентацию






![Основность В + Н2О → НВ+ + НО- [OH-][HB+] Kb= ⎯⎯⎯⎯⎯⎯ [B]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1167589/slide-14.jpg)









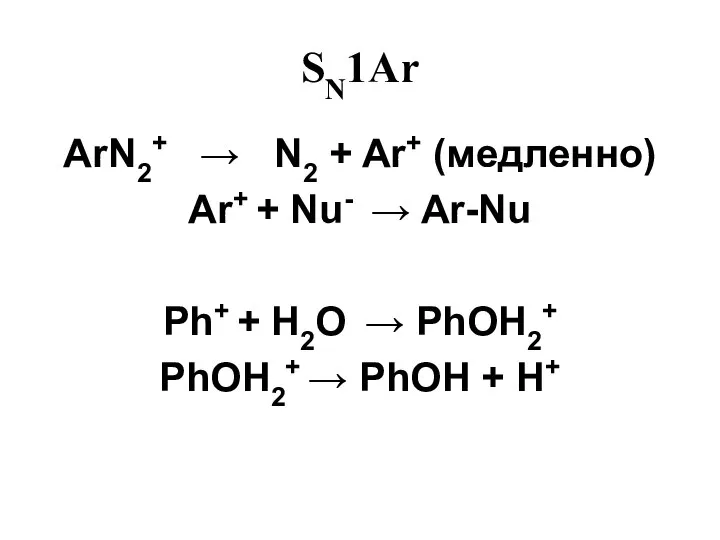
![SN1Ar 1) Скорость не зависит от [Nu] 2) Влияние заместителей в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1167589/slide-49.jpg)



![Свойства диазосоединений ArN2+ + [Н] → ArNHNH2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1167589/slide-61.jpg)




 Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Майлардың анықтамасы
Майлардың анықтамасы Общая радиохимия. Свойства радиоколлоидов
Общая радиохимия. Свойства радиоколлоидов Строение атома углерода
Строение атома углерода Да здравствует мыло душистое
Да здравствует мыло душистое Химические и физико-химические методы анализа. Сущность и методы качественного анализа
Химические и физико-химические методы анализа. Сущность и методы качественного анализа Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Уравнения химических реакций
Уравнения химических реакций Азотсодержащие соединения. Амины
Азотсодержащие соединения. Амины Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Гидролиз. Сущность процесса гидролиза
Гидролиз. Сущность процесса гидролиза Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Исследовательский проект «Кристаллы»
Исследовательский проект «Кристаллы» Минералы. Классы минералов
Минералы. Классы минералов Спирты
Спирты Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Пищевые добавки
Пищевые добавки Основания и кислоты. Тема 2
Основания и кислоты. Тема 2 Зміна ліпідів за технологічної обробки
Зміна ліпідів за технологічної обробки Презентация по Химии "Степень окисления" - скачать смотреть бесплатно_
Презентация по Химии "Степень окисления" - скачать смотреть бесплатно_ Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть
Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть  Области применения спиртов
Области применения спиртов Применение синтетических полимеров в вооружении
Применение синтетических полимеров в вооружении Пластик, пластмасса
Пластик, пластмасса Распознавание химических соединений
Распознавание химических соединений Основы безопасности при уничтожении химического оружия
Основы безопасности при уничтожении химического оружия Сера и ее аллотропные модификации. (9 класс)
Сера и ее аллотропные модификации. (9 класс) Виды химической связи
Виды химической связи