Содержание
- 2. Элементы Vа группы
- 3. Строение атомов и степени окисления На внешнем энергетическом уровне элементы V-A группы содержат по 5 электронов.
- 4. Фосфор образует различные (аллотропные модификации). Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет
- 5. Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор
- 6. Простые вещества
- 7. Аммиак
- 8. Оксиды азота Оксиды азота I, II, IV N2O – бесцветный газ со сладким запахом, плохо растворим
- 9. Оксид азота (V), азотная кислота, нитраты Химические свойства азотной кислоты Общие кислотные свойства азотной кислоты Если
- 10. Особые свойства нитратов
- 12. Скачать презентацию
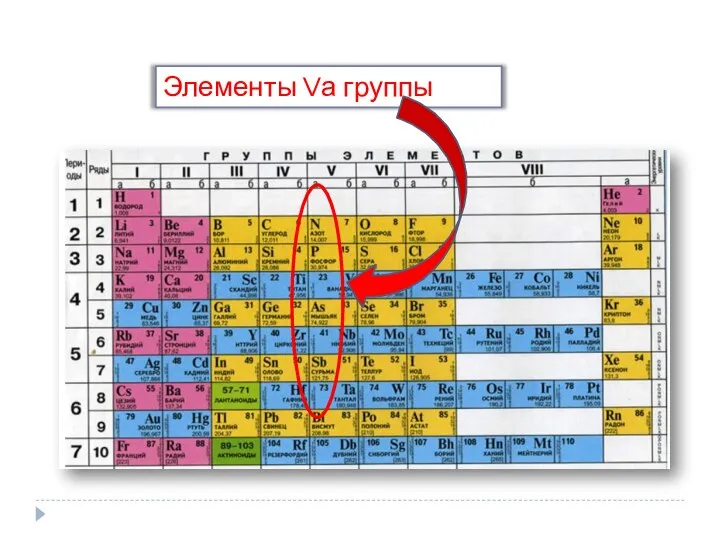
Элементы Vа группы
Элементы Vа группы
Строение атомов и степени окисления
На внешнем энергетическом уровне элементы V-A группы
Строение атомов и степени окисления
На внешнем энергетическом уровне элементы V-A группы
У атомов всех элементов, кроме азота, в возбужденном состоянии увеличивается количество неспаренных электронов, поэтому они могут проявлять валентность V.
Высшая валентность азота IV.
N: 2s22p2 P, As, Sb: ns2np2nd0
+5 N2O5, HNO3, NO3- +5 P2O5, H3PO3, PO43-
+4 NO2
+3 N2O3, HNO2, NO2- +3 P2O3, PCl3
+2 NO
+1 N2O
0 N2 0 Ркр, Рбел
-3 NH3, NH4+, N-3 -3 PH3, PH4+, P-3
Фосфор образует различные (аллотропные модификации).
Белый фосфор — это вещество состава P4.
Мягкий, бесцветный,
Фосфор образует различные (аллотропные модификации).
Белый фосфор — это вещество состава P4.
Мягкий, бесцветный,
Молекулярная кристаллическая решетка, а следовательно,
невысокая температура плавления (44°С),
высокая летучесть.
Очень реакционно способен,
самовоспламеняется на воздухе.
Азот (греч. азотикос – безжизненный) – бесцветный газ, без цвета, запаха и вкуса.
Не поддерживает дыхание и горение, один из основных компонентов воздуха (объемная доля ~78%), нерастворим в воде.
Простые вещества
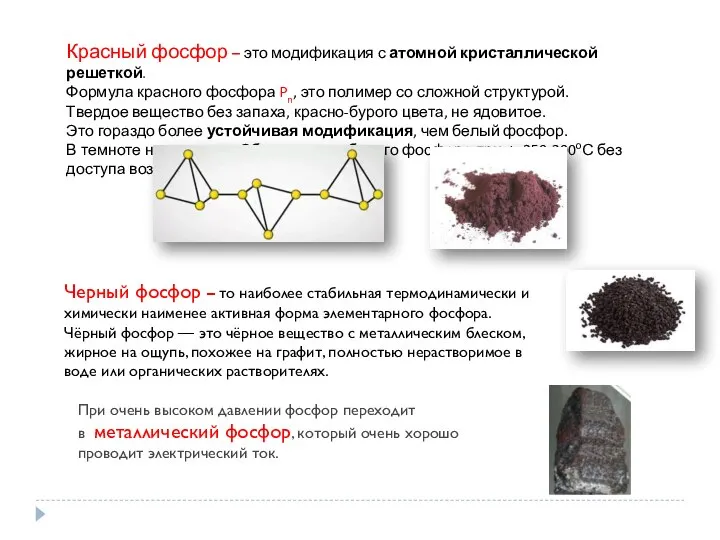
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного
Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь, похожее на графит, полностью нерастворимое в воде или органических растворителях.
При очень высоком давлении фосфор переходит в металлический фосфор, который очень хорошо проводит электрический ток.
Красный фосфор – это модификация с атомной кристаллической решеткой.
Формула красного фосфора Pn, это полимер со сложной структурой.
Твердое вещество без запаха, красно-бурого цвета, не ядовитое.
Это гораздо более устойчивая модификация, чем белый фосфор.
В темноте не светится. Образуется из белого фосфора при t=250-300оС без доступа воздуха.
Простые вещества
Простые вещества
Аммиак
Аммиак
Оксиды азота
Оксиды азота I, II, IV
N2O – бесцветный газ со сладким
Оксиды азота
Оксиды азота I, II, IV
N2O – бесцветный газ со сладким
NO - бесцветный газ, плохо растворим в воде, ядовитый.
NO2 – бурый газ, ядовитый.
Химические свойства оксидов азота I, II, IV
Оксиды азота I и II являются несолеобразующими, проявляют окислительные и восстановительные свойства: 2NO + O2 = 2NO2
N2O + Mg = N2 + MgO
Оксид азота IV считается кислотным, реагирует с водой и растворами щелочей:
2NO2 + H2O = HNO2 + HNO3 (или 3NO2 + H2O = 2HNO3 + NO)
2NO2 + 2KOH = KNO2 + KNO3 + H2O
Если реакция протекает в присутствии кислорода, то образуется только одна соль:
4NO2 + 4KOH + 2O2 = 4KNO3 + 2H2O
Некоторые металлы окисляются оксидом азота (IV):
2NO2 + 4Cu = 4CuO + N2
Оксид азота (III), азотистая кислота, нитриты
Оксид азота (III) – синяя подвижная жидкость, разлагается при комнатной температуре,
растворим в воде с образованием слабой неустойчивой азотистой кислоты.
Оксид азота (III) – кислотный, реагирует с водой и щелочами, легко разлагается:
Химические свойства оксида азота (III) и нитритов
N2O3 + H2O = 2HNO2
N2O3 = NO2 + NO
Нитриты в ОВР проявляют окислительные и восстановительные свойства:
KNO2 + Br2 + H2O = KNO3 + 2HBr
2KNO2 + 2KI + 2H2SO4 = I2 + 2NO + 2K2SO4 + 2H2O
Оксид азота (V), азотная кислота, нитраты
Химические свойства азотной кислоты
Общие кислотные свойства
Оксид азота (V), азотная кислота, нитраты
Химические свойства азотной кислоты
Общие кислотные свойства
Если основной оксид, основание или соль не могут проявлять восстановительных свойств, то реакция протекает, как с обычными кислотами:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Окислительные свойства азотной кислоты
Азотная кислота в любых концентрациях является окислителем. Она реагирует со всеми металлами, кроме золота и металлов платиновой группы, по схеме:
Me + HNO3 = нитрат + вода + соединение азота (NO2, NO, N2O, N2, NH4NO3).
Чем активнее металл и меньше концентрация кислоты, тем ниже будет степень окисления у азота.
При комнатной температуре концентрированная азотная кислота пассивирует алюминий, железо, хром и свинец.
Cu + 4HNO3(конц) = 2NO + Cu(NO3)2 + 2H2O
3Cu + 8HNO3(разб) = 2NO + Cu(NO3)2 + 4H2O
Fe + 4HNO3(разб) = NO + Fe(NO3)3 + 2H2O
10K + 12HNO3(конц) = 10KNO3 + N2 + 6H2O
Также азотная кислота окисляет неметаллы (C, S, P, I2) и некоторые сложные вещества, восстанавливаясь при этом обычно до NO2:
P + 5HNO3(конц) = 5NO2 + H2O + H3PO4
S + 6HNO3(разб) = H2SO4 + 6NO2 + 2H2O
ZnS + 8HNO3(конц) = ZnSO4 + 8NO2 + 4H2O
Fe(OH)2 + 4HNO3(конц) = Fe(NO3)3 + NO2 + 3H2O
При нагревании и на свету азотная кислота разлагается
4HNO3 ↔ 4NO2 + 2H2O + O2
Особые свойства нитратов
Особые свойства нитратов







 Элементы химической термодинамики и биоэнергетики
Элементы химической термодинамики и биоэнергетики Алканы. Алкены. Алкины
Алканы. Алкены. Алкины Добавки, красители и консерванты в пищевых продуктах
Добавки, красители и консерванты в пищевых продуктах Правила безопасности во дворе
Правила безопасности во дворе Матеріалознавство. Будова твердих тіл та вплив на їх властивості
Матеріалознавство. Будова твердих тіл та вплив на їх властивості Кальций туралы
Кальций туралы Организация физической защиты ДРМ
Организация физической защиты ДРМ Цікаві досліди з хімії
Цікаві досліди з хімії Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.
Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.  Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе
Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе Сложные эфиры. Жиры
Сложные эфиры. Жиры Химический состав микроорганизмов-деструкторов
Химический состав микроорганизмов-деструкторов Періодична система хімічних елементів
Періодична система хімічних елементів Презентація на тему: Пластмаси. Їх роль у сучасному виробництві.
Презентація на тему: Пластмаси. Їх роль у сучасному виробництві.  Вода – чудо жизни
Вода – чудо жизни Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Горение твердого топлива
Горение твердого топлива Массовая доля вещества в растворе
Массовая доля вещества в растворе Исследование условий образования внутренних тангенциальных азеотропов в бинарных двухфазных системах
Исследование условий образования внутренних тангенциальных азеотропов в бинарных двухфазных системах Химическая термодинамика
Химическая термодинамика Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов
Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Свойства нейтральных атомов. Лекция 4
Свойства нейтральных атомов. Лекция 4 Топаз
Топаз ВЫПОЛНИЛА: УЧЕНИЦА 10А СРЕДНЕЙ ШКОЛЫ №9 ПОСПЕЛОВА АЛИНА ПРОВЕРИЛА: БОРЗЫХ Т.Н.
ВЫПОЛНИЛА: УЧЕНИЦА 10А СРЕДНЕЙ ШКОЛЫ №9 ПОСПЕЛОВА АЛИНА ПРОВЕРИЛА: БОРЗЫХ Т.Н. Нефтяные масла. Основная информация
Нефтяные масла. Основная информация Радиоактивность
Радиоактивность Волшебные свойства воды
Волшебные свойства воды