Содержание
- 2. V группа А подгруппа К элементам этой подгруппы относятся: N ; P ; As ; Sb;
- 3. Характеристика азота и фосфора по периодической системе
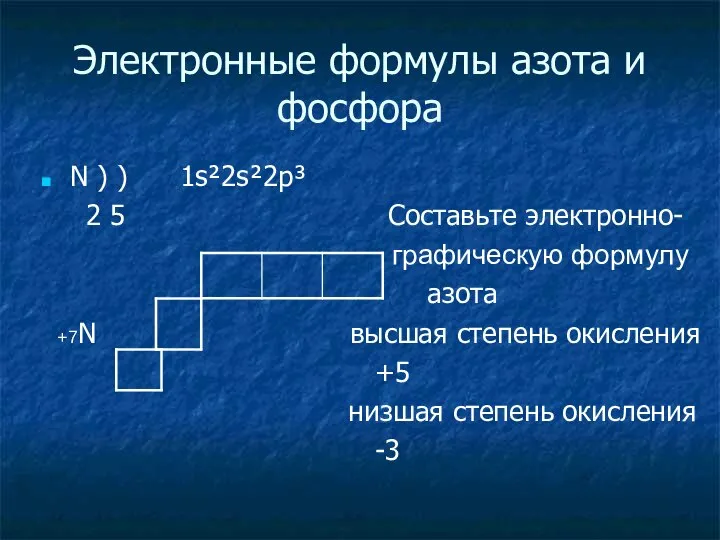
- 4. Электронные формулы азота и фосфора N ) ) 1s²2s²2p³ 2 5 Cоставьте электронно- графическую формулу азота
- 5. Знаете ли вы что … Впервые азот был открыт ученым Д. Резерфордом в 1772г. Свойства исследовали
- 6. Азот. Физические свойства Строение молекулы N2 Структурная формула N Ξ N Электронная формула : N ⋮⋮
- 7. Химические свойства азота При обычных условиях малоактивен При Т=2000º реагирует с кислородом N2 + O2 ↔
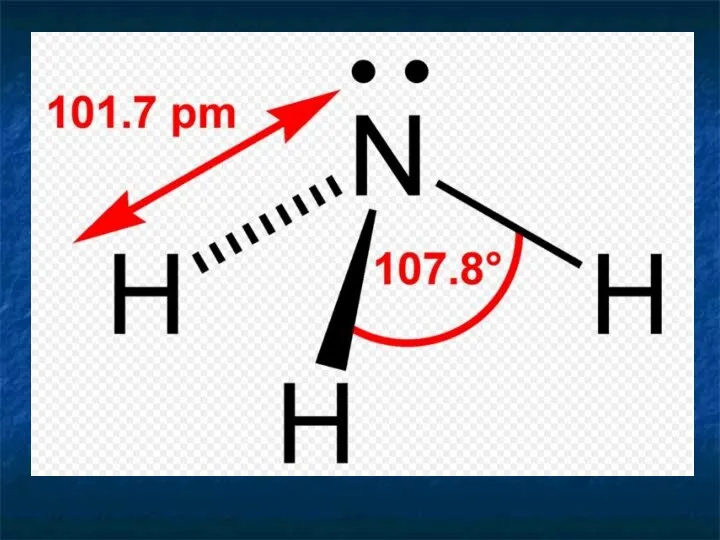
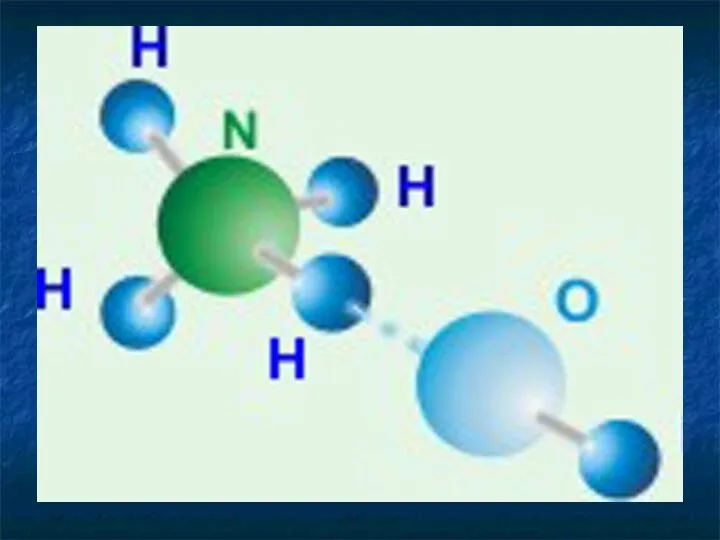
- 8. Аммиак Соединение азота с водородом называется аммиак NH3 Строение молекулы H – N – H |
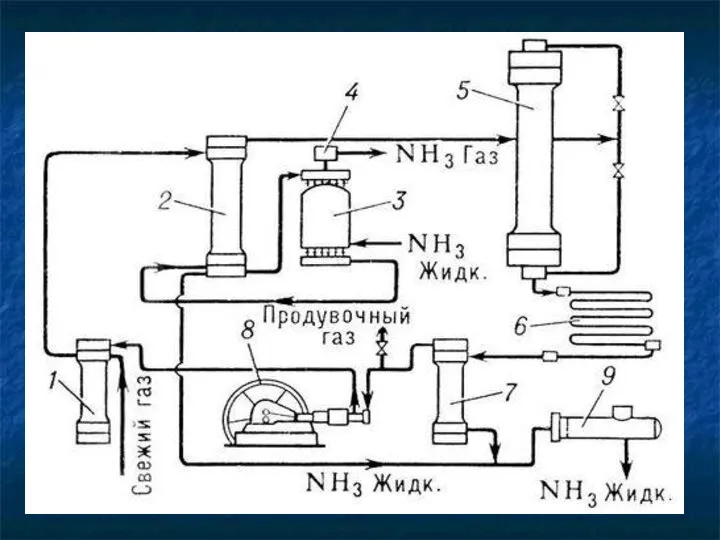
- 10. Получение в промышленности В 1913 году в Германии был создан первый завод каталитического синтеза аммиака N2
- 12. Получение в лаборатории При нагревании смеси солей аммония со щелочами. 2NH4Cl +Ca(OH)2=CaCl2+2NH3↑ +2H2O хлорид аммония аммиак
- 13. Химические свойства Активное вещество Взаимодействует с водой NH3 + H2O ↔ NH4OH гидроксид аммония С кислотами
- 14. Химические свойства Непрочное соединение при нагревании разлагается 2NH3↔N2 + 3H2 Горит ?NH3 + ? O2→ ?
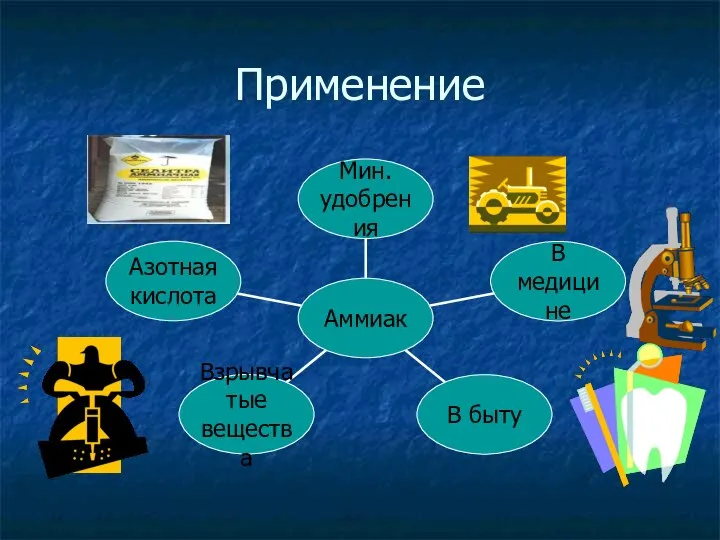
- 15. Применение
- 16. Соли аммония NH3 + HCl = NH4Cl хлорид аммония 2NH3 + H2SO4 = (NH4)2 SO4 сульфат
- 17. Вопросы и упражнения Какие элементы составляют VА группу? Какого строение внешнего электронного слоя атомов азота и
- 18. Вопросы и упражнения Какие соли образует аммиак? Какая реакция является качественной на катион аммония? Где находят
- 19. Упражнения Закончите уравнения реакций N2 + H2 → ? N2 + Ca → ? N2 +
- 20. Упражнение Решить цепочку превращения N2 →NH3 → NH4OH→ NH4Cl →NH3 Решить ОВР NH3 + O2 →
- 21. Оксиды азота Известно несколько оксидов азота
- 22. Азотная кислота Строение молекулы HNO3 O // H – O – N \\ O
- 24. Получение В лаборатории NaNO3 + H2SO4 = NaHSO4 + HNO3↑ нитрат натрия гидросульфат натрия В промышленности
- 25. Физические свойства Бесцветная дымящаяся жидкость с резким запахом. Хорошо растворима в воде. Концентрированная очень опасна. Под
- 26. Химические свойства Общие с другими кислотами .Сильная кислота, диссоциирует полностью HNO3→ H໋ + NO3ˉ Реагируют с
- 27. Специфические свойства При нагревании и на свету разлагается 4HNO3 ↔ 2 H2O + 4NO2↑ + O2↑
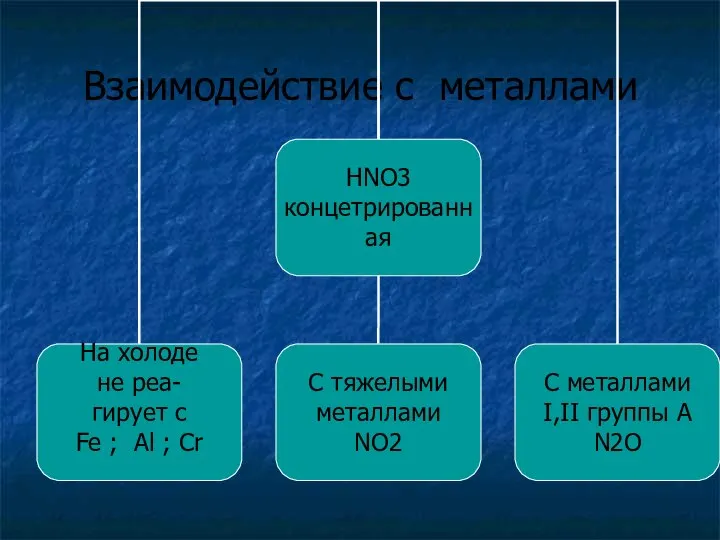
- 28. Взаимодействие с металлами
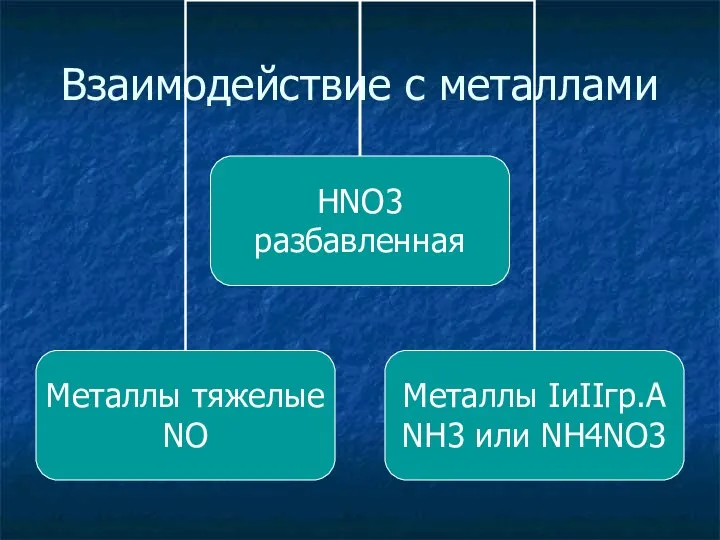
- 29. Взаимодействие с металлами
- 30. Примеры Сu + HNO3 = ? + ? + ? конц Cu + HNO3 = ?
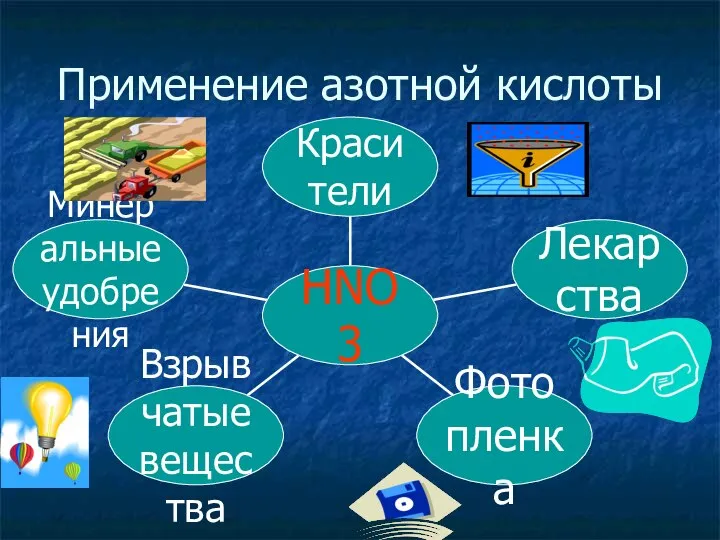
- 31. Применение азотной кислоты
- 32. Соли азотной кислоты Соли азотной кмслоты – нитраты Нитраты калия, натрия, аммония и кальция – называются
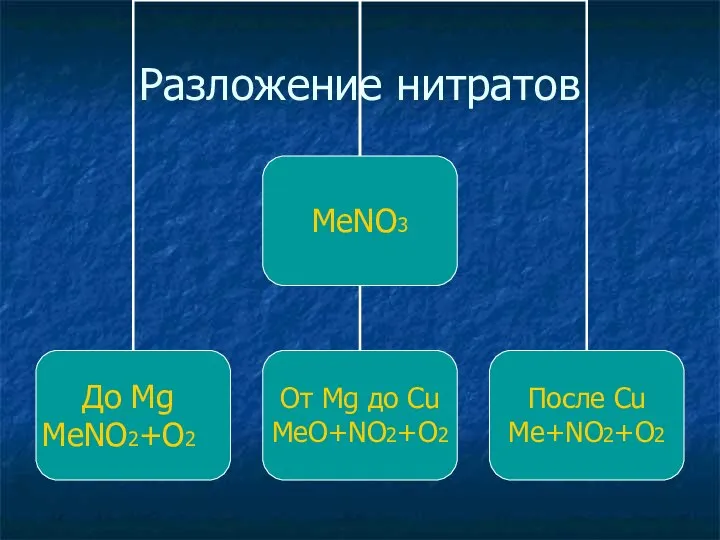
- 33. Разложение нитратов
- 34. Примеры NaNO3 = ? + ? Zn (NO3)2 = ? + ? + ? Ag NO3
- 35. Вопросы и упражнения Какие оксиды азота вам известны? Каковы физические свойства азотной кислоты Опишите химические свойства
- 36. Упражнения Напишите молекулярные и ионные уравнения реакций CaO + HNO3 = NaOH + HNO3 = K2CO3
- 38. Скачать презентацию


























 Алмаз. Алмаз дегеніміз не
Алмаз. Алмаз дегеніміз не Биогенные p-элементы
Биогенные p-элементы Биологическая судьба химических веществ
Биологическая судьба химических веществ Презентация по Химии "Экологические проблемы химии гидросферы" - скачать смотреть
Презентация по Химии "Экологические проблемы химии гидросферы" - скачать смотреть  Соли в свете теории ЭД
Соли в свете теории ЭД Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала
Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала Комплексные соединения. Химическая связь. (Лекция 9)
Комплексные соединения. Химическая связь. (Лекция 9) Получение углекислого газа и изучение его свойств. Взаимопревращение карбонатов и гидрокарбонатов. Практическая работа № 2
Получение углекислого газа и изучение его свойств. Взаимопревращение карбонатов и гидрокарбонатов. Практическая работа № 2 Изготовление мыла в домашних условиях
Изготовление мыла в домашних условиях Ֆլավանոիդներ պարունակող դեղաբույսեր եվ հումք
Ֆլավանոիդներ պարունակող դեղաբույսեր եվ հումք Алмазы, искусственный и естественный рост
Алмазы, искусственный и естественный рост Волокна Презентація на тему:
Волокна Презентація на тему:  8 класс. РЕШЕНИЕ ЗАДАЧ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ
8 класс. РЕШЕНИЕ ЗАДАЧ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте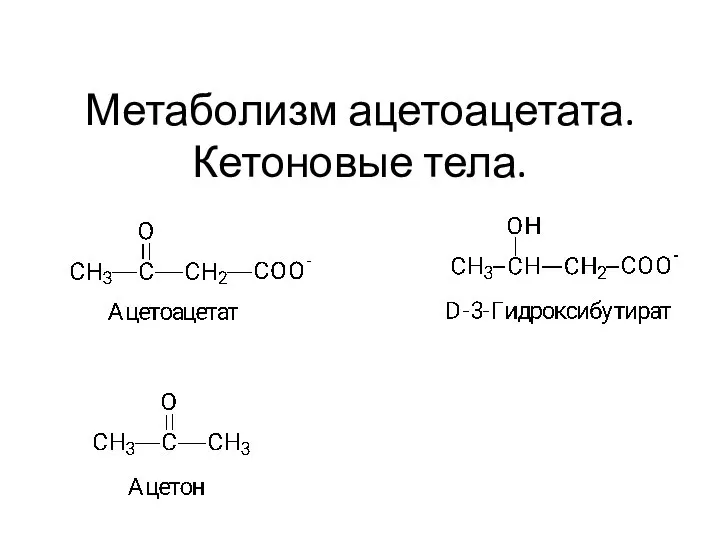 Метаболизм ацетоацетата. Кетоновые тела.Тема 10
Метаболизм ацетоацетата. Кетоновые тела.Тема 10 Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление
Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление Открытия в химии Теория Александра Бутлерова
Открытия в химии Теория Александра Бутлерова Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева
Закон Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона-Менделеева КРУГОВОРОТ ВЕЩЕСТВ В ПРИРОДЕ Маслова А.Л. ГОУ № 483
КРУГОВОРОТ ВЕЩЕСТВ В ПРИРОДЕ Маслова А.Л. ГОУ № 483 Глюконеогенез. Регуляция гликолиза и глюконеогенеза. Цикл кори. Пентозофосфатный путь превращения глюкозы. Спиртовое брожение
Глюконеогенез. Регуляция гликолиза и глюконеогенеза. Цикл кори. Пентозофосфатный путь превращения глюкозы. Спиртовое брожение Кобальт. Нахождение Co в природе
Кобальт. Нахождение Co в природе Радиофармацевтическая химия
Радиофармацевтическая химия Свойства и классификация нефти
Свойства и классификация нефти Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация по Химии "РУДЫ И МИНЕРАЛЫ" - скачать смотреть бесплатно
Презентация по Химии "РУДЫ И МИНЕРАЛЫ" - скачать смотреть бесплатно Реактопласти підготував учень 11-в класу Котенко Роман
Реактопласти підготував учень 11-в класу Котенко Роман  Простые вещества - металлы
Простые вещества - металлы Разработка низкотемпературных порошковых систем для окраски MDF и других диэлектриков
Разработка низкотемпературных порошковых систем для окраски MDF и других диэлектриков