Содержание
- 2. План 1. Строение КС 2. Название КС 3. Химическая связь в КС 4. Диссоциация КС. Константа
- 3. Понятие КС Комплексными называются соединения, в которых есть химическая связь, образованная по донорно-акцепторному механизму. Пример: ион
- 4. Строение КС. Координационная теория А.Вернера. КC состоят из внутренней и внешней сферы(внутренняя сфера заключается в квадратные
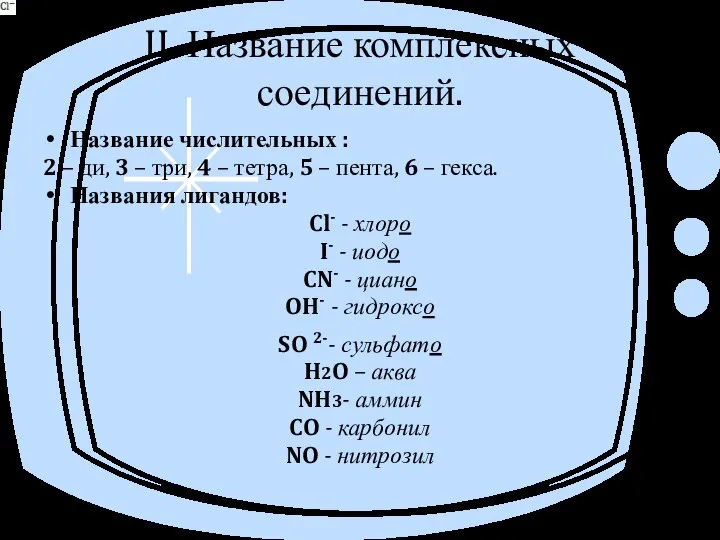
- 5. II. Название комплексных соединений. Название числительных : 2 – ди, 3 – три, 4 – тетра,
- 6. Название КС катионного типа […]+ 1.Внешняя среда 2.Лиганды и их кол-во 3. Центральный ион по-русски в
- 7. Название КС анионного типа […]- 1.Лиганды и их кол-во 2.Центральный ион (лат.) с окончанием «ат» 3.Внешняя
- 8. Название внутрикомплексных солей […]0 1.Лиганды, их кол-во 2.Центральный ион по-русски в именительном падеже Пример : [Pt2+(NH3)2Cl2]0
- 9. Химическая связь в КС. Если КС растворимо в воде, то на внутреннюю и внешнюю сферу оно
- 10. Пример: K2[HgI4] → 2K+ +[HgI4]2- Диссоциация комплексного иона: 1.Ступень первая [HgI4]2- ↔ [HgI3]- + I- ;
- 11. Окислительно-восстановительные реакции (ОВР) План: 1. Понятие ОВР 2. Типичные окислители и восстановители 3. Окислительно-восстановительная двойственность (ОВД)
- 12. Понятие ОВР I. ОВР – реакции, протекающие с изменением степени окисления элементов. Окислители принимают электроны и
- 13. Типичные окислители: Элементы в max степени окисления ( HNO3, KMnO4, K2Cr2O7) степень окисления = номер группы.
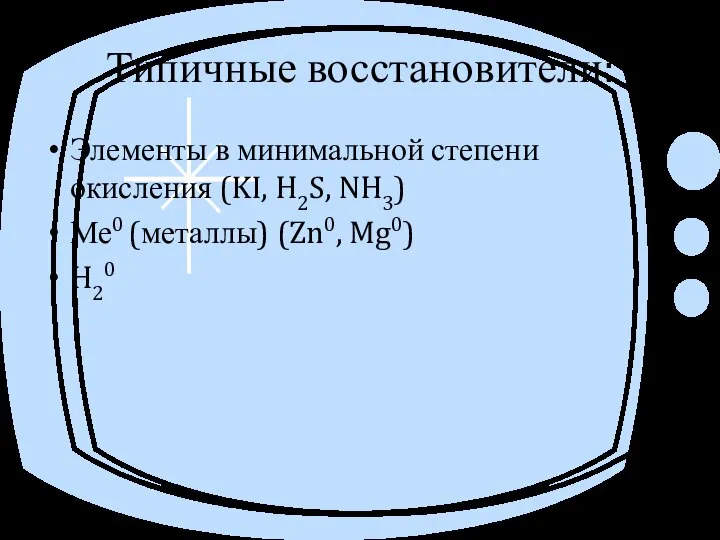
- 14. Типичные восстановители: Элементы в минимальной степени окисления (KI, H2S, NH3) Ме0 (металлы) (Zn0, Mg0) H20
- 15. Окислительно-восстановительная двойственность (ОВД) Элементы в промежуточной степени окисления (HNO2, Na2SO3) Ионы Mem+ в промежуточной степени окисления
- 16. IV. Метод электронного баланса Метод используется, если реакция протекает в газах или в твердой фазе. Пример:
- 17. V. Метод полуреакций Метод полуреакций используется для ОВР, протекающих в водном растворе. В нем выписывается не
- 18. Правила уравнивания атомов «O» и «Н»: а) кислая среда: в той части полуреакции, где мало атомов
- 19. б) нейтральная среда: если справа и слева в полуреакции разное количество атомов «О», то слева всегда
- 21. Скачать презентацию


![Название КС катионного типа […]+ 1.Внешняя среда 2.Лиганды и их кол-во](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1391294/slide-5.jpg)
![Название КС анионного типа […]- 1.Лиганды и их кол-во 2.Центральный ион](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1391294/slide-6.jpg)
![Название внутрикомплексных солей […]0 1.Лиганды, их кол-во 2.Центральный ион по-русски в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1391294/slide-7.jpg)

![Пример: K2[HgI4] → 2K+ +[HgI4]2- Диссоциация комплексного иона: 1.Ступень первая [HgI4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1391294/slide-9.jpg)








 Карбонильные соединения (оксосоединения)
Карбонильные соединения (оксосоединения) Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства
Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства Презентация по Химии "Вода – важнейшая составляющая жизни на Земле" - скачать смотреть
Презентация по Химии "Вода – важнейшая составляющая жизни на Земле" - скачать смотреть  Termodünaamika. Entroopia. (Loeng 8)
Termodünaamika. Entroopia. (Loeng 8) Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Аттестационная работа. Методразработка по проведению исследовательской работы Выращивание кристаллов в домашних условиях
Аттестационная работа. Методразработка по проведению исследовательской работы Выращивание кристаллов в домашних условиях Пластмаси, синтетичні каучуки Виконала: Учениця 11 – А класу Твердохліб Анжеліка
Пластмаси, синтетичні каучуки Виконала: Учениця 11 – А класу Твердохліб Анжеліка  Тема: хімія та їжа
Тема: хімія та їжа Устойчивость дисперсных систем
Устойчивость дисперсных систем Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Сульфаты и оксиды металлов
Сульфаты и оксиды металлов Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов
Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов Структурная химия катионов переходных элементов
Структурная химия катионов переходных элементов Окислительно-восстановительные реакции. Химическое равновесие
Окислительно-восстановительные реакции. Химическое равновесие Силикатное производство
Силикатное производство Амины
Амины Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації в організмі
в організмі  Презентация Углекислый газ СО2
Презентация Углекислый газ СО2  Электролитическая диссоциация
Электролитическая диссоциация Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Биомакромолекулы. Нуклеиновые кислоты
Биомакромолекулы. Нуклеиновые кислоты Изучение свойств природных индикаторов, содержащихся в растениях
Изучение свойств природных индикаторов, содержащихся в растениях Презентация Строение и свойства циклоалканов.
Презентация Строение и свойства циклоалканов.  Композитные материалы
Композитные материалы Дисперсные системы Эмульсии. Пены. Порошки
Дисперсные системы Эмульсии. Пены. Порошки Сложные эфиры. Жиры
Сложные эфиры. Жиры Аттестационная работа. Программа регионального компонента образовательной области Химия
Аттестационная работа. Программа регионального компонента образовательной области Химия