Содержание
- 2. Биогенные элементы – элементы, необходимые для построения и функционирования различных клеток и организмов.
- 3. Критерии биогенности
- 4. 1. Распространенность элемента в природе. Биосфера – часть земной оболочки, занятая растительными и животными организмами.
- 5. Живые организмы активно участвуют в перераспределении элементов в земной коре, например, при построении скелета концентрируют кальций
- 6. Распространенность элементов в земной коре различна. На долю 18 элементов приходится 99,8% массы земной коры. O
- 7. Исследования показали, что в живых организмах присутствуют все те же элементы, которые есть в земной коре
- 8. Чем выше содержание элемента в природе, тем больше его в организме.
- 9. Однако, данная закономерность соблюдается не всегда. Так, в земной коре содержится 27,6% Si, а в организмах
- 10. Наблюдается и обратная картина: Биологическое концентрирование – увеличенное содержание элемента в организме по сравнению с окружающей
- 11. В результате естественного отбора основой живых систем стали 6 элементов-органогенов: углерод, водород, кислород, азот, фосфор, сера.
- 12. Таблица 1
- 13. 2. Растворимость соединений элемента в воде Чем лучше растворимость природных соединений элемента в воде, тем выше
- 14. Таблица 2
- 15. 3. Размеры атомов Чем меньше порядковый номер элемента, тем больше его массовая доля в организме, т.к.
- 16. Таблица 3 99% массы организма составляют элементы с порядковым номером
- 17. 4.Способность приобретать устойчивую электронную конфигурацию Эта способность является причиной прочности связей элемента в соединении и устойчивости
- 18. Элементы 1-3-й групп ПСЭ отдают 1-3 электрона: Na 1s22s22p63s1-1e→Na+ 1s22s22p6 – устойчивая электронная конфигурация, как у
- 19. Элементы 4-7-й групп ПСЭ принимают 4-1 электрона: Cl 1s22s22p63s23p5 +1e→Cl- 1s22s22p63s23p6 – устойчивая электронная конфигурация, как
- 20. 5. Способность к образованию прочных полярных ковалентных связей, кратных связей, созданию сопряженных систем В то же
- 21. У их аналогов из 3-го периода – Si, P, S - эта способность уменьшается и, соответственно,
- 22. 6. Склонность к комплексообразованию максимальна для d-элементов, имеющих большой заряд ядра и значительное количество вакантных орбиталей.
- 23. Катионы “металлов жизни”- Fe, Zn, Cu, Co, Mn, Mo – in vivo соединяются с биолигандами, образуя
- 24. Классификация биогенных элементов 1. По положению в ПСЭ: s-элементы: K, Na, Ca, Mg; p-элементы: O, C,
- 25. 2. По биороли (классификация Ковальского): -жизненно необходимые, дефицит которых приводит к нарушению жизнедеятельности: O, C, H,
- 26. -примесные, присутствуют в организме, но их биороль мало выяснена или до конца не ясна: Ga, Sb,
- 27. 3. По среднему содержанию в организме: -макроэлементы, их ω>10-2%: O, C, H, N, P, S, K,
- 28. -микроэлементы, их ω Fe, Zn, Mo, Mn, Cu, Co, F, Br, I.
- 29. Функции макроэлементов: Построение тканей. Поддержание постоянных: -осмотического давления ( осмотического гомеостаза); -электролитного состава; -рН (кислотно-основного гомеостаза).
- 30. Функции микроэлементов. Микроэлементы входят в состав витаминов, гормонов, ферментов в качестве комплексообразователей и активаторов, участвуют: 1.
- 31. Топография биогенных элементов Распределение элементов в органах и тканях различно. Большинство микроэлементов накапливаются в печени, костной
- 32. Элементы могут проявлять специфическое сродство к некоторым органам и содержаться в них в высоких концентрациях, например,
- 33. Таблица 4
- 34. Макроэлементы О и Н входят в состав воды:ω(Н2О)=65%, она неравномерно распределена в организме.
- 35. Таблица 5
- 36. Макроэлементы O, C, H, N, P, S входят в состав белков, нуклеиновых кислот, липидов, углеводов. Максимальна
- 37. При заболеваниях происходит изменение содержания элементов. Например, при рахите нарушается P-Ca обмен и уменьшается содержание Са
- 38. В организме с участием гормонов поддерживается оптимальный баланс концентраций биогенных элементов – химический гомеостаз.
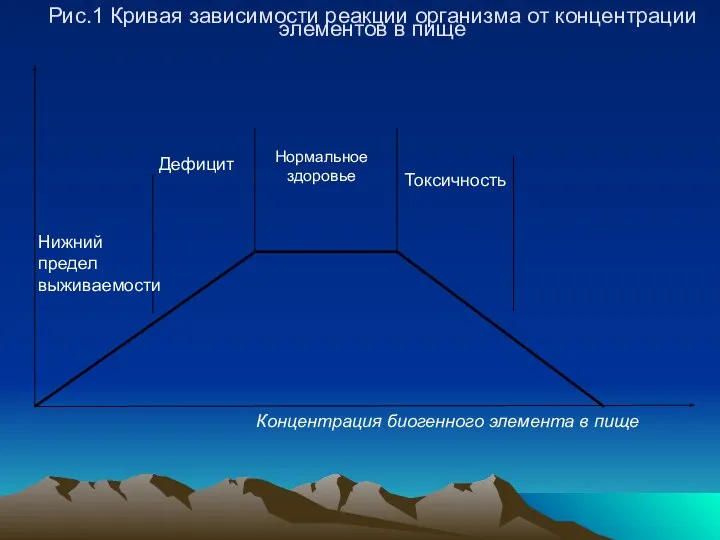
- 39. Рис.1 Кривая зависимости реакции организма от концентрации элементов в пище
- 40. Чем больше горизонтальный участок кривой, тем больше область концентраций, соответствующих нормальному здоровью, росту, воспроизведению, тем менее
- 41. Узкое плато свидетельствует о высокой токсичности элемента и резком переходе от жизненно необходимых количеств к токсичным.
- 42. Значительное увеличение концентраций таких микроэлементов может привести к летальному исходу (Hg 2+ , Pb 2+ ,
- 43. Синергизм и антагонизм действия элементов Сходство и различие биологического действия элементов связано с электронным строением атомов
- 44. Синергизм – усиление биологической активности замещаемого элемента Антагонизм – угнетение активности.
- 45. Примеры: 1. Вe 2+ и Mg 2+ сходны по химическим характеристикам: ⇒Ве 2+ замещает Mg 2+
- 46. 2. Са 2+ и Sr 2+ сходны по строению, взаимозамещаемы: Sr 2+ замещает Са 2+ в
- 47. 3. Mg 2+ и Mn 2+ - синергисты, активируют одни и те же ферменты, например, ферменты,
- 48. 4. d-Элементы IV периода: Mn 2+ , Fe 2+ , Cu 2+ , Co 2+ -
- 49. Эндемические заболевания (микроэлементозы) Биогеохимические провинции – территории, в почвах и водоемах которых содержание химических элементов отличается
- 50. Поскольку содержание элемента в земной коре и в организме человека тесно связано, в организмах людей, проживающих
- 51. Таблица 6
- 53. Скачать презентацию

















































 Электролитическая диссоциация
Электролитическая диссоциация Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Теоретическая электрохимия, часть 1
Теоретическая электрохимия, часть 1 Презентация по Химии "Метан" - скачать смотреть бесплатно
Презентация по Химии "Метан" - скачать смотреть бесплатно Көміртек
Көміртек Как сделать петуха из бумаги
Как сделать петуха из бумаги  Катализ.Лекция
Катализ.Лекция Презентация по Химии "Ацетилен" - скачать смотреть
Презентация по Химии "Ацетилен" - скачать смотреть  Что Вы ожидаете от занятия? Отметьте своё настроение.
Что Вы ожидаете от занятия? Отметьте своё настроение.  Е-числа Підготували учні 11-І класу Черкаської спеціалізованої школи №13 Білокінь Анастасія Левченко Таміла
Е-числа Підготували учні 11-І класу Черкаської спеціалізованої школи №13 Білокінь Анастасія Левченко Таміла  Энергетика и направление химических реакций
Энергетика и направление химических реакций Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония
Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония Металлы. Разнообразие металлов
Металлы. Разнообразие металлов Мембранний транспорт. Рівняння Теорела. Рівняння проникності мембран
Мембранний транспорт. Рівняння Теорела. Рівняння проникності мембран Достижения КГАСУ в области изучения эпоксидных смол
Достижения КГАСУ в области изучения эпоксидных смол Химический диктант. Свойства галогенов
Химический диктант. Свойства галогенов “РОЗЧИННИК”
“РОЗЧИННИК”  Кислород, его общая характеристика и свойства
Кислород, его общая характеристика и свойства Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии
Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии Алкены «Бутен»
Алкены «Бутен» Биологическое окисление
Биологическое окисление Химическая кинетика
Химическая кинетика Биохимия центральной нервной системы
Биохимия центральной нервной системы Международная классификация моторных масел по вязкости в нормах J 300 SAE Ассоциации автомобильных инженеров
Международная классификация моторных масел по вязкости в нормах J 300 SAE Ассоциации автомобильных инженеров Титриметрический анализ
Титриметрический анализ Молярная концентрация вещества в растворе
Молярная концентрация вещества в растворе Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини