Содержание
- 2. Рекомендуемая литература Ротинян А.Л. Теоретическая электрохимия: Учебник / А.Л. Ротинян, К.И.Тихонов, И.А.Шошина - Л.: Химия, 1981.-
- 3. ЭЛЕКТРОХИМИЧЕСКАЯ СИСТЕМА, ЕЕ СОСТАВНЫЕ ЧАСТИ «Электрохимия – это часть химии, изучающая превращения веществ на границе проводник
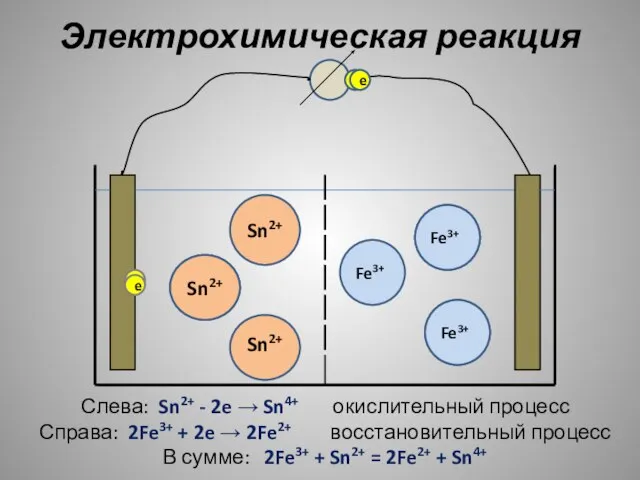
- 4. Fe2+ Fe2+ Sn4+ Fe3+ Fe3+ Sn2+ Sn2+ Fe3+ e e Fe2+ Fe2+ Sn4+ Fe3+ Fe3+ Sn2+
- 5. Sn4+ Sn2+ Sn2+ Fe2+ Fe3+ Fe2+ e e Fe3+ Fe3+ Sn2+ e e Электрохимическая реакция Слева:
- 6. Раздельное протекание реакций окисления и восстановления есть основной признак электрохимической реакции. Электрохимическая система – замкнутая часть
- 7. Электрохимические системы (ячейки), в которых электрохимическая реакция протекает самопроизвольно, т.е. с выделением энергии, могут быть использованы
- 8. Электрохимические системы (ячейки), в которых электрохимические реакции идут с поглощением энергии, называются электролизерами, а процесс, идущий
- 9. Поскольку прохождение электрического тока через электрохимические системы связано с химическим превращением, то должна существовать определенная зависимость
- 10. Первый закон Фарадея устанавливает прямую пропорциональность между количеством прошедшего через систему электричества и количеством прореагировавшего вещества.
- 11. Физический смысл электрохимического эквивалента Kэ– электрохимический эквивалент – количество вещества, вступившего в электрохимическую реакцию при прохождении
- 12. Второй закон Фарадея выражает связь между количеством прореагировавшего вещества при пропускании данного количества электричества и природой
- 13. Например, в свинцовом аккумуляторе происходит реакция: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O. При
- 14. Другими словами, для выделения одного эквивалента вещества, независимо от его природы, необходимо одно и то же
- 15. Если Δm = А, то первый закон Фарадея можно записать: A = Кэ·F, (3) откуда выразим
- 16. Случаи отклонения от законов Фарадея : При переходе электрона из металла в электролит не меняется природа
- 17. Выход по току Универсальность законов Фарадея состоит в том, что если на электроде одновременно протекает несколько
- 18. При этом распределение количества электричества между реакциями зависит от условий электролиза (состава электролита, плотности тока, температуры).
- 19. Поскольку прохождение количества электричества вызывает превращение эквивалентного количества вещества, то выход по току можно определить как
- 21. Скачать презентацию

















 Основания
Основания Анаболические стероиды
Анаболические стероиды Ion exchange
Ion exchange Общая характеристика элементов IIIA-группы. Бор. Алюминий
Общая характеристика элементов IIIA-группы. Бор. Алюминий Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Презентация по Химии "Термодинамика и электрохимия" - скачать смотреть бесплатно
Презентация по Химии "Термодинамика и электрохимия" - скачать смотреть бесплатно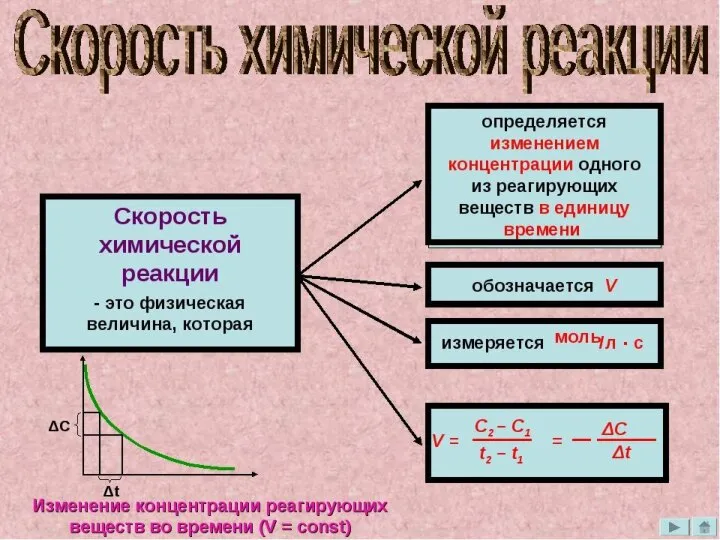 Скорость химичесой реакции и химическое равновесие
Скорость химичесой реакции и химическое равновесие Физические и физико-химические свойства и характеристики грунтов. (Лекция 2)
Физические и физико-химические свойства и характеристики грунтов. (Лекция 2) Металлы, их свойства и область применения
Металлы, их свойства и область применения Сложные эфиры. Жиры
Сложные эфиры. Жиры A quantum computer
A quantum computer Способы выражения состава раствора. Решение задач
Способы выражения состава раствора. Решение задач Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия
Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия Органика вокруг нас
Органика вокруг нас «Контейнерная химия»: комплексоны, комплексообразование, применение
«Контейнерная химия»: комплексоны, комплексообразование, применение Тема: физико-химический анализ хлеба. Цель: Физико - химический анализ разных разных сортов хлеба. Задачи: 1.Определить физико-хими
Тема: физико-химический анализ хлеба. Цель: Физико - химический анализ разных разных сортов хлеба. Задачи: 1.Определить физико-хими Карбоновые кислоты
Карбоновые кислоты Синтетические органические соединения
Синтетические органические соединения Развитие теории восстановления металлов
Развитие теории восстановления металлов Спирты
Спирты Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Увлекательная химия
Увлекательная химия Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Общая химия
Общая химия Презентация по Химии "Кристалл – основа жизни на земле" - скачать смотреть
Презентация по Химии "Кристалл – основа жизни на земле" - скачать смотреть